FARMACI
ANTI-ULCERA
L’ulcera peptica ha un notevole impatto
economico sul sistema sanitario
E’ stato stimato che un Americano su dieci soffre di ulcera
peptica durante il corso della sua vita
.
L’ulcera causa circa 1 milione di ricoveri ospedalieri e 6500
morti ogni anno.
Negli Stati Uniti, la spesa sanitaria per malattie di tipo ulceroso è
stata stimata in circa 6 miliardi di dollari: 3 miliardi per spese
ospedaliere, 2 miliardi per visite mediche private, e 1 miliardo
per scarsa produttività dovuta ai giorni di lavoro persi.
Principali fattori causali dell’ulcera peptica
•Aumento della secrezione di HCl
•Insufficiente protezione della mucosa contro l’acido gastrico
•Infezione da Helicobacter pylori
Farmaci antiulcera
•Farmaci antiacidi
•H2 antagonisti
•Inibitori della pompa protonica
•Farmaci vari (antimuscarinici, antigastrinici, proteggenti della mucosa)
•Farmaci antimicrobici
Farmaci Antiacidi
Sono farmaci sintomatici, non curativi, usati per neutralizzare
l’iperacidità gastrica.
Possibili limiti ed effetti indesiderati:
•Alcalosi sistemica
•Azione sulla peristalsi intestinale
•Formazione di anidride carbonica
•“Ritorno acido”
Farmaci Antiacidi
Sistemici: sodio bicarbonato
Può provocare alcalosi sistemica, eruttazioni gassose con
dilatazione della parete gastrica, “ritorno acido”
Non sistemici: ossidi, idrossidi, sali inorganici ed organici
del calcio, del magnesio, del bismuto e dell’alluminio.
Es.: Magaldrato (Riopan®): [Al5Mg10(OH)31(SO4)2] idrato
Antagonisti H2 : Introduzione
• I recettori H2 sono accoppiati alla proteina G, e si trovano
principalmente nelle cellule parietali (localizzate nella
mucosa del fondo e nel corpo dello stomaco). I recettori H2
sono anche presenti nel muscolo liscio vascolare e
bronchiale, ma gli H2 antagonisti hanno effetti estremamente
limitati in tali distretti.
• La stimolazione dei recettori H2 della parete da parte
dell’istamina aumenta cAMP intracellulare che, a sua volta,
attiva l’enzima H+/K+ ATPasi contenente un gruppo tiolico,
enzima noto come pompa protonica. Ciò determina attiva
secrezione di acido gastrico.
• Oltre all’istamina, anche la gastrina e l’acetilcolina (che
mobilitano entrambe il Ca+2 intracellulare) stimolano le
cellule parietali a secernere acido attraverso l’attivazione
dell’enzima H+/K+ ATPasi.
Antagonisti H2 : Farmacologia
• Secrezione di acido gastrico
• Gli antagonisti H2 inibiscono in maniera competitiva e
dose-dipendente la secrezione di acido gastrico indotta
dall’istamina.
• In minor misura questi agenti inibiscono anche la
secrezione acida indotta da gastrina e Ach
• Gli antagonisti H2 inibiscono sia la secrezione basale che
quella notturna, come pure quella stimolata dal cibo
• Diminuiscono anche la secrezione del fattore intrinseco,
ma non in misura tale da compromettere l’assorbimento
della vitamina B12
Antagonisti H2 : SAR
R1
R2
HN
R3
N
• La struttura degli antagonisti H2 è prevalentemente
idrofila e, a differenza degli H1 antagonisti, deve essere
"istamino-simile"
• Non
possono
presentare cariche positive in
corrispondenza dell’area molecolare in cui l’istamina è
cationica, anche se cationi sono permessi a livello
dell’anello imidazolico
• Vengono progettati e sintetizzati come modificazioni
strutturali dell’agonista, istamina. La sintesi del primo H2
antagonisa, la Cimetidina (Tagamet) è stato uno dei
primi tentativi di vero rational drug design che ha avuto
successo
Antagonisti H2 : SAR
R1
R2
HN
R3
N
• L’anello imidazolico non è fondamentale per l’attività.
Altri sistemi aromatici, purchè provvisti di carattere
basico, possono portare ad inibitori attivi
• Se l’anello imidazolico è presente, la struttura deve
promuovere e mantenere il tautomero N-H perché
l’antagonista sia riconosciuto dal recettore e possa legarsi
ad esso (ricorda che questo è il tautomero dell’istamina
che inizialmente si lega al recettore)
• Il tautomero N-H deve essere evitato a tutti i costi,
altrimenti si avrà la stimolazione del recettore, mentre
invece vogliamo che questi composti antagonizzino il
recettore H2!
Antagonisti H2 : SAR
R1
R2
HN
R3
N
• R1: Deve essere un gruppo ad effetto +I per spingere
elettroni verso l’anello e così favorire il tautomero N-H a
spese del tautomero N-H.
• CH3 è l’unico gruppo usato come R1. E’ elettrondonatore e
piccolo, per cui minimizza l’impedimento sterico nel binding
al recettore
• R2: Deve essere un gruppo ad effetto -I per tirare via
elettroni da N. Anche questo effetto favorisce il tautomero
N-H
• R2 deve avere dimensioni equivalenti a quelle di una catena
butilica al fine di mantenere la giusta distanza tra l’anello
aromatico ed R3 (due gruppi importanti per il binding
recettoriale)
Antagonisti H2 : SAR
R1
R2
HN
R3
N
• Il sostituente R2 è comunemente rappresentato da un gruppo
etiltiometile (-CH2-S-CH2-CH2-) perché S ha effetto -I e
presenta approssimativamente le stesse dimensioni di un
gruppo CH2
• La posizione ottimale per S in questa catena è ad un
atomo di carbonio di distanza dall’anello. In tal modo:
• S è abbastanza vicino all’anello per esplicare l’effetto induttivo
elettronattrattore (favorendo N-H) ma non è coniugato con
l’anello, pertanto il suo doppietto elettronico non può avere
effetto +R (il che favorirebbe N-H)
• S può anche avere un ruolo importante nel permettere il giusto
posizionamento reciproco di R3 e dell’anello per avere la
massima affinità di binding
Antagonisti H2 : SAR
eR1
S
HN
R3
L'effetto i ndutti vo el ettronattrattore
dell 'atomo di S aumenta l a potenza
H2 antagonista
Favori sce il tautomero NH
N
eR1
N
S
NH
R3
L'effetto el ettrondonatore per
ri sonanza di mi nui sce l a potenza H 2
antagonista
Favori sce il tautomero NH
Antagonisti H2 : SAR
R1
R2
HN
R3
N
• R3: deve essere polare ma non-cationico
• All’inizio fu provato il gruppo guanidinico, ma non risultò
efficace a causa della basicità eccessiva. Dava origine ad un
catione, con conseguente azione H2 agonista
N
H
C
NH2
NH2
acido molto debole
pKa - 13
N
H
C
NH2
NH
base molto forte
Antagonisti H2 : SAR
R1
R2
HN
R3
N
• Come gruppo R3 fu poi provato un residuo tioureico
NH
C
NH2
S
• Lo zolfo attrae elettroni dagli atomi di azoto dell’urea, che
perciò non è basica e non dà origine a cationi a pH 7.4.
• Questo composto presentava buona attività H2 antagonista,
ma risultò molto tossico (produceva agranulocitosi)
Antagonisti H2 : SAR
R1
R2
HN
R3
N
• Si ebbe successo con l’uso di altri gruppi elettronattrattori che
permisero di eliminare la basicità della guanidina
NH
C
NO2
C
NH2
NH
N
C
C
NH2
N
1,1-Diamminonitroetene
Cianoguanidina
• Si pensa che il gruppo NH della guanidina formi legame a
idrogeno con il recettore H2
• L’aggiunta di un CH3 all’azoto della guanidina modificata
determina un aumento nel carattere lipofilo della molecola, che
favorisce l’antagonismo H2. L’introduzione di questo CH3
permette di ottenere un certo bilanciamento idrofilo/lipofilo in
queste molecole molto polari
Antagonisti H2 : Prodotti
H
N
H3C
S
HN
N
H
N
N
C
H3C
CH3
N
O
N
S
CH3
N
NH2
S
S
Famotidina
CH3
Ranitidina
NH2
N
H
N
NO2
Cimetidina
H2N
H
N
N
O2
S
H3C
NH2
H
N
N
N
CH3
S
H
N
CH3
S
NO2
Nizatidina
Antagonisti H2 : Prodotti
Indicazioni: ulcera duodenale; ulcera gastrica benigna;
riflusso
gastro-esofageo
(RGE);
condizioni
di
ipersecrezione patologica; prevenzione di emorragie del
tratto gastrointestinale superiore
Forme Farmaceutiche: compresse; capsule (Nizatidina);
polvere per sospensione orale (Famotidina); sciroppi
(Ranitidina); soluzioni per iniezione ed infusione
Antagonisti H2 : Prodotti
H
N
H3 C
1. Cimetidina (Tagamet)
H
N
S
HN
N
C H3
N
C
N
Note SAR
• L’anello aromatico imidazolico ha carattere basico
• R1 = CH3: gruppo +I che favorisce il tautomero N-H
richiesto per il riconoscimento da parte del recettore H2 ma
non per l’attivazione del recettore
• R2 = etiltiometile: gruppo -I che favorisce la forma
tautomerica N-H; isosterico con la catena butilica
separazione ottimale tra l’anello aromatico e R3
• R3 = cianoguanidina: polare, ma neutra. 100% di forma nonionizzata a pH 7.4, il che assicura un effetto antagonista puro,
senza alcuna azione agonista
• N-CH3 aumenta il carattere lipofilo, con conseguente
aumento di attività
Antagonisti H2 : Prodotti
1. Cimetidina (Tagamet)
H
N
H3 C
H
N
S
HN
N
C H3
N
C
N
• Interazioni farmaco-farmaco
• La Cimetidina inibisce il citocromo P450 (CYP450)
• Provoca un aumento significativo della durata di azione di
altri farmaci cosomministrati che vengono metabolizzati dal
CYP450
• L’anello imidazolico è implicato in questo tipo di attività.
L’atomo di azoto dell’imidazolo complessa il Fe+2 dell’eme
che è associato all’enzima CYP450.
• Anche il CYP3A4 ed altre isoforme dell’enzima vengono
inibite, aumentando il rischio di interazioni farmacofarmaco.
Antagonisti H2 : Prodotti
H
N
H3 C
1. Cimetidina
(Tagamet)
H
N
S
HN
N
C H3
N
C
N
• Altri Effetti Indesiderati
• Effetti collaterali antiandrogenici possono causare
ginecomastia ed impotenza
• Ha maggiore propensione rispetto ad altri H2 antagonisti a
provocare effetti sul SNC (e.g. confusione mentale)
• Gli antiacidi riducono l’assorbimento po della Cimetidina.
Dal momento che i pazienti assumono sia antiacidi che H2
antagonisti per il trattamento di RGE o altri disturbi gastrici,
questo è un aspetto da considerare attentamente
• Nel caso di cosomministrazione, antiacidi e H2 antagonisti
dovrebbero essere assunti a distanza di almeno un’ora gli uni
dagli altri.
Antagonisti H2 : Prodotti
2. Ranitidina
(Zantac)
H
N
O
H3 C
N
H
N
S
CH3
CH3
NO
Note SAR:
• L’anello aromatico del furano con la catena laterale basica
dimetilamminometilica è considerato isostere dell’imidazolo
• Presenta tra Ar and R3 una catena stericamente equivalente ad
un butile ma con effetto elettronattrattore
• R3 è un gruppo diamminonitroetilenico: polare, ma nonionizzabile
• Vantaggi della Ranitidina rispetto alla Cimetidina:
• La potenza è aumentata di 4-10X
• La catena laterale basica permette la formazioni di sali
idrosolubili
• Non ha un anello imidazolico, per cui non inibisce CYP450
2
Antagonisti H2 : Prodotti
N H2
3. Famotidina
(Pepcid): H2 N
O2
S
N
N
S
N H2
N
N H2
S
Note SAR:
• Il gruppo guanidinico sull’anello tiazolico fornisce il centro
basico necessario in questi composti
• Non ha il gruppo metilico sull’azoto terminale
• La potenza è 40-60X quella della Cimetidina e 9-15X quella
della Ranitidina
• La Famotidina ha un indice terapeutico analogo a quello
della Ranitidina
• Non ha l’imidazolo, quindi non inibisce CYP450.
• Minori interazioni farmaco-farmaco rispetto alla
Cimetidina
Antagonisti H2 : Prodotti
4. Nizatidina
(Axid)
H
N
N
H3 C
S
N
CH3
H
N
CH3
S
NO2
Note SAR:
• La Nizatidina presenta l’anello aromatico tiazolico della
Famotidina ed i gruppi dimetilamminometilico e
diamminonitroetilenico della Ranitidina
• Possiede attività comparabile a quella della Ranitidina, ma
migliore biodisponibilità dopo somministrazione orale
• La sua potenza è 5-18X quella della Cimetidina
• Non inibisce CYP450
• E’ un’ammina terziaria, perciò può formare sali idrosolubili
Antagonisti H2 : Sintesi
1. Cimetidina (Tagamet)
Antagonisti H2 : Sintesi
2. Ranitidina HCl (Zantac)
(CH 3) 2NH
condensazione
HCl + (CH 2O)x +
paraformaldeide
OH
O
(CH 3) 2N
di Mannich
furfurolo
NH2
HCl
(CH 3) 2N
SCH3
NHCH 3
S
O
cisteamina cloridrato
OH
5-dimetilaminometilfurfurolo
O2N
HS
O
NH2
N-metil-1-metiltio2-nitroetenamina
NO2
(CH 3) 2N
O
S
N
H
N
H
CH3
ranitidina
Chi desidera conoscere la sintesi della Famotidina e della Nizatidina può consultere: A. Kleeman, J. Engel et al. Pharmaceutical Substances,
3rd edition, Thieme
Inibitori della Pompa Protonica (PPI):
Introduzione
• Come già detto, la secrezione di acido gastrico da parte delle
cellule parietali è regolata dall’enzima H+/K+-ATPasi (pompa
protonica).
• Poiché l’attivazione della pompa protonica è l’ultimo stadio del
processo di secrezione acida, l’inibizione di questo enzima
bloccherà la secrezione acida indotta da qualunque mediatore
chimico (istamina, gastrina o ACh). Gli inibitori della pompa
protonica bloccano anche la secrezione basale di acido gastrico,
per cui sono degli agenti terapeutici molto potenti e di ampia
portata.
• Studi su soggetti affetti da RGE hanno mostrato che si può
avere migliore cicatrizzazione dell’esofago con gli inibitori della
pompa protonica rispetto agli H2 antagonisti.
PPI: Introduzione
• I PP inibitori bloccano l’effetto di tutti gli agenti stimolanti la
secrezione gastrica, inclusa la gastrina, per cui determinano
aumento della secrezione di gastrina con conseguente
ipergastrinemia ed iperplasia delle cellule enterocromaffinosimili del fondo gastrico. Fortunatamente non si è osservata
nell’uomo la progressione dei carcinomi dello stomaco vista
negli animali.
.
PPI: Chimica
• I PPI agiscono formando un ponte disolfuro (legame covalente)
con l’enzima. Per fare ciò devono contenere un atomo di zolfo
capace di formare tale legame con un gruppo SH dell’enzima.
• L’enzima H+/K+-ATPasi presenta 37 residui CYS, in particolare
la CYS813 che si pensa formi il legame covalente con i PPI si
trova in un loop extracitoplasmatico tra la 5° e la 6° regione
transmembranaria della proteina.
• Questo residuo critico di CYS è affiancato da aminoacidi
anionici alle posizioni 820 e 824. Il loro compito è trattenere gli
inibitori cationici attraverso un’interazione ione-ione, che
consente di posizionare correttamente il farmaco ai fini del suo
legame irreversibile con il residuo di CYS.
PPI: Chimica
• Derivati benzimidazolici sostituiti (e.g., solfinilbenzimidazoli)
sono il prototipo dei PPI. Tutti contengono un anello piridinico
basico che si protona nel fluido gastrico, permettendo il legame
del farmaco ai residui anionici dell’enzima.
• Questi composti contengono anche un atomo di zolfo (il gruppo
solfinile), ma sono dei profarmaci inattivi.
• Quando vengono attivati per protonazione, essi subiscono una
serie di riarrangiamenti non-enzimatici che rendono reattivo
l’atomo di zolfo, che a sua volta si lega covalentemente al
gruppo SH della CYS813 dell’ ATPasi.
• Una volta che si è formato il ponte disolfuro, l’ H+/K+-ATPasi è
inattivata irreversibilmente, per cui i PPI hanno una lunga durata
di azione
PPI: Meccanismo di attivazione
MeO
MeO
Me
Me
MeO
Me
H+
N
N
S
MeO
Me
Me
N
H
O
N
MeO
H
Omeprazolo
MeO
Me
Me
Me
N
N
S
H
O
N
MeO
H
Forma protona ta attivata
N
N
S
H
O
N
N
N
MeO
H
H
Interme dio spiro labile
H2O
MeO
MeO
Me
Me
S
N
N
NH
MeO
Me
S
Enz
Me
Enz-SH
Me
Me
N
N
N
N
S
N
H2O
S OH
N
H
MeO
OMe
OMe
Solfe namide
Enzima inattivato
Enz-SH
Forma zione de l ponte disolfuro
S OH
OH
Ac ido solfenico
PPI: Meccanismo di azione
PPI: Metabolismo dell’Omeprazolo
MeO
MeO
Me
Me
N
N
S
O
Me
CYP2C19
N
O-de alchilazione
N
N
MeO
Omeprazolo
O
H
Fenolo (inattivo)
ossidazione
riduzione
MeO
MeO
Me
Me
Me
N
Me
N
N
MeO
S
N
HO
H
CYP3A4
Me
S
O
N
O
N
H
Solfone (ina ttivo)
MeO
S
N
H
Tioe tere (inattivo)
PPI: Metabolismo del Pantoprazolo
MeO
HO
OMe
N
N
F2 HCO
S
N
H
Pantoprazolo
O
OMe
CYP2C19
N
O-dealchilazione
N
F2 HCO
S
N
H
Fenolo (inattivo)
O
PPI: Metabolismo del Rabeprazolo
OMe
O
OH
O
OMe
OMe
CYP2C19
N
O-de alchilazione
N
N
N
S
O
N
S
O
N
ossidazione
N
OMe
O
O
S
H
Aldeide (inattiva)
Aldeide
ossidasi
ossidazione
riduzione
OMe
O
OMe
O
O
OMe OH
OMe
N
N
N
S
N
S
O
N
Solfone (ina ttivo)
O
N
N
H
O
N
Alcol (inattivo)
ossidazione
N
S
H
Rabepra zolo
N
OMe H
Alcol
de idroge nasi
N
H
CYP3A4
O
O
H
Tioe tere (inattivo)
H
Ac ido c arbossilico (inattivo)
PPI: Interazioni tra farmaci
•I PP inibitori si legano in misura notevole alle proteine
sieriche e vengono estesamente trasformati dal sistema
enzimatico CYP450 (in particolare le isoforme 2C9 e
3A4) in metaboliti inattivi.
•Alcuni composti (specialmente il farmaco originario
omeprazolo) inibiscono queste isoforme e possono dare
importanti interazioni farmaco-farmaco
PPI: Sintesi dell’Omeprazolo
OCH 3
H3 C
OCH 3
CH3
N
(CH 3CO) 2O
H3 C
OCH 3
CH3
CH3
O
N
H3 C
NaOH
CH3
CH3
OH
N
O
O
SOCl 2
SK
NH2
CH3 O
OCH 3
S
N
OC2H 5
NH2
(potassio etil
xa ntoge nato)
H3 C
SH
N
H
CH3 O
N
NaOH
OCH 3
H3 C
O
CH3
N
N
S
NH
CH3 O
O
O
OH
OCH 3
H3 C
CH3
Cl
N
MCPBA
N
(acido metacloroperbe nzoico)
S
NH
CH3 O
Omeprazolo
CH3
Cl
Dexlansoprazole
Dexlansoprazole (INN, trade name Kapidex) is a proton pump inhibitor that is marketed by Takeda
Pharmaceuticals. Chemically, it is an enantiomer of lansoprazole. The compound was launched in the US
for use in the treatment and maintenance of patients with erosive oesophagitis and non-erosive gastrooesophageal reflux disease (GERD or GORD).[1] Dexlansoprazole was approved by the U.S. Food and
Drug Administration (FDA) on January 30, 2009After racemic lansoprazole is applied orally, 80% of the
circulating drug are dexlansoprazole. Moreover, both enantiomers have a similar effect on the proton
pump.Consequently, the main advantage of Kapidex is not the enantiopure substance, but the
pharmaceutical formulation.
Kapidex is based on a dual release technology, with the first quick release producing a plasma peak
concentration about one hour after application, and the second retarded release producing another peak
about four hours later.As of November 2009, clinical relevance of this form of release has yet to be shown.
KAPIDEX may not be right for everyone. You should not take KAPIDEX if you are allergic to KAPIDEX
or any of its ingredients. Severe allergic reactions have been reported. Symptom relief does not rule out
other serious stomach conditions. The most common side effects of KAPIDEX were diarrhea (4.8%),
stomach pain (4.0%), nausea (2.9%), common cold (1.9%), vomiting (1.6%), and gas (1.6%). KAPIDEX
and certain other medicines can affect each other.
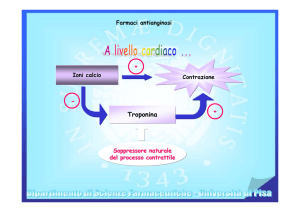
Farmaci Vari
Farmaci antiulcera che operano con meccanismi diversi da
quelli finora considerati:
•Pirenzepina è un antimuscarinico selettivo per i recettori della
mucosa gastrica: riduce la secrezione sia di HCl che di pepsina
•Proglumide è un inibitore della gastrina che riduce il volume,
l’acidità ed il potere proteolitico del succo gastrico
•Gefarnato è un antiulceroso ad azione protettiva e trofica sulla
mucosa gastrica e duodenale con meccanismo analogo a quello
fisiologico
•Misoprostolo è un analogo sintetico della PGE1 usato come
agente antisecretorio gastrico con effetti protettivi sulla mucosa
gastroduodenale
MISOPROSTOLO:
è un analogo di una prostaglandina (PGE1) inibisce la
secrezione gastrica e stimola la produzione di muco
gastrico.
Inibisce la secrezione acida basale
Stimola il recettore EP3 e induce la
secrezione di muco e bicarbonati
L’indicazione terapeutica principale è la
gastroprotezione in corso di terapia cronica
con FANS
Farmacocinetica
E’ rapidamente assorbito per orale ed va
incontro ad un elevato effetto di primo
passaggio (produzione di un metabolita attivo);
L’effetto è di circa 3 ore;
L’eliminazione avviene per via renale.
Effetti collaterali:
Diarrea e dolore addominale, che può causare la
sospensione del farmaco in circa il 50% dei
pazienti
Assolutamente controindicato in gravidanza:
provoca aborto o parto prematuro per induzione
della contrattilità uterina
Ulcera gastroduodenale: malattia infettiva?
Nel 1893 Giulio Bizzozero aveva osservato, nello stomaco di
cani, la presenza di batteri; ma la sua logica deduzione, cioè che
un agente infettivo potesse essere la causa dell’ulcera, era
completamente sovrastata dall’assioma "niente acido, niente
ulcera" per cui la presenza di batteri nello stomaco non era altro
che la conseguenza di contaminazione post-mortem.
Questo concetto di sterilità dello stomaco, come conseguenza del
succo gastrico, è perdurato per decenni, fin quando Peter Lewin
ha dimostrato che la mucosa gastrica può essere colonizzata
dall’Helicobacter pylori.
Cosa è e cosa fa l’Helicobacter pylori
E’ un batterio di 0,2-0,5 µm di lunghezza, spiraliforme, che si
localizza negli strati profondi del gel di muco che riveste la mucosa
gastrica e sulla superficie apicale delle cellule epiteliali della
mucosa.
http://www.cellsalive.com/helico.htm
http://www.hpylori.com.au/
Cosa è e cosa fa l’Helicobacter pylori
Esso produce una varietà di proteine che sembrano mediare o
facilitare il danno che provoca alla mucosa gastrica:
*
l’ureasi prodotta da H. pylori catalizza l’idrolisi di urea
per formare ammoniaca e anidride carbonica; ciò rende il
microambiente più alcalino, il che protegge il batterio dagli effetti
dell’acido gastrico e impedisce la colonizzazione di altri batteri.
L’ureasi altera le cellule epiteliali mucose a causa degli ioni OH–
generati dalla reazione tra acqua e ammoniaca.
*
superossidi, proteasi e fosfolipasi che degradano il
complesso glicoproteine-lipidi dello strato di gel mucoso; ciò
riduce lo spessore e la viscosità del gel di muco gastrico
protettivo che sovrasta le cellule della mucosa gastrica
Cosa è e cosa fa l’Helicobacter pylori
Una volta colonizzato lo stomaco, l’H. pylori esercita, quindi,
sulla mucosa gastrica, sia un danno diretto, attraverso le sostanze
su elencate, sia un danno mediato dalla risposta immune
dell’ospite, innescata dall’attivazione di cellule immunitarie da
parte dell’ureasi e delle altre proteine batteriche.
Ruolo dell’ H. pylori nella malattia ulcerosa
Esistono almeno 4 osservazioni che sostengono l’ipotesi che H.p.
sia il principale fattore eziologico dell’ulcera peptica:
*
*
*
*
la maggioranza dei pazienti con ulcera duodenale o
gastrica hanno un’infezione da H.p. (le statistiche attuali
dicono che è presente nel 92% dei casi di ulcera
duodenale, nel 65% dei casi di ulcera gastrica, dal 40 al
75% dei casi di carcinoma gastrico)
l’ulcera duodenale si sviluppa con maggiore frequenza nei
soggetti con infezione da H.p.
le recidive sono state marcatamente ridotte dalla terapia di
eradicazione dell’infezione da H.p.
H.p. è la causa, o una delle principali cause, di una forma
di gastrite detta gastrite cronica attiva, in cui è stato
riscontrato praticamente nel 100% dei casi.
Ruolo dell’ H. pylori nella malattia ulcerosa
In realtà ci sono vari dati che tendono a ridimensionare il ruolo
svolto dal batterio nella genesi dell’ulcera.
In primo luogo solo il 15-20% dei pazienti con infezione da H.p.
sviluppa un’ulcera peptica; ciò significa che la maggior parte dei
pazienti con colonizzazione gastrica non sviluppa mai l’ulcera e
resta asintomatica: perché?
Come si spiega la frequente presenza del batterio in soggetti
asintomatici per altro sani?
Si deve dedurre che esistono ceppi (tipi) di H.p. saprofiti (non
patogeni) e ceppi patogeni? o i saprofiti diventano patogeni in
determinate condizioni?
Ruolo dell’ H. pylori nella malattia ulcerosa
La " quasi totalità" dei pazienti affetti da ulcera ha un’infezione da
H.p.: ciò significa che esiste una pur piccola percentuale di
pazienti ulcerosi che non hanno un’infezione da H.p.: come si
spiega?
L’eradicazione dell’infezione da H.p. richiede di associare alla
terapia tradizionale uno o più antibiotici per ottenere questo scopo:
ma, in pratica, quanti pazienti seguono la terapia correttamente?
Alla luce di queste osservazioni si può concludere che il ruolo di
Helicobacter pylori nello sviluppo dell’ulcera peptica non è certo
quello dell’attore protagonista, e che la sua presenza in scena
riflette soltanto un’associazione commensale estremamente
frequente.
Farmaci Antimicrobici
La terapia ottimale dei pazienti con ulcera peptica infetti da
Helicobacter pylori richiede il trattamento antimicrobico con
varie associazioni di antibiotici e chemioterapici, ad es.:
•Bismuto, metronidazolo, tetraciclina (cui spesso si aggiunge
un antisecretivo)
•Metronidazolo, amossicillina (più omeprazolo)
N
O2N
N
CH3
OH
Metronidazolo