Reattività del carbonio sp3
Idrocarburi saturi o alcani – proprietà fisiche
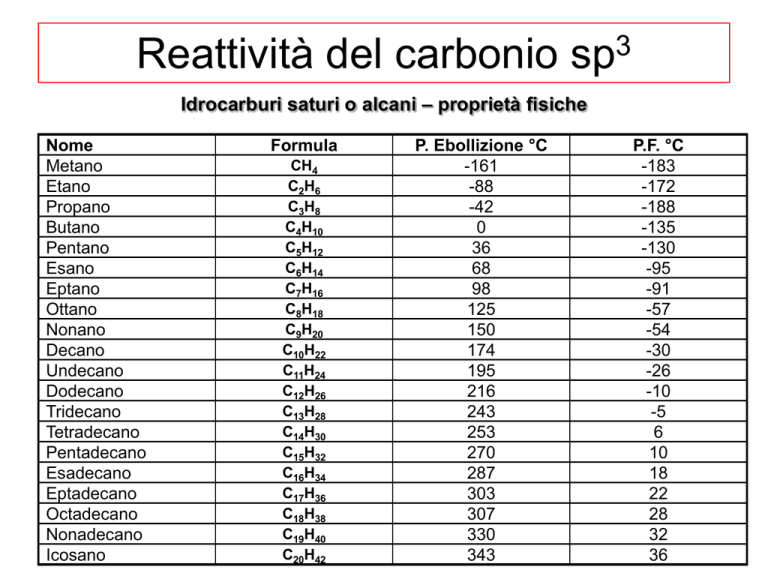
Nome
Metano
Etano
Propano
Butano
Pentano
Esano
Eptano
Ottano
Nonano
Decano
Undecano
Dodecano
Tridecano
Tetradecano
Pentadecano
Esadecano
Eptadecano
Octadecano
Nonadecano
Icosano
Formula
CH4
C2H6
C3H8
C4H10
C5H12
C6H14
C7H16
C8H18
C9H20
C10H22
C11H24
C12H26
C13H28
C14H30
C15H32
C16H34
C17H36
C18H38
C19H40
C20H42
P. Ebollizione °C
-161
-88
-42
0
36
68
98
125
150
174
195
216
243
253
270
287
303
307
330
343
P.F. °C
-183
-172
-188
-135
-130
-95
-91
-57
-54
-30
-26
-10
-5
6
10
18
22
28
32
36
Reazioni del metano
A temperatura ambiente il metano non reagisce né con acidi forti né con basi forti.
La differenza di elettronegatività tra C e H è piccola per polarizzare il legame
covalente e attrarre cariche per dare reazioni.
Il carbonio è al massimo stato di riduzione e non può essere ridotto ulteriormente;
Neanche gli ossidanti comuni reagiscono col metano a temperatura ambiente.
È un idrocarburo saturo (o anche paraffina), cioè poco reattivo.
reazioni con il cloro , Cl
CH4 + Cl2
DH° = -113 kJ/mole
DG°
CH3Cl + HCl
DS° = -0,03 kJ/(mole°K)
= DH° + T DS° = -104 kJ/mole
(a25°C)
Keq = 2 x 1018
La reazione è termodinamicamente favorita, ma non avviene a causa
dell’energia di attivazione elevata
CLORURAZIONE DEL METANO
Se si irradia una miscela di metano e cloro con radiazione ultravioletta si
ottiene una miscela di prodotti che comprendono vari composti del cloro:
CH4 + Cl2
CH3Cl + Cl2
CH3Cl + HCl
clorometano
CH2Cl2 + HCl
diclorometano
cloruro di metilene
CH2Cl2 + Cl2
CHCl3 + HCl
CHCl3 + Cl2
CCl4 + HCl
triclorometano
cloroformio
tetraclorometano
tetracloruro di carbonio
CLORURAZIONE DEL METANO – SOSTITUZIONE RADICALICA
La radiazione ultravioletta provoca la rottura omolitica della molecola di
cloro, con formazione di due radicali:
hn
Cl-Cl
Cl·
Reazione di
iniziazione
Cl·
I radicali ci cloro sono molto reattivi e reagiscono col metano strappando
un idrogeno, formando quindi un radicale metile.
Il radicale metile reagisce ulteriormente con altro cloro propagando ancora
il radicale.
CH4 + Cl·
CH3· +
Cl2
CH3·
+ HCl
CH3Cl +
Reazioni di
propagazione
Cl·
La reazione termina quando due radicali si combinano tra loro
CH3· +
Cl·
CH3Cl
CH3· + CH3·
CH3-CH3
Reazioni di
terminazione
Meccanismo di reazione e spostamento degli elettroni
Freccia indicante lo spostamento
di un solo elettrone
Freccia indicante lo spostamento
di una coppia di elettroni
Cl
Cl
CH3 H
CH3·
hn
Cl
Cl·
Cl·
Cl·
CH3·
Cl
CH3Cl +
+ HCl
Cl·
H
Il raricale
CH3· è ibridizzato sp2, planare, 120°
C·
H
H
I composti di carbonio in cui atomi di idrogeno sono stati
sostituiti con altri più elettronegativi, sono più reattivi.
d+ dCH3-Cl
CH3Cl + Cl·
CH2Cl·
+
Cl2
CH3Cl + Cl2
CH2Cl·
+ HCl
CH2Cl2 +
Cl·
CH2Cl2 + HCl
CH2Cl2 + Cl2
CHCl3 + HCl
CHCl3 + Cl2
CCl4 + HCl
le proporzioni tra i prodotti dipendono dal rapporto tra i reagenti
-eccesso di metano = monoclorurazione
-eccesso di cloro = tetraclorurazione
I composti di carbonio in cui atomi di idrogeno sono stati
sostituiti con altri più elettronegativi, sono più reattivi.
H2C
CH2Cl
CH 3
CH 2
Cl2
CH2
CH2
CH3
CH3
prodotti
di reazione
radicali intermedi
di reazione
CH 3
CH3
CH3
HC
CH Cl
CH3
prodotto
prevalente
CH3
stabilità dei radicali
CH3
H3C
H2C
CH2
HC
CH3
CH3
H3C C
CH3
CH3
meno stabile
più stabile
Reattività degli alogenoalcani
Gli alogenoalcani, contenendo un legame tra il carbonio ed un elemento molto
più elettonegativo, sono molto più reattivi degli alcani.
d+ dCH3-Cl
Reagenti nucleofili ed elettrofili
Nucleofilo = Nu :
Ricco di elettroni
Nu :
S
Nu-S
Elettrofilo = E
E
S
Avido di elettroni
E-S
Reagenti nucleofili
Ricco di elettroni
Nu :
S
Nu-S
Si comportano come nucleofili:
• Basi di Arrhenius: OH
• Basi di Bronsted: H2O, NH3, ROH, RNH2,
R2NH, R3N
• Anioni: CN-, CH3O-, CH3COO-, NO2-, NO3SH-, CH3S-, SO42-, F-, Cl-, Br-, I-, etc…
Reagenti elettrofili
Avido di elettroni
E
S
E-S
Si comportano come elettrofili:
• Gli H+ degli acidi
• Sostanze carenti di elettroni: BCH3, AlCl3,
SO3, NO2+, Br+, acidi di Lewis
• Cationi: Ag+, Cu2+, Cr3+, ecc…
Reazioni di sostituzione nucleofila
OH-
d+
dCH3 - Cl
HO – CH3
CH3-Cl + BrCH -Cl + I-
CH3-Br
CH3-Cl + SH-
CH3-SH
CH3-Cl + NO2-
CH3-NO2
CH3-Cl + CN-
CH3-CN
CH3-Cl + CH3O-
CH3-OCH3
3
CH3-I
CH3-Cl + CH3COO- CH3-OCOCH3
+ Cl+ Cl+ Cl+ Cl+ Cl+ Cl-
+ Cl-
Cl-
Reazioni di sostituzione nucleofila bimolecolare,
Sn2
X- = gruppo uscente
HH d+ dC X
H
energia
Nu :
dNu
H d+H
C
H
dX-
HH
Nu C
H
X-
Stato di transizione
Coordinata di reazione
v = k [substrato] [Nu:]
Lo stadio lento del meccanismo è l’interazione iniziale tra i reagenti
Reazioni di sostituzione nucleofila monomolecolare, Sn1
CH3
CH3
H3C C Cl
OH-
+
H3C C OH
CH3
+
Cl-
CH3
2-metil-2-propanolo
2-cloro-2-metilpropano
carbocatione
CH3
I°)
CH3
H3C C Cl
H3C C
+
Cl-
CH3
CH3
II°)
CH3
H3C C
+
CH3
OH-
CH3
H3C C OH
CH3
v = k [substrato]
Lo stadio lento del meccanismo è la formazione del carbocatione
Reazioni di sostituzione nucleofila monomolecolare,
Sn1
CH3
CH3
energia
H3C C Cl
H3C C
+
CH3
CH3
carbocatione
CH3
H3C C OH
CH3
Coordinata di reazione
Il carbocatione è ibridizzato Sp2
Stereochimica delle reazioni di sostituzione nucleofila
Sn2
H d+ dH3C C Cl
H2C
OH-
H d+CH3
d-
C
HO
R-2-clorobutano
HO
CH3
HO
H3C
solvente
Cl
C3H7
R-3-cloro-3-metilesano
Cl-
S-2-butanolo
Sn1
C
Cl
H
C CH3
CH2
CH2
CH3
CH3
C2H5
d-
H3C
C2H5
C
CH3
C C2H5
C3H7
S-3-metil-3-esanolo
+
C3H7
OH-
Il carbocatione è ibridizzato Sp2
racemi, racemizzazione
H3C
C2H5
C
OH
C3H7
R-3-metil-3-esanolo
Fattori strutturali che influenzano le reazioni di sostituzione nucleofila
Sn2
reattività
R
CH3
>
R
CH2
>
R
CH
>>
R
C
R
R
Atomi o gruppi ingombranti impediscono l’accesso del nucleofilo
Solventi apolari impediscono la formazione del carbocatione
Sn1
reattività
R
R
R
R
C+
C+H
>
>
R
C+H2
>
R
Il carbocatione più sostituito è più stabilizzato
Solventi polari favoriscono la stabilizzazione del carbocatione
C+H3
Reazione di eliminazione concorrente alla sostituzione nucleofila
E2
Quando il carbonio è ingombrato e sono presenti atomi di idrogeno in
posizione a, il nucleofilo si può comportare da base e strappare l’idrogeno
bimolecolare
H H
OH-
dHO
H C C Cl
H H
H
H H
C C
H2O
H
H H
CH3
C-X
>
R
E1
H CH3
CH-X
>
CH3
CH2-X
R
H CH3
C C+
- Cl-
H C C Cl
H CH3
H
etene
CH3
monomolecolare
Cl-
C C
cloroetano
R
H
H
dCl
OH-
H CH3
- H2O
CH3
H
C C
H
CH3
Alcoli
R
R
CH2-OH
Alcol primari
R
CH-OH
R
Alcol secondari
R
C-OH
R
Alcol terziari
Per reazione con il Na danno luogo agli alcolati, buoni nucleofili
R-CH2-OH + Na
R-CH2-O- Na+ + H2
R-CH2-O- + CH3-Cl
R-CH2-O-CH3 + Cl-
Alcoli
Per reazione con il acidi forti danno luogo ai sali di ossonio, e possono eliminare
acqua, buon gruppo uscente.
R
R
R
+
CH2-O-H
|
H
R
-
+
CH2-O-H
|
CH3 H
Nu :
-
Nu :
H
+
CH2-O-H
|
CH2 H
+
CH-O-H
|
H
R
R
Nu -CH2
O-H
|
H
CH3
NuH
+
C-O-H
|
H
CH2
CH2
O-H
|
H
Ossidazione degli alcoli
Alcol primari
R
O
||
C-H
[O]
R
CH2-OH
[O]
R
Aldeide
Alcol secondari
R
O
||
C-OH
Acido carbossilico
R
[O]
[O]
CH-OH
C=O
R
R
Chetone
Alcol terziari
R
[O]
R
R
C-OH
[O] = ossidante
I tioli sono analoghi solforati degli alcoli
CH3CH2SH
etanotiolo
CH3CH2CH2SH
1-propanotiolo
CH3
CH3CHCH2CH2SH
HSCH2CH2OH
3-metil-1-butanotiolo
2-mercaptoetanolo
Sono acidi più forti (pKa = 10) che gli alcoli
Non formano legami idrogeno
In solventi polari, ioni tiolato sono nucleofili migliori
degli ioni alcolato
CH3OH
Ammine
Ammoniaca
pKb=4,74
:
R
NH2
NH
Ammine primarie
pKb=3,36
R
Ammine terziarie
pKb=3,36
Le ammine sono dei buoni nucleofili
R - NH2
+
CH3 - I
N:
R
R
Ammine secondarie
pKb=3,02
:
NH3
R
:
:
R
H
|+
R - N - CH3
|
H
+
I-
:
Le ammine e la sostituzione nucleofila
CH3 - NH2
+
CH3 - I
metilammina
H
|+
CH3 - N - CH3
|
H
I-
+
:
Dimetilammonio ioduro
CH3 - N - CH3
|
H
+ CH3 - I
dimetilammina
trimetilammina
+
I-
trimetilammonio ioduro
:
CH3 - N - CH3
|
CH3
H
|+
CH3 - N - CH3
|
CH3
+ CH3 - I
CH3
|+
CH3 - N - CH3
|
CH3
+
tetrametilammonio ioduro
I-
Ossidazione delle ammine
Ammine primarie
[O]
R
NH2
R
O
||
C-H
Aldeide
Ammine terziarie
R
[O]
R
N
3
O
||
C-H
R
Aldeide
R
Se l’N è legato ad un carbonio secondario
R
R
[O]
CH-NH2
R
C=O
R
Chetone









