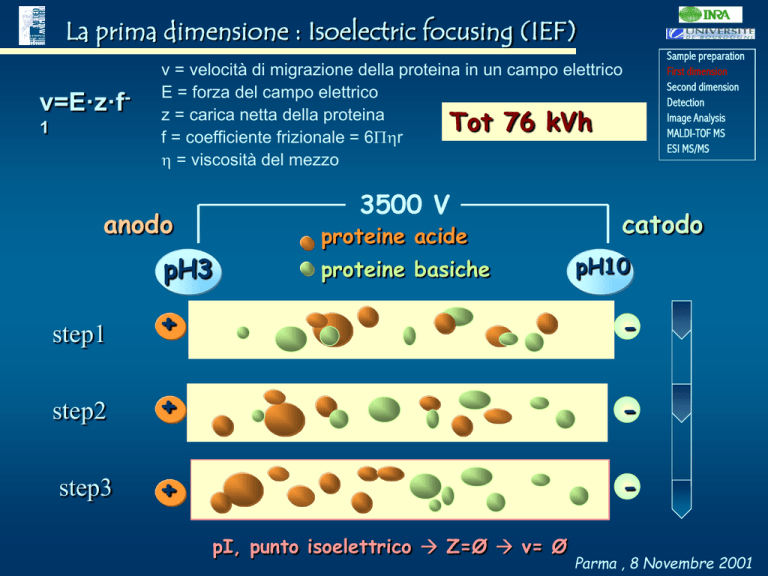
La prima dimensione : Isoelectric focusing (IEF)
v=E·z·f1
v = velocità di migrazione della proteina in un campo elettrico
E = forza del campo elettrico
z = carica netta della proteina
Tot 76 kVh
f = coefficiente frizionale = 6r
= viscosità del mezzo
3500 V
anodo
proteine acide
pH3
proteine basiche
catodo
pH10
step1
+
-
step2
+
-
step3
+
pI, punto isoelettrico Z=Ø v= Ø
Sample preparation
First dimension
Second dimension
Detection
Image Analysis
MALDI-TOF MS
ESI MS/MS
Parma , 8 Novembre 2001
La I° dimensione : IPG strips
Immobilized PH Gradient strip = IPG strip
Sample preparation
First dimension
Second dimension
Detection
Image Analysis
MS analysis
Perché la I° dimensione è così importante nella 2-DE ?
Una I° dimensione eccellente assicura che gli spots (peptidi) siano ben separati (= risolti) nella
II° dimensione, anche quando una grande quantità di proteine viene analizzata
Perché le IPG strips sono così importanti nella I° dimensione ?
1.
il gradiente di pH immobilizzato è stabile ed evita il fenomento della “catodic drift” ;
2.
se sono noti i valori di pI delle proteine d’interesse, l’intervallo di separazione IEF viene ristretto
e ne consegue un’analisi estremamente mirata (>accuratezza e precisione) ;
3.
elevata risoluzione proteica ;
4.
alta riproducibilità dei risultati ;
5.
le proteine estremamente acide o basiche sono più facilmente separabili ;
6.
IPG buffers con stesso intervallo di pH delle IPG strips sono disponibili e il loro utilizzo fa
notevolmente ridurre o elimina il background nella colorazione del gel ….
I° dimensione : l’importanza
Parma , 8 Novembre 2001
La seconda dimensione : 2D SDS-PAGE
Nella II° dimensione in condizioni denaturanti (“elettroforesi monodimensionale SDS-PAGE”) le
proteine sono separate in un gel di poliacrilamide in base alla loro massa molecolare (MM)
1. La miscela proteica è sottoposta a :
H3C-(CH2)10-CH2OSO3-Na+
Sodio dodecil solfato (SDS)
+
Mercaptoetanolo e ditiotreitolo
= detergente anionico che spezza tutte le
interazioni non covalenti delle proteine
native
= riducono i ponti disolfuro
2. Gli anioni dell’SDS si legano alle catene principali in un rapporto di :
~ 1 molecola SDS • 2 residui di amminoacidi
3. I complessi SDS-proteina denaturata hanno una carica negativa MM proteica
Sottoposte ad un C.E. le proteine migrano dal catodo - all’anodo+ in base alla loro MM
I° dimensione : l’importanza
Parma , 8 Novembre 2001
La seconda dimensione : 2D SDS-PAGE
IPG strip
- CATODO
-
+
Gel di poliacrilamide
45 mA
+ ANODO
Sistemi di analisi 2DE - strumenti
I° DIMENSIONE (IEF) :
II° DIMENSIONE (2D-PAGE) :
12 IPG strips /
corsa
12 IPG strips / corsa
12 gels /
10 gels / 15-20 ore
4-6 ore
Hoefer DALT
Ettan
DALT II
unit (APB)
System (APB)
Multiphor II (APB)
IPG Phor (APB)
Giorno 1
t 16.00
Giorno 2
13.00
Reidratazione o.n.
Preparazione
2°dimensione
Giorno 3
12.00
9.30
17.00
Giorno 4
16.00
Giorno 5
Equilibrazione
Separazione IEF Equilibrazione
Preparazione 2°
dimensione (GELS)
Preparazione
2° dimensione
Separazione 2D-PAGE
Fissazione e colorazione
Analisi 2DE : le apparecchiature
Parma , 8 Novembre 2001
2DE : vantaggi vs svantaggi
2DE
Vantaggi
Svantaggi
Vantaggi
Grande capacità di separazione e risoluzione di miscele proteiche
(2.000–3.000 proteine)
Riproducibiltà e affidabilità dei risultati
Possibilità di confronto dei dati tra laboratori differenti
Capacità di rilevazione di modificazioni post-traduzionali delle
proteine
fosforilazione
glicosilazione,
tagli proteolitici,
Possibilità costruire e/o usufruire di mappe di riferimento
disponibili in rete
Identificazione MIRATA di uno specifico pattern proteico cellulare
Vantaggi vs vantaggi
Parma
, 8 ,Novembre
Parma
8 Novembre2001
2001
2DE : vantaggi vs svantaggi
2DE
Vantaggi
Svantaggi
Svantaggi
metodica lunga
molto dispendiosa in termini di : tempo, costo, fatica fisica
bassa capacità di risoluzione delle proteine idrofobiche
difficile separazione delle proteine molto acide o basiche
scarsa risoluzione di proteine con MM > 150 kDa
bassa risoluzione delle proteine poco rappresentative nel
campione proteico
mancanza di linearità o sensibilità tra abbondanza della
proteina nel campione proteico e capacità di risoluzione
tramite colorazione sul gel
Vantaggi vs Svantaggi
Parma , 8 Novembre 2001












