QUADERNI DI CHIRURGIA VASCOLARE
03
Collana della Scuola
di Specializzazione in Chirurgia Vascolare
dell’Università degli Studi di L’Aquila
diretta da Carlo Spartera
Carla Petrassi / Mario Manno
Mario Masturzo / Ludovico Perilli
Patologia venosa
Copyright © MMVII
ARACNE EDITRICE S.r.l.
www.aracneeditrice.it
[email protected]
00173 Roma
via Raffaele Garofalo, 133 A/B
(06) 93781065
ISBN 978–88–548–1057–0
I diritti di traduzione, di memorizzazione elettronica,
di riproduzione e di adattamento anche parziale,
con qualsiasi mezzo, sono riservati per tutti i Paesi.
I edizione: marzo 2007
Indice
Prefazione . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
7
Capitolo 1
La malattia venosa . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
9
Capitolo 2
Emodinamica del sistema venoso . . . . . . . . . . . . . . . . . . . . . . . . . . . . 19
Capitolo 3
Patologia cronica del circolo superficiale . . . . . . . . . . . . . . . . . . . . . . 25
Capitolo 4
Trombosi venosa profonda . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 55
Capitolo 5
Embolia polmonare . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 101
Capitolo 6
Patologie dell’arto superiore . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 111
Letture consigliate . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 117
5
Prefazione
Nell’ambito della patologia vascolare la flebologia è sempre stato ritenuto un
settore di minore importanza sia dal punto di vista diagnostico che terapeutico e quindi le manifestazioni cliniche sono state sempre affrontate in maniera
empirica.
È ormai accettato da tutti che quanto avvenuto in passato sia stato un grosso
errore di valutazione per diversi motivi.
Innanzi tutto per l’entità numerica di tale patologia che colpisce una popolazione molto vasta e spesso in età lavorativa, con indubbia ricaduta socioeconomica.
Un altro motivo che, negli ultimi decenni, ha fatto rivalutare il settore
flebologico è stato l’avvento di una diagnostica non invasiva di alto livello
tecnologico che ha permesso di studiare i risvolti fisiopatologici e porre
indicazioni terapeutiche più mirate senza necessità di ricorrere a metodiche
invasive come la flebografia. In particolare l’ecocolordoppler nella patologia
varicosa e l’Angio-RM venosa nella patologia trombo-embolica hanno permesso una diagnostica ed un’indicazione terapeutica sempre più personalizzate, con indubbio miglioramento dei risultati immediati ed a distanza.
Ultimo motivo per l’inversione di tendenza nell’approcciarsi del chirurgo
vascolare al settore flebologico è stato l’avvento delle tecniche di chirurgia
endovascolare, sia nella patologia varicosa che in quella trombotica.
Tutto questo ha fatto sì che oggi la flebologia non sia più la Cenerentola nel
settore dell’Angiologia e della Chirurgia Vascolare ma, a pieno diritto, rivesta un ruolo paritario nei riguardi della più impegnativa patologia arteriosa.
Questa monografia affronta in modo esauriente le tematiche fondamentali
della patologia venosa, dall’anatomia alle moderne tecniche terapeutiche
endovascolari.
Carlo Spartera
7
8
1. La malattia venosa
La prima pubblicazione sulle vene risale al 1550 a.C.; si tratta del papiro di
Ebers sul quale venivano raffigurate delle “tortuosità serpiginose” considerate allora delle entità nosografiche ad altissimo rischio emorragico e che,
pertanto, non andavano incise. La prima illustrazione di una vena varicosa
risale al IV secolo a.C. in una tavola votiva ritrovata ai piedi dell’Acropoli di
Atene. Essa ritraeva la faccia mediale di una gamba con una lunga tumefazione serpiginosa.
L’inizio della chirurgia delle vene varicose si deve far risalire a Galeno (130200 d.C.). La prima descrizione delle valvole risale al 1547 con la descrizione
di pieghe valvolari nella vena azygos.
Nel 1793 si descrive per la prima volta l’ostruzione della vena cava inferiore
e si afferma che una riduzione del flusso porta alla trombosi.
Nel 1859 si riscontra il legame tra trombosi venosa profonda ed embolia
polmonare. Nel 1891 Trendelemburg descrive la legatura della vena grande
safena al terzo superiore di coscia.
Nei primi 40 anni del secolo scorso la flebologia è stata quasi dimenticata,
ma da circa 40 anni, questo campo è tornato a suscitare l’interesse che merita
grazie anche al progredire dei mezzi diagnostici a disposizione che hanno
consentito una diagnosi più accurata e maggiormente indirizzata alla scelta
del miglior trattamento, sia medico che chirurgico.
La patologia venosa è in continuo aumento a causa dei repentini cambiamenti
di stile di vita che si sono verificati dal dopoguerra ai nostri giorni. La sedentarietà e l’obesità incidono molto sulla malattia venosa, così come l’aumento
delle malattie neoplastiche si associa ad una maggiore incidenza di trombosi
secondarie del circolo venoso profondo. D’altra parte anche la maggiore capacità di porre diagnosi rende più frequente il riconoscimento della malattia;
infatti i notevoli miglioramenti nell’imaging diagnostico, che si basano sul
migliore uso dell’eco-color-Doppler e sui progressi delle tecniche TC e RM,
rendono la diagnosi rapida e precisa.
La naturale conseguenza è un netto miglioramento della terapia, grazie all’introduzione di strategie vincenti sia in campo medico che chirurgico. Ad
esempio, l’introduzione delle eparine a basso peso molecolare rende la terapia più agevole che in passato, sia per il paziente che per il medico.
Il progresso nel campo della chirurgia del circolo venoso superficiale sembra,
tuttavia, avere avuto la maggiore eco. L’introduzione di metodiche endovascolari ha permesso di raggiungere ottimi risultati estetici senza alterare
l’efficacia terapeutica. Sono stati ridotti i tempi di degenza e, di conseguenza,
anche i costi.
9
10
Capitolo 1
Anatomia del circolo venoso
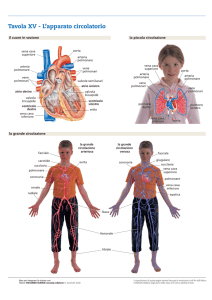
Le vene rappresentano quella parte del sistema circolatorio che trasporta il
sangue dalla periferia verso il cuore. Le vene sono assai diverse dalle arterie
sia per numero che per struttura. Il letto vascolare venoso è molto esteso; le
vene, infatti, coprono una superficie circa doppia rispetto alle arterie. Inoltre,
la superficie del circolo venoso periferico è nettamente più ampia rispetto a
quella del circolo venoso delle parti centrali del corpo. Questa particolare disposizione favorisce la spinta idraulica verso il cuore.
La parete venosa è sottile e collassabile e soltanto le vene di grosso e medio
calibro posseggono una classica struttura a tre tuniche rappresentate da una
tunica intima, una media ed un’avventizia (Fig. 1). Le piccole vene, invece,
che nascono immediatamente dopo i capillari arteriosi, al di fuori dello strato
endoteliale, hanno soltanto un sottile involucro di fibre connettivali ed elastiche. Tra l’intima e la media delle vene di grosso e medio calibro sono
disposte le fibre elastiche e muscolari, queste ultime molto meno rappresentate che nelle arterie. Ci sono, inoltre, differenze tra le varie parti del corpo
per quanto riguarda la composizione delle tre tuniche; a livello degli arti infe-
Figura 1: Struttura della parete delle vene di medio e grosso calibro
La malattia venosa
11
riori la tunica media ha lo spessore maggiore, mentre è meno rappresentata a
livello degli arti superiori, è estremamente ridotta nella vena porta e, infine, è
assente nella vena cava superiore, nella succlavia e nelle vene della testa.
L’avventizia è, invece, sempre molto ben rappresentata e contiene anche vasa
vasorum e reti nervose, soprattutto a livello delle vene di calibro più grosso.
La principale caratteristica delle vene è sicuramente rappresentata dalle valvole. Queste strutture a forma di semiluna nascono dall’intima venosa e poggiano su di uno strato di connettivo costituito da fibre elastiche e da rare fibre
muscolari (Fig. 2); esse hanno il compito fondamentale di assicurare la direzione del flusso venoso dalla periferia verso il cuore.
Per la loro posizione topografica distinguiamo, a livello degli arti, vene superficiali, vene profonde, vene comunicanti e vene perforanti. Le prime hanno un decorso sottocutaneo, mentre quelle profonde hanno un decorso sottofasciale. I due sistemi sono in comunicazione tra loro attraverso un sistema di
vene che perforano la fascia muscolare e vengono pertanto dette vene perforanti. Il nome di vene comunicanti viene dato a quei vasi che mettono in comunicazione due vene che appartengono entrambe al sistema superficiale o a
quello profondo.
A livello dell’arto inferiore (Fig. 3) il sistema venoso profondo è costituito, a
Figura 2: Anatomia di una valvola venosa
12
Capitolo 1
partire dalla periferia, da due vene tibiali anteriori, da due tibiali posteriori e
da due vene peroniere; queste vene si uniscono prossimalmente a formare la
vena poplitea. Al di sopra del ginocchio la vena poplitea si continua con la
vena femorale superficiale che, insieme alla vena femorale profonda, si unisce a formare la vena femorale comune a livello inguinale. Mentre nella
gamba le due vene decorrono ai lati dell’arteria omonima, la vena poplitea
ha, al cavo popliteo, un decorso più profondo rispetto all’arteria poplitea e
più superficiale rispetto al nervo. I loro rapporti vengono in genere schematizzati con la sigla NE.V.A. (rispettivamente nervo, vena, arteria secondo un
piano d’osservazione postero-anteriore). A livello dell’inguine, nella “lacuna
vasorum”, è il nervo femorale che ha una posizione più laterale, mentre, pro-
Figura 3: Anatomia del sistema venoso degli arti inferiori
La malattia venosa
13
cedendo verso la parte mediale, incontriamo l’arteria e quindi la vena femorale (N.A.VE.).
A livello degli arti inferiori il circolo superficiale è dominato dalla vena grande safena; questa nasce dall’arcata plantare superficiale e passa anteriormente
al malleolo mediale per risalire verso l’alto, con un decorso posteriore rispetto alla parte mediale del piatto tibiale, e sboccare a livello inguinale nella vena femorale comune attraverso una struttura unica nel sistema vascolare rappresentata dalla crosse safeno-femorale (Fig. 4).
Nella crosse safeno-femorale sboccano altri rami venosi che vanno sotto il
nome di “collaterali della crosse” e che sono rappresentati dalla vena epigastrica superficiale, dalla vena pudenda esterna, dalla vena circonflessa iliaca
superficiale e dal ramo antero-laterale.
Figura 4: A sinistra: decorso della vena grande safena dall’origine fino alla
crosse safeno-femorale; a destra: decorso della vena piccola safena che diventa sottofasciale a livello del terzo medio di gamba
14
Capitolo 1
La vena grande safena si può presentare, in alcuni casi, doppia; i due tronchi
venosi possono sboccare separatamente nella crosse oppure uno può confluire
nell’altro a diversi livelli del decorso.
Al sistema venoso superficiale appartiene anche la vena piccola safena che
decorre sulla faccia posteriore del polpaccio in regione mediana. Essa nasce
dalla vena marginale laterale del piede e, dopo un decorso retromalleolare
laterale, sale verticalmente verso il poplite dove sbocca nella vena poplitea a
livello della crosse safeno-poplitea (Fig. 4). Qui confluiscono anche le vene
gemellari costituite da un gruppo di 1-4 vene che si riuniscono in un tronco
venoso extramuscolare che può confluire direttamente nella vena poplitea o
contemporaneamente nella vena poplitea e nella vena piccola safena con una
terminazione a lambda.
La principale vena comunicante è la vena di Giacomini che decorre tra le vene piccola e grande safena con un percorso nella parte postero-mediale della
coscia. A livello di gamba, la comunicazione intersafenica è garantita dal reticolo venoso del polpaccio e da vene comunicanti dirette.
A livello degli arti esiste un sistema venoso di grande importanza che va sotto il nome di sistema delle perforanti e che è rappresentato da vene che, perforando la fascia muscolare, mettono in comunicazione il sistema venoso superficiale con quello profondo. Di particolare interesse chirurgico sono un
gruppo di 6-8 perforanti mediali di polpaccio rappresentate dalle:
- vene di Boyd, un gruppo di 3-6 vasi che collegano le vene tibiali posteriori
con una collaterale della vena grande safena o con una safena accessoria;
- vene perforanti gemellari che mettono in comunicazione le vene gemellari
interne con una collaterale della vena grande safena, con una safena accessoria o con il reticolo venoso del polpaccio;
- vene di Cockett che mettono in comunicazione le vene tibiali posteriori con
la vena di Leonardo o con vasi comunicanti o collaterali della vena grande
safena.
Le vene della gamba sono densamente valvolate; le valvole sono orientate in
modo che il sangue progredisca in modo centripeto e non viceversa. La vena
poplitea ha, di solito, 2-3 valvole nella regione dell’articolazione del ginocchio. Nella vena femorale superficiale, nel 90% degli arti, una valvola è presente appena distalmente alla sua unione con la vena femorale profonda ed
un’altra valvola è localizzata all’ingresso del canale di Hunter. Le valvole
nelle altre vene profonde della gamba sono incostanti per numero e posizione
e variano non solo da persona a persona, ma anche tra gamba destra e sinistra
di uno stesso soggetto.
Sia nella grande che nella piccola safena vi sono 8-10 valvole. Una valvola è
invariabilmente presente all’estremità prossimale della grande safena ed è ritenuta di notevole importanza nel prevenire il reflusso del vaso. Le vene perforanti
La malattia venosa
15
della gamba hanno valvole orientate in modo da dirigere il flusso del sangue dalle vene superficiali a quelle profonde; queste valvole si trovano sia superficialmente che profondamente rispetto alla fascia muscolare profonda.
A livello soprainguinale la vena femorale comune si continua nella vena iliaca esterna che confluisce, insieme alla vena iliaca interna, a formare la vena iliaca comune a livello della parte superiore dell’articolazione sacro-iliaca.
La vena iliaca interna drena il sangue venoso degli organi pelvici, compresi i
genitali. La vena iliaca interna riceve numerosi collaterali che permettono
l’instaurarsi di validi circoli di compenso in caso di ostruzione della via venosa principale. In particolare, è opportuno ricordare il plesso emorroidario
che permette la creazione di circoli collaterali con la vena mesenterica inferiore e, quindi, con la vena cava. Esiste anche una vena ileo-lombare che, attraverso anastomosi con la vene lombari, entra in comunicazione con il sistema delle vene azygos e, quindi, con la vena cava superiore.
L’iliaca comune di destra decorre prima dietro l’arteria omonima per poi portarsi lateralmente. La vena iliaca comune di sinistra contrae rapporti con
l’arteria iliaca comune omolaterale, rispetto alla quale si trova medialmente, e
passa, in prossimità del carrefour aortico, al di sotto dell’arteria iliaca di destra. Di grande importanza chirurgica sono i rapporti della vena iliaca sinistra
con i rami del plesso nervoso simpatico che innerva gli organi genitali e con
l’uretere di sinistra.
La vena cava inferiore si forma sul lato destro della quarta vertebra lombare
dall’unione delle due vene iliache comuni. In questo tronco venoso confluìscono tutte le vene della parte sottodiaframmatica del corpo; il territorio di
sua competenza corrisponde a quello di distribuzione dell’aorta addominale.
È la vena più grossa del corpo umano, vaso impari, decorre verticalmente a
Dx della colonna vertebrale e termina nell’atrio destro. Ha una lunghezza
media di 22 cm, di cui 18 cm per la porzione addominale, ed un calibro di
circa 30 mm. Nella porzione addominale ha rapporto posteriormente con il
lato destro dei corpi vertebrali, medialmente con l’aorta addominale, lateralmente con il margine mediale del muscolo psoas e, più in alto, con il margine
mediale del rene Dx; anteriormente ricoperta dal peritoneo, corrisponde dapprima alla radice del mesentere; risale quindi dietro al duodeno, alla testa del
pancreas ed al fegato. Nella breve porzione toracica ha rapporti con la base
del polmone Dx e con il legamento freno-pericardico Dx; penetra nel sacco
pericardico e termina sboccando nell’atrio Dx. I rami affluenti della vena cava inferiore si distinguono in: parietali (vene lombari e freniche inferiori) e
viscerali (vene renali, surrenale Dx, genitale Dx ed epatiche). Il sangue refluo
da tutti gli organi della parte sotto-diaframmatica dell’apparato digerente e
dalla milza, raccolto in modo pressoché totale dalle vene mesenterica superiore, mesenterica inferiore e lienale, confluisce in un unico importante tron-
16
Capitolo 1
co, la vena porta che raggiunge l’ilo del fegato e si ramifica all’interno
dell’organo. Solo dopo aver attraversato le reti sinusoidali epatiche il sangue
raggiunge, mediante le vene epatiche, la vena cava inferiore.
Il circolo superficiale dell’addome è rappresentato da una serie di vene tra cui
la vena epigastrica superficiale, la circonflessa iliaca superficiale e la toracoepigastrica. Questi circoli superficiali sono in comunicazione con il circolo
profondo. Normalmente non sono evidenti ma, in caso di ostruzione del circolo venoso profondo, possono diventare notevolmente ipertrofici. Ad esempio, la presenza di circoli lungo la pareti laterali dell’addome indica una comunicazione collaterale tra il circolo cavale superiore ed inferiore, mentre la
presenza di circoli a livello periombelicale è indice di stasi del sistema portale che si scarica attraverso il sistema delle vene ipogastriche.
A livello sopra-diaframmatico il sangue venoso viene drenato nella vena cava
superiore. Essa si forma dalla confluenza dei due tronchi brachio-cefalici che
raccolgono il sangue degli arti superiori, del collo e del capo oltre che della
parte sopra-diaframmatica del torace. La vena cava superiore non possiede
valvole e la sua parete non ha tunica muscolare. Se ne distingue una porzione
intra-pericardica ed una extra-pericardica. La vena cava superiore si trova a
destra dell’aorta e contrae rapporti con il nervo frenico lateralmente, con la
pleura in avanti, mentre poggia con la sua faccia posteriore contro il bronco
di destra con l’interposizione del nervo vago. I principali rami confluenti nella cava superiore sono la vena azygos e le due vene emiazygos. Esse raccolgono il sangue delle regioni lombari del corpo risalendo verso il torace e drenando a loro volta il sangue da numerose vene intercostali. La vena azygos, o
grande azygos, sbocca nella cava superiore a livello della III-IV vertebra toracica dopo aver formato un arco a livello del bronco principale di destra. Le
due emiazygos si distinguono in superiore ed inferiore. La emiazygos
superiore drena il sangue delle prime cinque coste e, scendendo verso il basso, si congiunge con quella inferiore, oppure piegando verso destra drena
nell’azygos di destra. La emiazygos inferiore si forma direttamente dalla vena
lombare ascendente di sinistra e passa attraverso il diaframma per poi confluire, attraverso un passaggio retroaortico, a livello della VIII-IX vertebra
toracica nell’azygos.
A livello dell’arto superiore il circolo venoso profondo è costituito da vene
che decorrono ai lati delle arterie omonime. Dall’arcata venosa palmare si
formano le due vene radiali e le due vene ulnari che confluiscono, a livello
del gomito, nelle due vene omerali o brachiali che poi formano la vena ascellare, unica, che confluisce nella vena succlavia. Quest’ultima confluisce
con la vena giugulare interna a formare il tronco brachio-cefalico omolaterale. Il circolo venoso superficiale dell’arto superiore prende origine dall’abbondante rete venosa della mano ed è rappresentato dalle vene cefalica, late-
La malattia venosa
17
ralmente, e basilica, medialmente, che si congiungono a livello della piega
del gomito con la vena mediana dell’avambraccio. La vena basilica dopo un
decorso sulla faccia mediale dell’avambraccio e del braccio si approfonda al
di sotto della fascia muscolare per terminare nella vena omerale. La vena cefalica, invece, corre sulla faccia laterale dell’avambraccio e del braccio per
passare sotto la fascia a livello del solco deltoideo-pettorale e terminare nella
vena ascellare (Fig. 5).
Figura 5: Sistema venoso dell’arto superiore
18
Capitolo 1
2. Emodinamica del sistema venoso
Le vene rappresentano il più voluminoso sistema vascolare del corpo. Esse
svolgono l’importante funzione di riportare il sangue al cuore e di regolare la
capacità del letto vascolare. L’aspetto fasico delle flusso ematico venoso è
influenzato dalla presenza delle valvole, dalla natura collassabile della parete
venosa, dalle basse pressioni intravascolari. Le notevoli acquisizioni fisiopatologiche, ottenute anche con l’ausilio degli ultrasuoni, hanno permesso di
approfondire lo studio della fisiologia venosa; la comprensione delle basi
dell’emodinamica venosa è una premessa imprescindibile per affrontarne gli
aspetti patologici.
Relazione pressione-flusso
Se consideriamo un punto qualsiasi di un vaso, la pressione al suo interno dipende da tre componenti fondamentali: la pressione dinamica, la pressione di
riempimento statico e la pressione idrostatica. La pressione dinamica è quella
determinata dalla contrazione del cuore. La pressione di riempimento statico
dipende, sostanzialmente, dalle caratteristiche strutturali della parete venosa
ed in particolare dalla sua elasticità. Essa è la pressione che si registrerebbe
se escludessimo l’azione cardiaca e se la pressione idrostatica fosse pari a 0.
Nel sistema venoso il contributo dato da questa componente alla pressione
intravascolare è esiguo (circa 6 mmHg) e, in genere, viene trascurato. Ben più
importante è, invece, il contributo offerto dalla pressione idrostatica. Essa è
fortemente influenzata dalla forza di gravità e, nel sistema venoso, partecipa
alla pressione intravascolare in maniera ancor più importante della pressione
dinamica; nel sistema arterioso, invece, è la pressione dinamica ad influenzare in maniera predominante la pressione intravascolare.
Considerando un soggetto in ortostatismo, la pressione idrostatica aumenta se
ci spostiamo nelle regioni più basse del corpo e diminuisce andando dal cuore
verso la testa secondo la relazione ∆P = -ρg∆h, dove “ρ” è la densità del fluido, “g” è la forza di gravità e “h” è la distanza di un punto del corpo dall’atrio
di destra. Ne deriva che per un uomo in ortostatismo essendo “g” e “ρ” costanti sulla superficie terrestre, la pressione venosa alla caviglia aumenta in
maniera direttamente proporzionale alla distanza “h” dall’atrio di destra (circa 125 cm) e risulta pari a circa 117 cmH2O. Se, invece, andassimo a misurare la pressione a livello dell’arto superiore alzato sopra la testa troveremmo
una pressione pari a zero. In realtà in base a quanto detto prima ci dovremmo
aspettare una pressione negativa, poiché la pressione idrostatica diminuisce di
19
20
Capitolo 2
circa 50 cmH2O. Tuttavia le vene collassano, si chiudono e così la pressione
non può scendere al di sotto di quella atmosferica. Il piano in cui le pressioni
restano invariate, indipendentemente dalla posizione assunta, prende il nome
di piano di indifferenza idrostatica e, nel soggetto in posizione eretta, questo
piano si trova 4-5 cm al di sotto del diaframma. Pertanto tutte le regioni al di
sopra di questo piano hanno una pressione minore in ortostatismo che in clinostatismo, viceversa accade nell’addome.
Flusso ematico venoso e ritorno venoso al cuore
Il sangue venoso si muove dalla periferia al cuore spinto da un gradiente
pressorio, cosi come avviene per tutti i fluidi in un sistema idraulico. Appare
chiaro che, in questo caso la forza di gravità si oppone al ritorno venoso annullando la componente data dalla forza idrostatica. Esistono, pertanto, due
forze che garantiscono il ritorno di sangue venoso verso il cuore, forze che
vanno sotto il nome di “vis a tergo” e “ vis a fronte”. La prima è la forza propulsiva trasmessa dal sangue arterioso a livello capillare, mentre la seconda
deriva dal fatto che tra l’atrio Dx ed il capillare venoso esiste una differenza
di pressione che “richiama” il sangue venoso verso il cuore. A questa si aggiunge l’attività respiratoria. Infatti, la pressione a livello dell’atrio Dx, identificata anche come pressione venosa centrale, è pari a 2-4 mmHg, mentre la
pressione a livello delle vene periferiche è di circa 15 mmHg. A livello
dell’arto superiore esistono pressioni pari o prossime allo zero. In tal caso è la
forza di gravità a giocare un ruolo favorente il ritorno verso il cuore, per cui
si potrebbe dire che il sangue “cade” verso l’atrio Dx. Se noi escludessimo
anche la pressione dinamica e considerassimo la pressione venosa di riempimento statico essa sarebbe pari a 6 mmHg per cui avremmo comunque un
gradiente pressorio pari a 2-4 mmHg che garantirebbe il ritorno del sangue
venoso verso l’atrio Dx.
La pompa muscolare periferica
Oltre all’attività cardiaca, l’altra importante componente che garantisce il ritorno venoso al cuore, contro la forza di gravità è la pompa muscolare periferica. Essa è rappresentata, a livello degli arti inferiori, in special modo dai
muscoli del polpaccio, soprattutto dal gastrocnemio e dal soleo. Il flusso di
sangue alla parte superiore della gamba giunge dalle vene del plesso plantare
situato tra i muscoli del piede. La sequenza viene così schematizzata: (1) la
dorsiflessione del piede svuota le vene della parte distale della gamba; (2) il
Emodinamica del sistema venoso
21
peso del corpo svuota le vene del piede; (3) la successiva flessione plantare
svuota le vene della parte prossimale della gamba a seguito della contrazione
dei muscoli del polpaccio.
In un soggetto che passa dalla posizione supina a quella ortostatica, circa
500 ml di sangue si riversano nelle vene delle gambe e né la cute né la fascia musclolare sono in grado, da sole, di opporsi al passaggio di liquidi
nello spazio interstiziale che si verifica come conseguenza dell’aumento
della pressione idrostatica. La contrazione muscolare necessaria all’acquisizione della stazione eretta e la conseguente compressione da parte dei muscoli della gamba sulle pareti venose permetterà di evacuare questa quantità
di sangue dalle vene degli arti inferiori, garantendo la riduzione della pressione sul capillare venoso ed assicurando il flusso artero-venoso in maniera
molto più consistente di quanto possa fare la sola venodilatazione. Durante
la contrazione muscolare si sviluppano pressioni molto alte all’interno delle
vene profonde, pari a circa 200 mmHg. È in questo momento della sistole
muscolare che le valvole delle vene profonde o delle perforanti giocano il
loro ruolo più importante. Le prime si aprono e lasciano defluire il sangue
verso il cuore, le seconde, impedendo il reflusso verso il circolo superficiale, garantiscono che il sangue venoso venga spinto in senso centripeto. Se,
infatti, le valvole non fossero presenti, il sangue tenderebbe a refluire verso
il circolo superficiale, per la presenza di un gradiente pressorio tra i due sistemi. In condizioni d’insufficienza venosa cronica le valvole non riescono
a sopportare il peso della colonna ematica e così si avrà un reflusso verso il
basso che sarà responsabile dell’ipertensione venosa che è alla base delle
principali complicanze cliniche dell’insufficienza venosa.
Il contributo della pompa muscolare periferica al ritorno venoso è di grande
valore anche durante l’esercizio fisico. Circa il 30% dell’energia necessaria
alla circolazione ematica durante l’esercizio strenuo viene fornito dall’azione
dei muscoli della gamba.
Durante la fase di rilassamento muscolare o diastole, il sistema venoso si
riempie con il sangue che proviene dal circolo superficiale e con quello che
proviene dalle zone più distali. Il passaggio dal circolo venoso superficiale a
quello profondo avviene, ancora una volta, per gradiente pressorio. Infatti,
durante la diastole muscolare, la pressione nel sistema venoso profondo è
praticamente zero, mentre nel sistema superficiale pieno di sangue si hanno,
in media, pressioni di circa 100-110 mmHg. Il sangue passa allora nel circolo
profondo, mentre quello superficiale si svuota di circa il 70%. È stato visto
che la decompressione del circolo superficiale che avviene con questo meccanismo è essenziale nel prevenire le turbe del trofismo cutaneo e sottocutaneo. Se persistesse una pressione costantemente elevata si avrebbero, infatti, fenomeni di morte cellulare.
22
Capitolo 2
Effetto della respirazione
Le fasi della respirazione influenzano significativamente il ritorno venoso. Le
cavità addominale e toracica sono, infatti, caratterizzate da condizioni pressorie particolari e del tutto diverse dalle regioni periferiche. Nella vena cava
inferiore si ha una pressione pari a circa 10 mmHg che poi si riduce a 4-5
mmHg quando, oltrepassando il diaframma, raggiunge la cavità toracica. La
cava ha una parete sottile con un contenuto muscolare scarso. A livello addominale durante la fase inspiratoria, l’abbassamento del diaframma causa un
aumento della pressione endo-addominale, al punto che il flusso venoso proveniente dall’addome è molto rallentato o addirittura momentaneamente sospeso. Nella fase espiratoria il sollevamento del diaframma determina una
situazione opposta grazie alla quale viene favorito il ritorno venoso. A livello
toracico, invece, l’inspirazione determina una riduzione delle pressioni endocavitarie che favorisce il ritorno di sangue dalla vena cava superiore, mentre
l’espirazione lo rallenta o lo blocca.
Controllo della capacità venosa
Il sistema venoso svolge un ruolo di grande importanza anche sulla regolazione del volume ematico. Quest’ultimo risulta condizionato soprattutto dai
cambiamenti del diametro venoso che, invece, influisce in maniera praticamente nulla sulla regolazione delle resistenze periferiche totali. La capacità
venosa può cambiare passivamente in base alla variazione della pressione,
oppure rispondere attivamente soprattutto a stimoli simpatici, a farmaci adrenergici o ad altri stimoli intrinseci od estrinseci. I vasi venosi hanno una struttura tridimensionale di tipo ellittico che tende a diventare circolare quando la
pressione intravascolare raggiunge valori di 10 mmHg. In questo modo la sezione aumenta ed il vaso accetta un maggior volume ematico mantenendo
costante la pressione. Quando la pressione intravascolare supera i 15 mmHg
qualsiasi ulteriore aumento pressorio causa lo stiramento della parete venosa
e delle fibre nervose, causando una risposta vasomotoria attiva. Questa grande flessibilità consente al serbatoio venoso normale di accettare notevoli
quantità di liquidi, ad esempio durante le trasfusioni o le infusioni, senza importanti conseguenze emodinamiche sulla pressione venosa centrale. Soltanto
se le vene sono piene e la pressione è già elevata un aumento di fluido può
causare un aumento importante della pressione venosa centrale. Analogamente, solo se il sistema è vuoto una perdita ematica potrà avere importanti conseguenze. A differenza delle arteriole, il cui tono è influenzato dall’ambiente
chimico locale, la regolazione nervosa delle vene dipende sostanzialmente
Emodinamica del sistema venoso
23
dall’innervazione simpatica e sono soprattutto le vene periferiche ad essere
sottoposte ad un maggiore controllo nervoso. I principali tipi di stimoli che
possono scatenare una risposta venomotoria attiva sono rappresentati
dall’emozione e dal dolore, dalla iperventilazione, dalla manovra di Valsalva
e dall’esercizio fisico. Non sempre è noto il punto di partenza dello stimolo
efferente responsabile della venocostrizione. Ad esempio, durante
l’iperventilazione, lo stimolo origina a livello della parete toracica o del diaframma, in risposta soprattutto ad improvvisi cambiamenti del tono dei muscoli respiratori. In caso di un’emorragia improvvisa, la risposta vasoattiva
risulta efficace quando il volume ematico si riduce di circa 15-20% e la maggior parte del sangue giunge al cuore dal letto venoso splancnico. In questo
caso, ad esempio, non è nota la sede di partenza dell’impulso afferente cui fa
seguito la risposta adrenergica efferente; secondo alcuni Autori questo impulso origina da riflessi vagali a partenza cardio-polmonare. Quando, invece si
verifica una condizione di shock la venocostrizione lascia spazio alla venodilatazione. Se, infatti, la pressione passa da 50 a 30 mmHg in genere si verifica una perdita, non più controllabile, del tono venoso. Il reintegro del volume
e l’incremento pressorio riporteranno il tono venoso a valori normali.
24
Capitolo 2
3. Patologia cronica del circolo superficiale
Le vene varicose, o varici, hanno sempre afflitto il genere umano; già un antico bassorilievo greco ci mostra un malato che offre al dio Esculapio, forse
per essere guarito, una statua raffigurante una gamba con voluminose varici.
Sin dal I sec. d.C., i medici islamici hanno descritto il metodo chirurgico di
incisione e di asportazione delle vene varicose degli arti inferiori.
Le malattie venose sono in continuo aumento e, nel mondo occidentale, rappresentano un’importante causa di morbilità e pesano gravemente sui costi
della salute pubblica. Metà della popolazione adulta presenta i segni della
malattia venosa cronica superficiale (55% delle donne; 44-45% dei maschi),
anche se meno della metà di essa ha varici macroscopicamente evidenti (Fig.
1). L’incidenza delle vene varicose cresce con l’età.
La malattia venosa cronica del circolo superficiale comprende uno spettro di
manifestazioni cliniche che va dalle teleangectasie (dilatazioni venulari intradermiche) alle vene varicose (vene superficiali dilatate e tortuose), alle ulcere cutanee. La possibilità di usare tecniche non invasive come l’ultraso
Figura 1: Evidenti varici a carico della vena grande safena Dx
25
26
Capitolo 3
nografia Doppler, che consentono uno studio accurato delle vene degli arti
inferiori, ha reso possibile specificare le condizioni funzionali e fisiopatologiche del sistema venoso. Con i continui progressi nelle metodiche di valutazione dell’anatomia e dell’emodinamica venosa, la terapia delle varici si
trova in una perenne fase di evoluzione. In molti paesi occidentali, il trattamento chirurgico di un’insufficienza venosa cronica superficiale è spesso la
procedura più comune.
Una valutazione preoperatoria inadeguata e la non corretta pianificazione della
procedura chirurgica sono considerate le principali ragioni di un alto tasso di
recidiva dopo la chirurgia venosa superficiale. La recidiva è comune soprattutto
dopo il primo intervento di stripping della vena grande safena.
Verso la fine degli anni ’90 hanno fatto ingresso nel panorama chirurgico alcune tecniche endovascolari per il trattamento delle varici che raccolgono
sempre più consensi con il passare degli anni.
Classificazione
Le varici si distinguono classicamente in:
- primitive, che rappresentano la forma più comune e nelle quali non si riconosce un fattore etiologico evidente; il maggiore fattore di rischio è rappresentato dalla familiarità.
- secondarie a trombosi del circolo venoso profondo e/o superficiale.
La patologia più frequentemente riscontrata è l’insufficienza della vena grande safena (che si verifica nel 66% dei casi).
Negli anni sono stati proposti diversi tipi di classificazione delle varici che
tenevano conto della loro importanza, della sede, della tipologia clinica, dell’etiologia, etc. La classificazione attualmente in uso è quella CEAP, introdotta nel 1994 e poi rivista e migliorata nel 2004. Essa si basa sullo stadio
clinico della malattia (C) a seconda dei segni obiettivi, sull’etiologia (E), sulla distribuzione anatomica (A) del reflusso e dell’ostruzione delle vene superficiali e sulla fisiopatologia di base (P).
Per i criteri clinici sono previste 7 classi:
C0: nessun segno visibile o palpabile di malattia venosa
C1: teleangectasie o vene reticolari
C2: vene varicose (diametro > 3 mm).
C3: edema
C4: alterazioni cutanee o del tessuto cellulare sottocutaneo legate a malattia
venosa cronica. Questa classe si suddivide in C4 a (pigmentazione e/o eczema venoso) ed in C4 b (ipodermite sclerotica e/o atrofia bianca).
C5: ulcera cicatrizzata
Patologia cronica del circolo superficiale
27
C6: ulcera non cicatrizzata
Ciascuna classe deve essere completata con A (asintomatico) o con S (sintomatico).
Il criterio etiologico comprende le classi:
Ec: malattia venosa congenita
Ep: malattia venosa primitiva
Es: malattia venosa secondaria (post-trombotica)
En: nessuna etiologia venosa identificata
La classificazione anatomica comprende:
As: sistema venoso superficiale. Va inoltre specificato se la patologia consiste in teleangectasie e vene reticolari (1), se riguarda la vena grande safena al
di sopra del ginocchio (2), la vena grande safena al di sotto del ginocchio (3),
la vena piccola safena (4) o se è extrasafenica (5).
Ad: sistema venoso profondo. Anche in questo caso va specificato il territorio:
vena cava inferiore, vena iliaca comune, vena iliaca interna, vena iliaca esterna,
vene pelviche, vena femorale comune, vena femorale profonda, vena femorale
superficiale, vena poplitea, vene di gamba (tibiali anteriori, posteriori ed interossee), vene muscolari del muscolo gastrocnemio, del soleo, altre.
Ap: vene perforanti, che possono essere di coscia o di polpaccio.
An: nessuna lesione anatomica riportata.
Con la lettera P si precisa il tipo di danno anatomo-emodinamico; in particolare:
Pr: reflusso
Po: ostruzione
Pr+o: reflusso ed ostruzione
Pn: nessun danno fisiopatologico venoso identificato.
Etiopatogenesi ed epidemiologia
La causa dell’insufficienza venosa è probabilmente multifattoriale. È stato
suggerito un ruolo di fattori genetici o acquisiti.
Per quanto riguarda le varici primitive sono state formulate diverse teorie etiopatogenetiche; secondo la teoria emodinamica, la malattia varicosa sarebbe
determinata da un’alterazione valvolare primitiva dei tronchi venosi; il fattore
emodinamico gioca un ruolo fondamentale e viene riconosciuto come il
pattern etiopatogentico principale.
L’altra teoria è quella parietale secondo la quale la malattia varicosa sarebbe
determinata da un’alterazione iniziale, su base ereditaria, della parete venosa
(riduzione del tessuto muscolare liscio e di quello collagene ed elastico) che
porterebbe allo sfiancamento della vena ed alla sua dilatazione, con insufficienza valvolare secondaria.
28
Capitolo 3
Le varici secondarie, si sviluppano a seguito del maggior carico emodinamico
al quale il circolo superficiale viene sottoposto quando si trova a supplire il
circolo venoso profondo o grossi tronchi superficiali ostruiti.
La malattia colpisce con maggiore frequenza il sesso femminile, soprattutto
nei primi 5 decenni di vita con un rapporto M/F che varia tra 1:3 e 1:4. Dopo
i 50 anni le differenze tra i due sessi si riducono. La gravidanza è sicuramente
un importante fattore di rischio. L’insufficienza venosa cronica si verifica,
infatti, nel 10-20% delle donne incinte; ciò sembra dovuto ad un aumento del
tasso di estrogeni ed ad un effetto meccanico compressivo dell’utero gravidico sulle vene della pelvi. Il diametro delle vene, sia competenti che incompetenti, cresce durante la gravidanza e decresce nel post–partum. Pare che gli
ormoni sessuali giochino un ruolo molto importante, nello sviluppo
dell’insufficienza venosa, nel post-partum come nelle donne in menopausa.
L’aumentata concentrazione dei recettori per gli ormoni sessuali nei segmenti
varicosi delle vene rafforza l’importanza del ruolo ormonale nello sviluppo
della malattia.
Anche la dieta viene ritenuta un possibile fattore di rischio.
Il grado con il quale ciascun fattore di rischio contribuisce allo sviluppo della
malattia resta, però, difficile da accertare. Il Framingnham Study ha dimostrato che possono essere considerati importanti fattori di rischio l’obesità,
una dieta povera di proteine e di fibre, un’elevata pressione sistolica, il fumo
di sigarette e la sedentarietà.
Diagnosi
Diagnosi clinica
I segni clinici nei pazienti affetti da insufficienza venosa cronica del circolo
superficiale degli arti inferiori variano dalle teleangectasie all’ulcera venosa.
L’anamnesi è molto importante; in particolare bisogna indagare, nella storia
clinica del paziente, sulla presenza di familiarità per insufficienza venosa
cronica, sulla presenza di una pregressa trombosi venosa profonda e/o del
circolo superficiale. Di grande utilità nei pazienti obesi, in modo particolare,
è valutare lo stile di vita e l’alimentazione che è necessario correggere ancor
prima del trattamento.
Spesso la gravidanza rappresenta un punto cruciale nella storia clinica della
malattia che si presenta in forma più accentuata proprio dopo il parto. È ovvio che le pluripare hanno un rischio sicuramente più elevato rispetto alle
nullipare.
Bisogna conoscere che tipo di disturbi il paziente avverte e come tali disturbi
incidono sulla sua qualità di vita. In genere i pazienti riferiscono un notevole
Patologia cronica del circolo superficiale
29
senso di pesantezza a fine giornata o in seguito ad una stazione eretta prolungata, mentre riportano un certo sollievo al risveglio. Possono essere presenti
anche crampi notturni, formicolii, prurito anche intenso fino ad un vero e
proprio dolore.
Il segno clinico più importante e l’edema degli arti inferiori che, insieme al
resto del corteo sintomatologico, dimostra un andamento ingravescente nel
tempo; spesso i pazienti riferiscono che le loro varici si sono trasformate da
semplici vene visibili in franchi gozzi varicosi ai quali si sono poi associate le
discromie cutanee. I pazienti potranno, inoltre, presentare complicanze quali
tromboflebiti superficiali.
L’insufficienza del circolo venoso superficiale non è un semplice problema
estetico, ma può portare ad importanti conseguenze. Un’insufficienza venosa
superficiale non trattata porta inevitabilmente, nel tempo, a modificazioni
della cute quali eczema, iperpigmentazione della caviglia, lipodermatosclerosi sottocutanea, fino alle ulcere venose.
L’arto va esaminato sia in ortostatismo che in clinostatismo. Si ottengono, in
questo modo, informazioni dirette sulla distribuzione delle varici, sulla presenza di edema e di ulcere. Con la palpazione si possono evidenziare varici
nascoste, situate più profondamente, nel tessuto sottocutaneo o, in caso di varici secondarie a fistole artero-venose, si può percepire un thrill che, all’auscultazione, è accompagnato da un soffio.
All’esame obiettivo segue una serie di test clinici che studiano sia il sistema
venoso superficiale che quello profondo. Quelli attualmente più utilizzati sono il test di Rima-Trendelemburg (Fig. 2) che si esegue con il paziente in posizione clinostatica. Si svuota l’albero venoso superficiale sollevando l’arto e
Figura 2: Test di Rima-Trendelemburg
30
Capitolo 3
si pone un laccio alla radice della coscia. Si invita il paziente ad alzarsi. Alla
rimozione del laccio, se compare un rapido riempimento dall’alto verso il
basso, si ha a che fare con un’incontinenza valvolare. Un lento riempimento
venoso dal basso indica una condizione di normalità.
Il test di Perthes è un test che esplora soprattutto la funzionalità del circolo
venoso profondo e del sistema delle perforanti. Con il paziente in ortostatismo si pone un laccio alla radice della coscia e si invita il paziente a camminare. Se il paziente interrompe la marcia dopo pochi passi per la comparsa di
dolore ed aumento del turgore delle ectasie venose, questo è indice di ostruzione del circolo venoso profondo con insufficienza delle vene perforanti. Il
circolo venoso superficiale rappresenta l’unica via di scarico per il sangue
venoso e, pertanto, non può essere eliminato. Se il paziente non è obbligato
ad interrompere la marcia ma si nota comunque un aumentato turgore dei
segmenti varicosi, questo è un indice di un sistema venoso profondo pervio e
l’incremento delle ectasie venose è dovuto all’insufficienza di una o più perforanti. Se, infine, il paziente non è impedito nella marcia e si osserva lo
svuotamento delle ectasie venose, il circolo venoso profondo è pervio e non
si riscontrano vene perforanti insufficienti.
Diagnosi strumentale
Le indagini diagnostiche non invasive più utilizzate sono attualmente quelle
ultrasonografiche ed in particolare l’eco-color-Doppler. Le caratteristiche
tecniche della metodica sono state riportate a proposito della diagnosi della
trombosi venosa profonda.
Lo studio dell’insufficienza del circolo venoso superficiale viene effettuato in
ortostatismo (le vene superficiali si riempiono e raggiungono il loro massimo
calibro), con il peso del corpo poggiato sull’arto non in esame; l’arto da studiare deve restare rilassato.
L’esame inizia con lo studio ecografico. Si valuta la morfologia della grande
safena alla crosse e la funzionalità delle valvole. Le valvole sono ben apprezzabili in posizione di apertura; si presentano come orletti ecogeni, sporgenti nel lume vasale, con un caratteristico movimento di va e vieni.
Con l’introduzione delle metodiche endovascolari, oggi è importante anche
conoscere il diametro trasverso massimo della vena grande safena alla crosse.
Si studia, poi, tutto il tronco venoso per valutarne la pervietà e la funzionalità
valvolare.
L’esame Doppler viene eseguito in fase dinamica, ovvero attraverso l’esecuzione di manovre di attivazione, quali la manovra di Valsalva o l’inspirazione profonda (Fig. 3). Con queste manovre si valuta la corretta chiusura dei
lembi valvolari prossimi alla crosse safeno-femorale, quindi la sua continen-
Patologia cronica del circolo superficiale
31
za. L’abbassamento del diaframma che avviene durante questa manovra provoca una fase d’ipertensione delle vene addominali che si riflette sulle valvole delle vene degli arti inferiori determinando la chiusura dei lembi valvolari
normali.
Se vi è insufficienza valvolare si osserverà un reflusso venoso verso il basso
a livello della crosse. All’esame color questo reflusso apparirà con colori tra
il rosso ed il verde, indici di flusso centrifugo e turbolento, rispettivamente.
All’esame spettrografico, in condizioni normali, le manovre di attivazione
producono una netta interruzione dell’onda flussimetrica, come conseguenza
della chiusura delle valvole, e non si ascolterà alcun suono. In caso d’incontinenza valvolare si può notare un’onda negativa caratteristica del reflusso
trans-valvolare, associata ad un suono che normalmente non si dovrebbe udire. Oltre allo studio della crosse, bisognerà esaminare anche i principali rami
collaterali della crosse, da cui possono originare le recidive se non trattati
correttamente.
Se c’è il sospetto d’insufficienza anche della piccola safena andrà esaminata
la giunzione safeno-poplitea. Questa può essere valutata con il paziente in
ortostatismo oppure in clinostatismo a ginocchio flesso.
Particolare attenzione va posta ai rami che mettono in comunicazione i due
principali assi venosi superficiali, in particolare alla vena di Giacomini (la
principale comunicante tra i due sistemi a livello della coscia), così come alle
vene perforanti.
Figura 3: Presenza di reflusso all’esame Doppler durante la manovra di Valsalva
32
Capitolo 3
Una metodica che, certamente, ha un notevole valore diagnostico è la misurazione della pressione venosa ambulatoriale; questa misurazione può avvenire in modo cruento od incruento. Con il metodo cruento, la pressione viene
misurata prima, durante e dopo la marcia attraverso un ago inserito a livello
di una vena dorsale del piede. Normalmente la pressione venosa a riposo, in
ortostatismo, si aggira intorno ai 90 mmHg. Viene considerato normale un
valore pressorio, durante la deambulazione, di 20-30 mmHg o comunque inferiore al 50% del valore a riposo. Per ottenere il riempimento venoso e,
quindi, il ritorno ai valori pressori normali dopo la deambulazione, viene
considerato normale un tempo superiore ai 20 sec. Se la pressione non si riduce durante la marcia o si riduce poco e se le vene si riempiono rapidamente
si pone diagnosi di insufficienza venosa.
La misurazione incruenta della pressione venosa si ottiene utilizzando un
manicotto di sfigmomanometro applicato alla caviglia. Utilizzando una sonda
doppler, si misura la pressione venosa in ortostatismo; si fa, quindi, deambulare il paziente e si misura nuovamente la pressione venosa. Anche con questa tecnica è importante valutare la variazione pressoria dopo deambulazione
ed il tempo necessario a ché la pressione torni ai valori di base una volta sospesa la marcia.
Nella valutazione della malattia varicosa lo studio invasivo è rappresentato
dalla flebografia che, tuttavia, oggi non ha nessuna indicazione nelle varici
semplici data l’affidabilità dell’esame ultrasonografico.
Terapia
La malattia varicosa è una patologia assolutamente benigna anche se con il
tempo si va incontro ad un deterioramento della qualità di vita per il suo carattere evolutivo e per l’insorgenza di complicanze. Pertanto, se da un lato la
terapia medica ha lo scopo di attenuare i sintomi, la terapia chirurgica ha
l’obiettivo di eliminare il reflusso venoso patologico alla base della sintomatologia clinica. Va sottolineato però, che neppure la terapia chirurgica, nelle varici primitive, ha la possibilità di eliminare le condizioni predisponenti
allo sviluppo dell’insufficienza venosa cronica; può solo modificare
l’evoluzione della malattia o prevenirne le complicanze.
Terapia medica
Il ruolo della terapia medica nel trattamento dell’insufficienza venosa cronica
superficiale è d’estrema importanza. Da un lato è importante che il paziente
adotti uno stile di vita corretto e cerchi di eliminare i fattori di rischio per la
Patologia cronica del circolo superficiale
33
sua malattia, dall’altro, prima di passare alla soluzione chirurgica, è possibile
adottare una serie di presidi, in particolar modo le calze elastiche, che possono alleviare molto la sintomatologia. È comunque importante sottolineare che
se il paziente non è in grado di modificare il proprio stile di vita e di collaborare in maniera attiva con il medico l’intervento chirurgico potrebbe rappresentare una risoluzione solo temporanea del problema.
Norme igieniche e di profilassi
Il paziente deve evitare l’immobilità prolungata, sia in posizione eretta che
seduta. Quest’ultima posizione causa, infatti, un importante ostacolo meccanico al normale flusso centripeto che si aggiunge anche all’inattività della
pompa muscolare del polpaccio. Sarebbe opportuno evitare bagni eccessivamente caldi, la sauna, metodi depilatori che prevedono un’azione di strappo,
ancor più se associati al calore, ed ogni tipo di calore intenso applicato direttamente alle gambe. Evitare scarpe troppo basse o tacchi troppo alti e pantaloni troppo stretti, soprattutto all’inguine; evitare sport traumatici ed attività
fisica che prevedano contrazioni muscolari intense ed improvvise; adottare
una dieta ricca di fibre e liquidi e combattere la stipsi.
Terapia farmacologica
I farmaci utilizzati si dividono in non venoattivi e venoattivi.
Per quanto riguarda i farmaci non venoattivi sono particolarmente utilizzati nelle
forme più severe di IVC e sono costituiti sopratttutto da agenti eparinici e fibrinolitici che intervengono su diversi aspetti microcircolatori come l’endotelio e la
trombosi capillare o l’emoreologia andando ad agire sul manicotto di fibrina pericapillare di cui si è discusso nel paragrafo sulla fisiopatologia. Comprendono i
glicosamminoglicani, la pentossifillina e il defribrotide.
I glicosamminoglicani possono essere somministrati per via orale, sottocutanea ed endovenosa ed hanno un’azione diretta sull’endotelio dove raggiungono la massima concentrazione. Hanno attività antitrombotica inibendo
alcuni fattori della coagulazione, prolungano il tempo di protrombina ed inibiscono l’adesività piastrinica. Inoltre possono ridurre la viscosità ematica
che in genere risulta aumentata nei pazienti con grave insufficienza venosa
cronica.
Il defribotide è un polidesossiribonucleotide a catena singola ottenuto mediante depolimerizzazione controllata del DNA proveniente da mucosa intestinale suina. Può essere somministrato per via orale, intramuscolare o endovenosa. Studi clinici hanno dimostrato le sue proprietà antitrombotiche,
antinfiammatorie e trombolitiche. È stata anche dimostrata la sua attività ci-
34
Capitolo 3
toprotettiva sulle cellule endoteliali che si esplica attraverso la prevenezione
dell’apoptosi indotta da chemioterapici antitumorali.
La pentossifillina può essere somministrata sia per via orale che endovenosa.
È farmacologicamente caratterizzata dalla capacità di modificare le proprietà
reologiche del sangue. Normalizza le condizioni di perfusione riducendo la
viscosità ematica e ripristinando la dinamica degli scambi metabolici a livello
della microcircolazione. La sua azione si esplica mediante l’aumento della
flessibilità dei globuli rossi, l’inibizione dell’aggregazione piastrinica ed il
miglioramento dell’attività fibrinolitica.
I farmaci venoattivi, di cui i principali rappresentanti sono i flavonoidi, hanno
un’attività antiossidante che neutralizza i radicali liberi in eccesso la cui formazione è favorita dallo stato di ipossia locale che si verifica in caso di insufficienza venosa cronica superficiale; essi causano un danno biologico sui
globuli rossi e sulle cellule dell’endotelio al quale vanno ad aderire i granulociti neutrofili. Grazie a quest’azione i flavonoidi migliorano il tono venoso,
mantengono inalterata la deformabilità eritrocitaria, riducono la permeabilità
capillare e venulare, inibiscono l’adesione dei granulociti neutrofili. In questo
modo essi determinano una diminuzione del passaggio del siero negli spazi
interstiziali, migliorano l’emoreologia del microcircolo, ostacolano la formazione di trombi, riducono l’innesco della reazione infiammatoria locale. Come conseguenza di questi effetti si ha una riduzione dello stato congestizio a
carico degli arti inferiori con miglioramento della sintomatologia.
Terapia elastocompressiva
Le calze elastiche a compressione graduata possono essere efficaci nel controllo sintomatico ma non curano la patologia sottostante. La compressione
esterna può ridurre il diametro della vena e diminuire il reflusso ematico nei
segmenti venosi insufficienti. Gli effetti sul microcircolo sono dati dall’accelerazione del flusso ematico nei capillari, dal miglioramento del rapporto
filtrazione/assorbimento nel sistema capillare e dalla riduzione dell’edema
tissutale. È stata osservata una riduzione del dolore, dell’edema e dei crampi.
Possono essere utilizzate bende o calze elastiche a compressione graduata.
L’uso della benda è limitato a situazioni particolari come nei pazienti obesi o
con insufficienza linfatica.
Le calze elastiche, di tipo preventivo o terapeutico, vengono fabbricate di diversa lunghezza ed a diverso grado di compressione; quest’ultima è maggiore
a livello di caviglia e decresce in senso craniale.
Quando la compressione esercitata alla caviglia è al di sotto dei 18 mmHg, la
calza viene definita “preventiva” o “riposante”. La sua efficacia, nella patologia conclamata, è controversa, così come quella dei tutori elastici che dichiarano la pressione esercitata in "deniers" (den).
Patologia cronica del circolo superficiale
35
Quando la compressione esercitata alla caviglia supera i 18 mmHg, il tutore è
detto “terapeutico”. Esso esercita sull’arto inferiore una compressione definita, che è il 100% alla caviglia, il 70% al polpaccio e il 40% alla coscia.
Sulla base della compressione esercitata alla caviglia le calze elasto-compressive vengono suddivise in 4 classi.
Sulla base della normativa tedesca RAL GZ 387 la 1a classe prevede una
compressione alla caviglia di 18,7-21,7 mmHg, della 2a classe fanno parte
presidi con compressione compresa tra 22,8-32,5 mmHg, alla 3a classe appartengono calze elasto-compressive la cui compressione alla caviglia è compresa tra 32,5 e 46,5 mmHg, mentre una compressione maggiore identifica la
4a classe.
Sulla base della normativa francese NFG 30-102 B le classi di compressione
prevedono valori inferiori in mmHg e precisamente per la 1a classe 10-15
mmHg, per la 2a classe 16-20 mmHg, per la 3a classe 21-36 mmHg mentre la
4a classe prevede una compressione superiore a 36 mmHg.
La principale controindicazione al loro utilizzo è l’insufficienza arteriosa.
Prima di prescrivere l’uso di calze elasto-compressive è opportuno valutare la
presenza dei polsi arteriosi periferici al fine di escludere la coesistenza di
un’arteriopatia ostruttiva cronica degli arti inferiori. Nel caso di un’arteriopatia ostruttiva periferica, soprattutto del tratto femoro-popliteo o di
quello più distale, il compenso è assicurato dal circolo collaterale del quale
fanno parte anche arterie muscolari ed arteriole di dimensioni molto ridotte.
Una compressione come quella esercitata dalle calze elastiche potrebbe influire negativamente proprio sul circolo collaterale e mettere in crisi un sistema arterioso in equilibrio emodinamico labile e causare un peggioramento
della sintomotologia.
Scleroterapia
La metodica consiste in una sclerosi della vena determinata da una sostanza
istolesiva che viene iniettata direttamente all’interno del vaso (Fig. 4). Le
principali indicazioni sono la riduzione dei sintomi soggettivi ed un miglioramento estetico. La scleroterapia è stata introdotta nel 1853 in Francia, ma le
linee guida ufficiali della società americana di dermatologia sono state pubblicate solo nel 1996.
Possono essere trattati capillari e piccole vene, anche se alcuni Autori adottano la scleroterapia anche per le varici tronculari.
Prima del trattamento è bene sottoporre il paziente ad un esame ematico routinario alla ricerca di condizioni d’atopia (IgE; IgA; IgG) e di condizioni protrombotiche (mutazioni della proteina S, della proteina C, del fattore V Leiden, dell’omocisteina) oltre che per conoscere il tasso di fibrinogeno ed il
36
Capitolo 3
numero delle piastrine. Al primo trattamento è bene usare una dose test di
agente sclerosante per valutare la tollerabilità ed i possibili effetti collaterali
e/o allergici. I primi sono dati da pigmentazione cutanea e dalle reazioni infiammatorie locali. Il prurito è riportato nel 35-45% dei casi.
L’iperpigmentazione è stata osservata nel 50-70% dei casi. Queste macchie
vengono definite come “matting” cutaneo e si formano a seguito di microematomi che si sviluppano con la puntura della vena.
I possibili rischi di complicanze pericolose, come la trombo-embolia e l’iniezione intra-arteriosa, devono essere ridotte dall’adozione di una tecnica
meticolosa.
Le sostanze presenti in commercio per la scleroterapia sono diverse e possono essere classificate in due gruppi principali: quelle ad azione potente e
quelle ad azione mite.
Del primo gruppo fanno parte il Tetradecil solfato di sodio ed il Lugol sodico. Il primo farmaco determina un effetto di spasmo del vaso che si ripercuote anche a distanza. Iniettato nel lume del vaso è completamente indolore,
mentre se iniettato fuori dal vaso la sensazione di dolore non è immediata.
Questo rappresenta un’arma a doppio taglio in quanto si continua ad iniettare
farmaco al di fuori del vaso e si possono determinare delle lesioni sia del sottocute che della cute. Un’altra pericolosa caratteristica è la tendenza a determinare reazioni allergiche.
Il Lugol sodico (iodio 1%) può essere utilizzato sia come prima sostanza che
in sostituzione del tetradecil, quando questo non ha funzionato. Ha un’azione
sclerosante potente ma, a differenza del primo, resta circoscritta alla zona
d’iniezione. L’iniezione sottocutanea è altamente irritante.
Tra le sostanze ad azione mite ci sono il salicilato di sodio, l’atossisclerol, la
glicerina cromata e la scleromousse. Il salicilato di sodio è stato per lunghi
Figura 4: Terapia sclerosante di teleangecasie
Patologia cronica del circolo superficiale
37
anni l’agente sclerosante più utilizzato. L’inconveniente principale è che determina crampi muscolari che possono essere evitati con l’aggiunta di qualche goccia di xilocaina. Se iniettato fuori vena è molto doloroso; infatti alcuni Autori lo aggiungono al Tetradecil solfato proprio come campanello
d’allarme per verificare la fuoriuscita dalla vena. La glicerina e l’atossisclerol
sono molto utilizzati. L’atossisclerol viene preferito alla glicerina poiché determina minori reazioni avverse ed è, quindi, tollerato meglio dal paziente.
Uno dei prodotti che da qualche anno è diventato particolarmente diffuso in
questo tipo di terapia è la scleromousse. Inventata nel 1986 da Michel Grigg
del St. Mary Hospital di Londra è una schiuma che contiene una sostanza tensioattiva che provoca l’occlusione non trombotica della vena. In pratica la
schiuma espelle il sangue dalla vena determinando l’accollamento delle pareti
venose. Ciò scatena una reazione infiammatoria che porta all’occlusione della
vena. Il principale inconveniente di questo metodo è che la schiuma tende a
tornare liquida in tempi brevi perciò, dopo la preparazione, bisogna essere
rapidi nell’iniezione.
Indipendentemente dall’agente utilizzato, dopo ogni seduta scleroterapica va
applicato un bendaggio elasto-compressivo. Il bendaggio andrà mantenuto
per un periodo variabile di 48-72 ore. Mentre alcuni Autori ritengono importante bendare l’intero arto trattato, altri applicano il bendaggio solo sulla
parte sottoposta a terapia sclerosante. I benefici del bendaggio sono diversi:
riduce gli effetti della reazione infiammatoria ed aumenta il tempo di contatto
delle pareti venose, aumentando l’efficacia della terapia.
Laser terapia
Una metodica alternativa che può essere utilizzata per il trattamento delle teleangectasie (diametro fino a 2 mm) è rappresentata dal laser. L’energia
prodotta dal laser è costituita da un’onda elettromagnetica monocromatica ad
una lunghezza d’onda specifica. La luce del laser che raggiunge il vaso è assorbita dall'emoglobina ed è convertita in calore che provoca la denaturazione
dei globuli rossi e dei vasi stessi. Modificando la lunghezza d’onda e la frequenza di emissione della luce è possibile ottenere un effetto molto selettivo,
evitando gli effetti collaterali sulle strutture circostanti.
Esistono in commercio diversi apparecchi in grado di produrre energia laser a
lunghezza d’onda e fluenze differenti. Il laser ND:Yag è un tipo di laser ad
elevata fluenza che riesce a coagulare anche capillari di una certa consistenza
senza danneggiare la cute circostante; ha una lunghezza d’onda di 1064 nm
ed un impulso lungo. È necessario raffreddare la cute prima, durante e dopo il
trattamento per permettere di utilizzare fluenze elevate che migliorano il risultato sui vasi bersaglio senza danni collaterali. Attualmente il laser ND:Yag
38
Capitolo 3
viene considerato il sistema laser d'elezione per le teleangectasie degli arti
inferiori, sia di colore rosso che di colore blu.
Il dye laser utilizza una soluzione di rodamina per emettere la radiazione. La
lunghezza d’onda prodotta varia da 585 a 600 nm. Ha un’efficacia sovrapponibile al ND:YAG ma è meno potente.
Il trattamento non è doloroso e può essere effettuato con un’anestesia topica
mediante l’uso di una crema anestetica. Si procede quindi a trattare la zona
interessata mediante un manipolo che viene appoggiato sulla cute (Fig. 5). Il
paziente può non avvertire nulla o il più delle volte riferisce una sensazione
simile ad un elastico tirato sulla pelle. Dopo l’intervento, in genere, si ha un
arrossamento cutaneo più o meno marcato che si risolve in 24-48 ore. I capillari possono apparire per circa due settimane come dei cordoncini duri e
talvolta anche più scuri di prima; poi scompaiono definitivamente. Per ottenere un risultato completo sono necessarie più sedute.
Poiché l'applicazione del raggio laser provoca la coagulazione dei capillari
con formazione di croste che cadono nel giro di un mese lasciando un’area
leggermente ipopigmentata, per scongiurare depigmentazioni della cute non
devono essere trattate pelli molto scure od abbronzate. La zona trattata non deve essere lavata per tre giorni e non deve essere esposta al sole per 4 settimane.
Il trattamento laser dei capillari dà gli stessi risultati di una scleroterapia ben
fatta. I vantaggi rispetto alla terapia sclerosante sono rappresentati soprattutto
dal minor dolore durante il trattamento e dal fatto che il laser non determina
mai la formazione di macchie scure che possono invece verificarsi con la
scleroterapia.
Figura 5: Laser-terapia di capillari
Patologia cronica del circolo superficiale
39
Terapia chirurgica
Il trattamento chirurgico ha lo scopo di eliminare le vene varicose presenti
nel momento in cui si interviene e che sono alla base delle manifestazioni cliniche. Prima di porre indicazione all’intervento e di scegliere la tecnica più
adatta s’impone una valutazione preoperatoria molto meticolosa, volta, da un
lato allo studio approfondito non solo del sistema safenico ma anche delle
vene collaterali, delle vene perforanti e del circolo venoso profondo,
dall’altro alla valutazione del rischio chirurgico generale. Lo studio eco-color-Doppler permette di avere tutte le informazioni che servono a questo scopo e consente di eseguire quello che viene definito il “mappaggio preoperatorio” delle vene insufficienti da eliminare.
Il trattamento chirurgico dell’insufficienza venosa cronica superficiale può
essere eseguito con diverse tecniche che vengono schematicamente suddivise
in tecniche di chirurgia tradizionale e di chirurgia endovascolare.
Chirurgia tradizionale
Le tecniche chirurgiche utilizzate per la correzione del reflusso venoso sono
diverse e tutte hanno lo scopo di eliminare assi venosi che non sono più in
grado di assolvere correttamente alla loro funzione. È possibile suddividere
schematicamente la chirurgia tradizionale in chirurgia “demolitiva” (stripping
e flebectomie) e chirurgia “conservativa” (CHIVA).
Eliminazione del reflusso della vena safena
È indicato nei pazienti con varici in classe C2-C5 della classificazione CEAP
nei quali, all’esame Doppler, è stato documentato il reflusso alla giunzione
safeno-femorale o safeno-poplitea.
Stripping della vena grande safena
Un reflusso safeno-femorale è presente nel 70% delle varici. L’eliminazione
chirurgica del reflusso della vena grande safena è utile nei pazienti con quadri
di insufficienza venosa cronica se il sistema profondo è pervio.
Lo stripping della safena rimane ancora il metodo maggiormente utilizzato. Il
metodo originale è stato messo a punto da Mayo nel 1906. Il paziente può
essere sottoposto ad un’anestesia generale o loco-regionale.
L’intervento inizia con un’incisione cutanea di 5 cm, parallela alla piega
dell’inguine, per esporre completamente la giunzione safeno-famorale. Le
vene che sboccano alla crosse o le collaterali della vena grande safena ven-
40
Capitolo 3
gono identificate, sezionate e legate. Si isola la vena grande safena al suo
sbocco nella femorale e la si clampa (Fig. 6). Si isola la safena a livello distale, sulla faccia mediale del terzo superiore della gamba o a livello perimalleolare interno (Fig. 7), a seconda che si voglia eseguire uno stripping
corto o lungo. La sonda per lo stripping viene inserita, di solito, in senso caudo-craniale; si fissa la safena allo stripper con un laccio robusto e poi si esegue lo stripping tirando la sonda in senso cranio-caudale (Fig. 8).
Figura 6: Crossectomia
Figura 7: Introduzione della sonda di Babcock al malleolo
Patologia cronica del circolo superficiale
41
Esistono due tipi di sonde; una determina l’accartocciamento della vena al
di sotto di una testina fissata al capo prossimale della sonda (questa è quella
maggiormente utilizzata), l’altra, invece, causa l’invaginazione della vena
con un minor danno meccanico a carico delle strutture vicine ed in particolare del nervo safeno. Alcuni Autori criticano l’asportazione della safena
fino al malleolo per due ordini di motivi: da un lato per gli stretti rapporti
che si instaurano nella gamba tra il nervo safeno e la vena omonima; la trazione meccanica effettuata durante lo stripping determina, in circa il 35%
dei casi, lesioni a carico di questo nervo che si traducono, clinicamente, in
insensibilità cutanea e parestesie del polpaccio che nella stragrande maggioranza dei casi sono temporanee. Vi è poi un motivo anatomico: dato che
la maggior parte dei collaterali di gamba non drena nella safena ma in altri
rami, in particolare nella vena di Leonardo (che connette la vena grande safena con le tibiali), non è funzionalmente utile asportare la vena grande safena nel tratto di gamba.
È utile eseguire le flebectomie a livello di gamba prima dello stripping
della safena. Si praticano delle piccole incisioni verticali in corrispondenza delle varici (Fig. 9), opportunamente evidenziate con una matita dermografica nello studio preoperatorio. Le vene varicose vengono isolate,
mediante appositi strumenti chirurgici (Fig. 10), sezionate ed asportate
(Fig. 11).
Figura 8: Stripping della vena grande safena in senso cranio-caudale
42
Capitolo 3
Se nello studio preoperatorio viene messa in evidenza l’incontinenza di una o
più vene perforanti, l’intervento può essere ulteriormente completato con la
sezione e legatura di queste vene. Quando il quadro clinico non è riconducibile ad una SPT, si procede alla legatura ed alla sezione delle vene perforanti nel loro tratto soprafasciale, mediante piccole incisioni cutanee.
Quando, invece, il quadro clinico comprende anche ulcere venose ed induratio della gamba è necessario ricorrere al trattamento della porzione sottofasciale delle perforanti di cui si parlerà nel paragrafo dedicato alla SPT.
Alla fine dell’intervento, dopo aver evacuato il sangue residuo dall’arto, si
applica un bendaggio elasto-compressivo che ha lo scopo di ridurre al minimo l’eventuale formazione di un ematoma.
Sebbene lo stripping della safena rimane ancora la tecnica maggiormente utilizzata dai chirurghi, essa comporta, tuttavia, delle complicanze, quantunque
raramente gravi.
Figura 9: Incisioni cutanee verticali lungo le varici da asportare
Figura 10: Strumenti chirurgici usati per le flebectomie secondo Muller
Patologia cronica del circolo superficiale
43
L’ematoma sottocutaneo lungo il decorso della safena asportata è molto frequente (80%) e, se di entità limitata, può essere considerato quasi “fisiologico” dopo l’intervento di stripping. Nel post-operatorio si può avere dolore,
bruciore, parestesie. Mackay e al. hanno dimostrato che solo nel 38% dei pazienti si osserva la completa scomparsa della sintomatologia a 2 settimane
dall’intervento. In genere, mentre il dolore e l’ematoma si riducono o scom-
Figura 11: Flebectomie secondo Muller
44
Capitolo 3
paiono nell’arco di due settimane, le parestesie possono durare per più tempo,
in media 4 settimane.
Le complicanze severe possono essere lesioni dei vasi arteriosi, una TVP,
un’embolia polmonare. Secondo uno studio britannico retrospettivo, l’incidenza
delle complicanze gravi dopo un intervento di stripping è pari allo 0.8% e la
maggior parte di queste sono TVP. L’infezione della ferita e la linforrea sono altre complicanze che si possono osservare nei pazienti operati di stripping. La linforrea riconosce più spesso come causa, specialmente a livello inguinale, una tecnica chirurgica non accurata nella fase di preparazione della crosse.
Sebbene questo tipo di intervento sia poco invasivo e venga eseguito nella
maggioranza dei casi in anestesia spinale, la convalescenza può non essere
brevissima. È stato stimato che un periodo 2-3 settimane è un lasso di tempo
ragionevole di astensione dal lavoro.
Stripping della vena piccola safena
La procedura prevede un’incisione trasversale 1 dito traverso a valle della
piega del poplite o nel punto in cui è stata individuata la crosse safeno-poplitea, con il paziente in posizione prona. La crosse safeno-poplitea può avere
diverse localizzazioni: si può trovare più in alto o più in basso rispetto alla
piega del ginocchio.
Ricordiamo, inoltre, che la crosse safeno-politea, a differenza di quella safenofemorale, si trova in regione sottofasciale; sarà pertanto necessario incidere la
fascia muscolare per isolarla. Distalmente la vena viene isolata in corrispondenza del malleolo laterale. Quando non è possibile inserire la sonda per lo stripping
si ricorre alla flebectomia della vena piccola safena. Anche in questo caso si eseguono delle flebectomie a carico dei vasi collaterali così come descritto prima.
Una volta terminato l’intervento bisogna chiudere la fascia muscolare prima di
affrontare i margini del tessuto sottocutaneo e quindi della cute.
CHIVA
CHIVA è un acronimo che sta per “cure conservatrice et hemodinamique de
l’insuffisance veineuse en ambulatorie”. Introdotta nel 1978 dal francese
Franceschi, è una tecnica di correzione emodinamica che trova il suo razionale nell’eliminare soltanto i circoli venosi superficiali, collaterali della vena
grande safena, che risultano incontinenti.
In questo modo si riduce il carico emodinamico sull’asse venoso safenico.
Per poter eseguire la metodica è necessario uno studio eco-color-Doppler preoperatorio lungo e paziente, volto ad individuare con esattezza i punti di fuga
venosi sui quali è necessario intervenire chirurgicamente.
Patologia cronica del circolo superficiale
45
Questa tecnica può essere eseguita in due modi:
CHIVA tipo 1: si realizza quando un vaso incontinente si riversa direttamente
in un sistema safenico incontinente. Si esegue la deconnessione della safena
dalla femorale senza eseguire lo stripping, e si deconnettono tutti gli eventuali rami tributari della vena safena che sono incontinenti.
CHIVA tipo 2: si realizza quando rami venosi incontinenti drenano su uno o
più collaterali della safena. Consiste nella deconnessione, allo sbocco nella
safena, della tributaria e nella sua eventuale flebectomia.
Questo intervento può rimanere unico in almeno il 60% dei casi a 18 mesi.
Nei rimanenti casi il trattamento va completato con una CHIVA tipo 1 o ripetendo il tempo sopradescritto.
Il vantaggio teorico rispetto allo stripping, per il quale Franceschi introdusse
questa tecnica, era rappresentato dal fatto che, da un lato si poteva lasciare un
tronco safenico non incontinente e, dall’altro, che la correzione emodinamica
potesse portare ad un miglioramento dell’intero quadro clinico. In realtà oggi le
conoscenze sulla fisiopatologia dell’insufficienza venosa cronica superficiale ci
dicono che la base della malattia è data da un’alterazione primitiva della parete e
delle valvole venose, il carico emodinamico è una conseguenza di quest’alterazione primitiva. Questo, quindi, è in contrasto con il postulato essenzialmente
emodinamico sul quale si basa la CHIVA. Inoltre, con questa tecnica vengono
lasciati in sede il tronco safenico e tutti quei collaterali che sono stati riconosciuti continenti allo studio eco-color-doppler. Questo espone alla formazione di circoli collaterali e allo sviluppo, per neoangiogenesi, di nuovi vasi. Per tali ragioni
si crea nuovamente il carico emodinamico che esisteva prima dell’intervento.
La reale efficacia di questa tecnica è ancora molto dibattuta, tuttavia appare
ormai chiaro che il numero di recidive è molto elevato. Addirittura in uno
studio del 2003 è stata osservata la presenza di un reflusso a carico della vena
grande safena nel 92% dei pazienti sottoposti ad intervento di CHIVA e che
sono stati poi trattati con lo stripping della safena.
Chirurgia endovascolare
Lo sviluppo delle tecniche endovascolari per il trattamento dell’insuffcienza
venosa cronica superficiale degli arti inferiori ha avuto un’enorme crescita
negli ultimi anni. La possibilità di eseguire un intervento meno invasivo, più
rapido ed allo stesso tempo con un’efficacia immediata sovrapponibile a
quella della chirurgia tradizionale ha spinto i chirurghi ad utilizzare queste
metodiche con sempre maggiore frequenza.
Il principio teorico delle metodiche endovascolari è quello di determinare l’obliterazione della vena grande safena attraverso un’energia applicata alle pareti venose
46
Capitolo 3
che è diversa a seconda della metodica utilizzata. Attualmente esistono due tecniche
principali che utilizzano, una le onde in radiofrequenza e l’altra l’energia laser.
I pazienti devono appartenere alla classe C2-C5 della classificazione CEAP e
deve essere presente all’esame eco-color-Doppler un significativo reflusso
della vena grande safena. È, però, necessario che il decorso della vena non sia
troppo tortuoso, in modo da non ostacolare il passaggio dei cateteri, e che il
diametro della vena non sia troppo grande per non vanificare l’efficacia della
tecnica (il calibro della grande safena deve essere < 12 mm se si utilizza la
metodica con radiofrequenza e < 18 mm se si utilizza il laser). La vena non
deve essere stata sottoposta a precedenti interventi scleroterapici, non devono
esservi trombi endoluminali e/o pregressi episodi flebitici.
Obliterazione della vena safena mediante radiofrequenza
La tecnica abbisogna di uno strumentario formato da un set di cateteri, un generatore di corrente alternata, un eco-color-Doppler con sonda da 7.5 MHz.
Il sistema utilizza delle onde in radiofrequenza che costituiscono una fonte di
calore che, applicata alla parete della vena, esercita una denaturazione del collagene attraverso una procedura definita “riscaldamento resistivo controllato”.
Il paziente sarà sottoposto ad una semplice anestesia locale per infiltrazione
lungo l’intero decorso della vena oppure ad un’anestesia loco-regionale.
Esistono due tipi di cateteri i quali, forniti di una guaina che riveste una serie
di elettrodi generanti calore, differiscono sia per misura che per struttura: nel
piccolo (6 F), lo scambio di polarità avviene tra un singolo ciuffo di elettrodi
collabiti tra loro ad ombrello e una punta centrale sferica (Fig. 12), mentre nel
Figura 12: a Sn apparecchio per la radiofrequenza; a Dx elettrodo
Patologia cronica del circolo superficiale
47
grande (8 F) tale scambio avviene tra due gruppi di elettrodi mentre la punta
sferica resta neutrale.
In entrambi i modelli è presente una via centrale per l’infusione di liquido ed
il passaggio del filo guida. I cateteri, adesi alla superficie intimale della vena,
permettono l’obliterazione dei vasi con diametro compreso tra 2 mm e 12
mm mediante la produzione di un anello di calore lungo 6-8 mm, che può essere trasportato lungo il tratto vasale che si intende obliterare.
Il generatore bipolare è controllato da un computer in grado di riconoscere i
diversi cateteri e di selezionare l’esatta funzione, impostata singolarmente,
del catetere da utilizzare.
S’incannula la safena interna dopo avere eseguito una mini-incisione cutanea
longitudinale al terzo medio-prossimale di gamba, oppure per via percutanea.
Sotto controllo ecografico, la sonda del catetere viene fatta procedere in senso anterogrado sino al posizionamento della sua punta a circa 1,5 cm dalla
crosse safeno-femorale.
Il controllo ecografico rappresenta un valido ed indispensabile aiuto al
fine di evitare uno sconfinamento della punta del catetere nella vena femorale. Il suo utilizzo permette inoltre la valutazione esatta del tratto safenico da risparmiare.
L’arto inferiore deve essere avvolto, dal piede alla radice della coscia, con
una benda di Einsmark allo scopo di dirottare il flusso di sangue dal circolo
venoso superficiale a quello profondo. Il lume del vaso, infatti, deve essere
privo di sangue. Ad una temperatura di 85°C e con un’impedenza di 200
Ohm, il catetere aperto ad ombrello viene retratto ad una velocità media di
2,5-3 cm/min. L’impedenza deve essere mantenuta stabile, controllando il
valore sul display e regolando la benda di Einsmark ad una valida compressione, ecograficamente confermata, che permetta un ottimale contatto tra
l’elettrodo e la parete intimale della vena (Fig. 13). A livello della crosse safeno-femorale, oltre alla benda di Einsmark, è necessaria una supplementare
Figura 13: Meccanismo d’azione della radiofrequenza
48
Capitolo 3
e diretta compressione manuale. Va detto, inotre, che si sono riscontrate diverse difficoltà nel posizionamento della benda di Einsmark. Soprattutto nelle
donne obese, la notevole circonferenza della coscia causa un cattivo funzionamento della benda che risulta d’importanza fondamentale per la corretta
riuscita della procedura.
Contestualmente al ritiro manuale del catetere e alla compressione, attraverso
l’irrigatore centrale, con adeguata pressione garantita da uno spremisacca,
viene iniettata soluzione fisiologica eparinata al fine di limitare al massimo la
formazione di coaguli sulla punta del catetere; questi, infatti, interponendosi
tra la punta stessa e la parete venosa, ostacolerebbero la corretta azione
dell’elettrocatetere e ne vanificherebbero i risultati.
Anche con questo tipo di tecnica, così come nello stripping, potranno poi essere eseguite delle varicectomie di gamba attraverso delle microincisioni. Alla fine dell’intervento bisogna applicare un bendaggio elasto-compressivo
che viene mantenuto per circa 7 giorni.
La dimissione del paziente avviene già in prima giornata e questi può riprendere a camminare sin dalla dimissione osservando una settimana di riposo.
I vantaggi di questa tecnica sono dati dalla rapidità d’esecuzione (20-30 minuti),
dalla bassa aggressività, dalla semplicità d’esecuzione, dal numero minimo di
effetti collaterali e dal notevole risultato estetico. Gli svantaggi sono dati dalla
rigidità dei criteri di selezione dei pazienti e dai costi ancora troppo elevati.
La metodica non è scevra da possibili complicanze che, tuttavia, sono molto rare
se vengono utilizzati i giusti parametri di settaggio della macchina. Le complicanze che si possono verificare sono eritema e porpora; queste hanno una frequenza maggiore rispetto agli edemi, alle flebiti, alle parestesie ed agli ematomi.
Uno dei principali studi sul sistema a radiofrequenza ha potuto dimostrare la notevole efficacia nel trattamento dell’insufficienza venosa cronica superficiale.
Nessuno dei pazienti trattati ha presentato nel post-operatorio complicanze
quali edema, flebiti, parestesie, ematomi o infezioni. Porpora ed eritema si
sono invece presentati, rispettivamente, nel 50% e nel 10% dei pazienti, ma
sono scomparsi in meno di due settimane.
Nel follow-up a 24 mesi la percentuale di pazienti guariti, sia da un punto di vista
clinico che fisiopatologico, valutato mediante eco-color-Doppler, era dell’80%.
Obliterazione della vena safena mediante tecnica laser
Questo metodo è stato introdotto da Carlos Bonè nel 1998 e successivamente
ripreso e codificato da Navarro et coll. Il sistema laser genera una fonte di
calore elevato che agisce sul pigmento emoglobinico dei globuli rossi che
rappresentano il target per questa tecnica. A differenza della tecnica in radiofrequenza è necessario che nella vena sia presente il sangue.
Patologia cronica del circolo superficiale
49
La tecnica abbisogna di uno strumentario fatto da un kit composto di una fibra
ottica laser da 600 mm, un’agocannula da 19 G, una guida J-tip da 0.035 Inch e
da un introduttore da 5 F, da un generatore laser a diodo con differenti lunghezze d’onda a seconda del tipo di macchina (810, 980, 1320 nm) con modalità
pulsata o continua, un eco-color-Doppler con sonda da 7.5 MHz.
Previa anestesia locale, si incannula la safena interna al III inferiore di coscia
per via percutanea o con preparazione chirurgica (Fig. 14).
Si inserisce la fibra ottica laser, la si fa proseguire fino a circa 1,5 cm dalla
crosse, si visualizza il marker rosso del laser allo sbocco safeno-femorale
(Fig. 15), si verifica la posizione misurando ecograficamente la distanza tra la
fibra e lo sbocco safeno-femorale e si pratica l’anestesia lungo il decorso della vena. A questo punto s’inizia a ritirare la fibra e si effettua una modica
compressione manuale subito dopo il passaggio della fibra ottica.
Figura 14: Preparazione della vena grande safena al III distale di coscia per
l’inserimento del catetere laser
Figura 15: La possibilità di osservare per epiluminiscenza la localizzazione
della punta, rende più sicura la corretta localizzazione della sonda
50
Capitolo 3
Il laser determina una coalescenza degli strati subintimali della parete venosa
senza particolare danno alle strutture avventiziali e peri-avventiziali. L’energia sviluppata dal laser porta alla formazione di bolle di vapore che urtando
sull’intima della parete venosa provocano la denaturazione delle fibre di collagene facendo collabire le pareti (Fig. 16). Inoltre il laser agisce anche sulle
strutture proteiche dei globuli rossi che vengono deformati. La perdita della
normale struttura ellissoidale delle emazie causa una trombosi endoluminale
che contribuisce al meccanismo di obliterazione della vena.
Con questa tecnica può essere provocato un danno circonferenziale adeguato
anche laddove la parete venosa si presenti particolarmente dilatata, tenendo
conto che, in tali casi, l’azione del raggio diodico non colpisce omogeneamente la circonferenza del lume venoso, ma ne ustiona punti diversi ottenendo comunque un danno circonferenziale soddisfacente. Una volta verificati tutti questi fattori, si inizia la procedura emettendo, con il pedale, trequattro impulsi laser e ritraendo lentamente e gradualmente di circa 1-2 mm
la sonda laser fino alla completa fuoriuscita della stessa.
L’EVLT presenta vantaggi importanti, anche rispetto alla radiofrequenza,
come il contenimento dei costi, una tecnica d’esecuzione semplice e rapida,
una fibra flessibile ed utilizzabile più facilmente in safene anche non perfettamente rettilinee e di calibro maggiore rispetto al limite di 12 mm fissato per
il trattamento con radiofrequenza.
Per quanto riguarda i risultati della metodica laser, in letteratura il tasso di
successo immediato è prossimo al 100%. Sebbene non esistano ancora dati a
lungo termine che possano permettere una comparazione completa con i risultati a distanza dello stripping, vengono descritti tassi di recidiva variabili
tra il 3 ed il 6% a 3 anni.
Figura 16: Meccanismo d’azione del laser
Patologia cronica del circolo superficiale
51
Le complicanze post-operatorie si limitano alla presenza saltuaria di un arrossamento cutaneo lungo il decorso della vena sottoposta a trattamento, associato, in alcuni casi, alla presenza di un cordone dolente. Tale sintomatologia scompare, comunque, entro 7-10 giorni.
La principale critica che viene fatta alle metodiche endovascolari riguarda il
fatto che non vengono trattate le vene collaterali della crosse che possono essere la causa di recidiva varicosa. I dati attualmente presenti in letteratura dicono che questo non rappresenta un limite in quanto il tasso di recidive non è
aumentato. Alcuni Autori, oltretutto, sostengono che lo spazio di circa 1,2 cm
lasciato tra l’inizio dell’azione del catetere e la crosse abbia un’azione preventiva sulla formazione delle recidive in quanto consentirebbe il deflusso
dei rami collaterali della crosse. Uno dei principali fattori che portano alle
recidive è la neoangiogenesi, che riconosce come stimolo principale l’ostruzione di un vaso; secondo tali Autori il meccanismo neoangiogenetico verrebbe inibito proprio dal breve tratto lasciato libero poco prima della crosse.
Tromboflebite superficiale
È un processo trombotico che interessa le vene superficiali.
La tromboflebite superficiale si distingue dalla trombosi venosa profonda sia
per la diversa localizzazione anatomica sia per la componente etiopatogenetica che in questo caso è rappresentata da uno stato infiammatorio piuttosto che
da una condizione di stasi e/o ipercoagulabilità. Il trombo si presenta adeso
alla parete venosa sin dall’inizio e la prognosi è favorevole e meno grave rispetto a quella di una trombosi venosa profonda. Spesso si assiste alla risoluzione spontanea del processo trombotico ed una buona terapia porta, quasi
sempre, alla ricanalizzazione anche completa della vena interessata. Tra le
cause che possono determinare una tromboflebite superficiale vi sono la malattia varicosa (causa più frequente), i traumi, l’immobilizzazione prolungata,
la gravidanza, le infezioni, le neoplasie, cause iatrogene (fleboclisi, esami
strumentali, agocannule).
Si possono distinguere forme mono-episodiche e forme ricorrenti.
Le forme mono-episodiche si caratterizzano per il fatto che il processo trombotico si esaurisce nel momento in cui si spegne la reazione infiammatoria ed
il paziente guarisce dalla malattia con la scomparsa completa di tutti i segni e
i sintomi. Possono essere idiopatiche o secondarie. Le tromboflebiti idiopatiche costituiscono meno del 10% dei casi, mentre le forme secondarie sono
quelle più frequenti.
Le tromboflebiti ricorrenti si caratterizzano per il fatto che, anche dopo la fine della fase infiammatoria acuta, i segni e i sintomi della malattia si riduco-
52
Capitolo 3
no ma non scompaiono ed il processo infiammatorio tende a ripetersi nel
tempo. Anche le forme ricorrenti vengono distinte in idiopatiche e secondarie. In questo gruppo, le forme idiopatiche sono più frequenti e rappresentano
il 20-50% dei casi. Le forme secondarie costituiscono circa il 50-80% dei casi
e sono correlate soprattutto alla presenza di patologie che riconoscono un
substrato etiopatogenetico di tipo infiammatorio, quali ad esempio le mesenchimopatie reattive (panarterite nodosa, dermatomiosite, lupus eritematoso
sistemico, sclerodermia, Morbo di Crohn), gli stati iperuricemici, le arteriti,
l’ernia diaframmatica ed anche fenomeni infiammatori focali (dentali, tonsillari, urogenitali, cutanei). Esistono, inoltre, le trombo-flebiti superficiali ricorrenti paraneoplastiche. In questi casi è soprattutto l’attivazione di uno stato procoagulativo ed infiammatorio indotto dalle cellule tumorali ad indurre
la trombosi.
Eziopatogenesi
La patogenesi della tromboflebite, in generale, è essenzialmente legata allo stato di flogosi ed alle alterazioni endoteliali da esso indotte. Da parte loro le cellule endoteliali, stimolate da alcuni fattori del complemento, esprimono una
serie di molecole di adesione per i leucociti circolanti. Si tratta in particolare di
molecole della classe delle E-Selectine e delle P-Selectine come le ICAM-1,
ICAM-2 e ICAM-3 che legano i leucociti neutrofili ed i monociti circolanti nel
sangue. A seguito di quest’interazione vengono liberate alcune citochine sia da
parte delle cellule endoteliali che dei leucociti. In particolare vengono rilasciate
IL-2, IL-1 e TNF che agiscono sia amplificando la risposta infiammatoria, sia
inducendo uno stato procoagulativo locale. Ad esempio l’IL-1 riduce la sintesi
del fattore di attivazione del plasminogeno (t-PA) ed aumenta quella dell’inibitore del plasminogeno (PAI-1), aumenta l’espressione del fattore VII, favorisce
l’attivazione del fattore X.
Clinica e diagnosi
La sintomatologia è caratterizzata da un senso di pesantezza accompagnato a
bruciore e dolore che viene esacerbato dalla palpazione. Può essere presente
febbre. All’esame obiettivo si potrà notare la presenza di una zona arrossata
intorno al decorso della vena interessata dal processo trombotico, con indurimento del tessuto circostante indotto da una periflebite di accompagnamento. Può essere presente un lieve essudato, per il concomitante interessamento dei vasi linfatici, e/o la presenza di pallore come conseguenza
di uno stimolo vasocostrittorio.
Questo corteo clinico in genere scompare dopo 7-10 giorni.
Patologia cronica del circolo superficiale
53
La diagnosi viene posta sulla base del quadro clinico; è comunque opportuno
accertarsi che il processo trombotico non interessi anche il circolo venoso
profondo soprattutto se sono coinvolte vene di grosso calibro come la vena
grande safena o il tratto brachiale della vena cefalica. In questi casi un esame
eco-color-Doppler è sufficiente a dirimere il dubbio.
Terapia
La terapia della tromboflebite superficiale è essenzialmente di tipo medico ed
è di facile gestione. Data la relativa benignità di questa condizione clinica,
non è necessario ospedalizzare il paziente.
Si può instaurare un terapia domiciliare somministrando cortisonici a dosaggi elevati accompagnati da anti-infiammatori ed eparine; è preferibile
somministrare eparine per via sottocutanea, soprattutto eparine a basso
peso molecolare.
È, inoltre, molto importante che il paziente osservi un periodo di riposo per
circa due settimane con l’arto sollevato in modo da favorire lo scarico venoso. Sono di giovamento anche alcune creme a base di eparina da applicare
localmente per circa 10 giorni.
Se si tratta di forme secondarie, l’eliminazione della causa scatenante, laddove possibile, evita la comparsa di recidive.
54
Capitolo 3
4. Trombosi venosa profonda
La trombosi venosa profonda (TVP) rappresenta una malattia potenzialmente
fatale che può complicare altre condizioni patologiche che già interessano il
paziente ma che si può anche sviluppare a carico di soggetti sani in maniera
del tutto inaspettata.
Le cause che possono portare alla comparsa di una TVP sono oggetto di studi
da numerosi anni. È stato Wirchow, nel 1856, ad individuare nella stasi venosa,
in uno stato d’ipercoagulabilità e nel danno endoteliale le tre principali condizioni favorenti lo sviluppo di una trombosi venosa. Non è stato possibile, nei
tanti studi presenti in letteratura, individuare uno solo di questi tre fattori come
unico responsabile dello sviluppo del trombo, ma esiste un accordo unanime
sul fatto che sia la stasi venosa a rappresentare la condizione più importante in
considerazione del ridotto flusso ematico e del maggior tempo di contatto tra le
piastrine che si verifica in questa situazione.
L’attivazione dei fattori della coagulazione e la stasi venosa sembrano essere
implicati nella maggior parte delle forme di trombosi venosa. La trombosi in
genere inizia come piccoli aggregati piastrinici che si formano a livello delle
cuspidi valvolari oppure a livello di zone danneggiate della parete venosa.
L’esposizione del collagene endoteliale a seguito di un trauma parietale porta
all’attivazione sia delle piastrine che della trombina.
Etiopatogenesi
L’etiopatogenesi della trombosi venosa profonda rappresenta ancora un problema di difficile risoluzione, mentre è sicuramente possibile identificare delle condizioni predisponesti che aumentano le probabilità di sviluppare una trombosi.
In genere le TVP vengono classificate in forme primitive o idopatiche (quando
non è possibile identificare una causa scatenante) e forme secondarie.
Il sesso femminile è il più colpito, anche se dopo i 40 anni la differenza tra i
due sessi tende a non essere più significativa.
La gravidanza rappresenta un periodo particolarmente a rischio. La presenza
dell’utero gravido determina fenomeni compressivi particolarmente importanti a livello della porzione pelvica ed addominale e, quindi, anche a carico
delle strutture vascolari presenti in queste regioni. Ma la gravidanza è anche
associata ad una maggiore presenza di alterazioni di alcuni fattori della coagulazione, quali il fattore V di Leiden, che aumentano il rischio di trombosi.
L’obesità rappresenta un fattore di rischio per un’eccessiva pressione che
dall’addome si ripercuote sugli arti inferiori. L’obesità, inoltre, si associa ad
55
56
Capitolo 4
uno stile di vita sedentario che favorisce la stasi venosa; in particolare, è la
posizione seduta a rappresentare una condizione molto sfavorevole per un
corretto ritorno venoso.
Di notevole interesse è l’associazione tra le neoplasie e la TVP; si ritiene, da
un lato, che le cellule tumorali possano svolgere, attraverso alcuni antigeni
così come attraverso la produzione di sostanze trombofiliche, un’attività protrombotica e, dall’altro, che masse tumorali possano causare fenomeni compressivi a carico delle strutture venose adiacenti.
Anche malattie delle cellule del sangue quali la policitemia vera, la trombocitosi essenziale, la metaplasia mieloide, la leucemia mieloide cronica e la
mielofibrosi sono associate ad un aumentato rischio di trombosi. Sebbene una
trombocitosi secondaria possa accompagnare queste malattie, sono i disordini
qualitativi delle piastrine a rappresentare il principale substrato fisiopatologico che predispone questi pazienti alla trombosi. Le alterazioni delle
piastrine riguardano essenzialmente il metabolismo dell’acido arachidonico,
alterazioni ultrastrutturali della cellula piastrinica, alterazioni dei recettori linfocitari Fc. Spesso i fenomeni trombotici in questi pazienti si osservano in
sedi poco usuali quali ad esempio a livello splenico, portale o mesenterico.
Ad esempio, nella Sindrome di Budd-Chiari le condizioni predisponenti che
più spesso vengono identificate sono proprio le malattie mieloproloferative e
l’emoglobinuria parossistica notturna. Nei pazienti affetti da iperlipidemia, la
membrana piastrinica cellulare ha un maggior carico di colesterolo che sembra predisporre ad una maggiore sensibilità delle piastrine ai fattori aggreganti, probabilmente attraverso un aumentato rilascio di trombossano. Poiché il
carico di colesterolo della membrana piastrinica è correlato alla concentrazione plasmatica di colesterolo, diminuendo la colesterolemia si potrebbe ridurre il rischio trombotico.
Anche il diabete mellito rappresenta un fattore di aumentato rischio trombotico. Il diabete, infatti, determina un aumento del rilascio del trombossano A2,
del fattore di von Willebrand, del fibrinogeno, mentre diminuisce la sensibilità delle piastrine alla prostaciclina. Non è chiaro se l’aggregazione piastrinica nei soggetti diabetici sia legata ad un’alterazione primaria a carico
della cellula piastrinica o se possa dipendere da una lesione della parete venosa. Il collagene glicosilato della parete venosa sembra essere un attivatore
piastrinico più potente rispetto al collagene del soggetto normale.
Le cardiopatie, specie lo scompenso cardiaco congestizio o l’infarto del miocardio, presentano un’elevata incidenza di malattia trombotica. I meccanismi
patogenetici sono da attribuirsi all’ipertensione venosa centrale, all’inattività
ed all’ipercoagulabilità dovuta all’ipossia tissutale ed all’acidosi.
Anche le infezioni gravi, sia acute che croniche, aumentano il rischio di TVP,
probabilmente imputabile all’attivazione della via estrinseca della cascata
Trombosi venosa profonda
57
emocoagulativa ad opera di monociti e macrofagi e al danno dell’endotelio
vasale ove i leucociti migrano e si concentrano.
Esistono, inoltre, TVP che si verificano in soggetti predisposti per condizioni ereditarie o acquisite e caratterizzate dalla presenza di fattori bioumorali predisponenti alla trombosi. Si definiscono trombofiliche alcune
condizioni ereditarie che riconoscono una trasmissione genetica di tipo autosomico dominante e sono caratterizzate da anomalie del sistema emostatico. Le trombosi associate a tali condizioni, in genere, si sviluppano in soggetti giovani (40-45 anni) e con una storia familiare positiva per fenomeni
di trombosi. Le trombosi possono essere dovute a deficit degli inibitori della coagulazione (deficit di AT III, delle proteine C o S) o a mutazione del
fattore V di Leiden che determina una resistenza alla proteina C attivata.
Si riconoscono, infine, alcune trombofilie acquisite tra cui è importante ricordare:
- la sindrome da anticorpi anti-fosfolipidi (APA): questi anticorpi hanno dimostrato di comportarsi come anticoagulanti in vitro e come protrombotici in
vivo associandosi a manifestazioni di trombosi arteriose e venose. Essi si sviluppano soprattutto in corso di malattie autoimmuni, di malattie mieloproliferative, neoplastiche, infettive virali.
- l’iperomocisteinemia: è una condizione che si associa, per un meccanismo
non ancora conosciuto, ad un aumento del rischio di trombosi. Un aumento
della concentrazione dell’omocisteina può verifcarsi in soggetti con deficit
degli enzimi coinvolti nel metabolismo della metionina, oppure per deficit
delle vitamine B12, B6, acido folico, anch’esse coinvolte nel metabolismo della metionina. Particolari abitudini di vita quali una dieta ricca di proteine,
l’alcoolismo, l’abuso di caffeina ma anche alcuni farmaci (methotrexate, ciclosporine, antiepilettici, corticosteroidi) possono causare iperomocisteinemia
in questi soggetti predisposti.
La conoscenza di queste basi fisiopatologiche ha permesso notevoli miglioramenti nella terapia della TVP e nella prevenzione delle sue principali conseguenze soprattutto nei confronti dell’embolia polmonare e della sindrome
post-trombotica.
Mezzi diagnostici
L’introduzione di nuove metodiche diagnostiche ed il loro continuo miglioramento ci permettono di acquisire informazioni molto dettagliate sulla sede
e sull’estensione del trombo, ma anche sulla sua epoca di insorgenza, potendo distinguere tra trombosi acute e croniche.
La vera innovazione nella diagnostica per immagini di tutte le malattie venose, così come di quelle arteriose, è stata l’introduzione dell’eco-color-Doppler
58
Capitolo 4
con il quale si possono ottenere informazioni sulle strutture anatomiche, quali
i vasi e gli organi vicini, sulla presenza del flusso, sulla sua direzione e velocità. Nello studio dei vasi la componente ecografica è in grado di individuare
bene sia le pareti vasali che il lume. Le pareti vengono visualizzate come delle strutture iperecogene (bianche) che racchiudono il lume che appare invece
anecogeno (nero) (Fig. 1).
Sarà, pertanto, possibile sapere se le pareti venose si schiacciano sotto la
pressione della sonda oppure se la parete di una vena è ispessita od irrigidita.
Nel primo caso la vena presenta pareti soffici e lume pervio, nel secondo caso
siamo di fronte ad una vena patologica. Ancora, sarà possibile sapere se il
lume venoso è occupato da materiale trombotico (Fig. 2) oppure se è dilatato
o meno.
La componente Doppler, nello studio del sistema venoso profondo, fornisce
informazioni circa la presenza, la direzione e la velocità del flusso. L’operatore pertanto è in grado di capire se ci sono alterazioni importanti del flusso.
Il color in realtà è un effetto cromatografico convenzionale che dipende dal-
Figura 1: Immagine ecografica di una vena normale. Sono visibili i lembi
valvolari
Trombosi venosa profonda
59
l’effetto Doppler e che colora il vaso di azzurro se il flusso si allontana dalla
sorgente e di rosso se il flusso si avvicina.
Il vantaggio principale di questa metodica risiede nella non invasività e nella
non tossicità; quindi può essere ripetuta tutte le volte che si vuole. Gli svantaggi principali sono la notevole dipendenza dalle capacità interpretative
dell’operatore e le difficoltà che si incontrano in alcuni distretti, quali quello
addominale, per la presenza di aria, o nello studio di vasi molto piccoli come
quelli del distretto sotto-popliteo.
Notevoli progressi sono stati fatti nell’utilizzo delle metodiche TC ed RM; queste
tecniche hanno praticamente soppiantato l’uso della flebografia che oggi trova indicazioni molto limitate. Il vantaggio principale della risonanza magnetica rispetto alla tomografia è rappresentato dall’assenza di radiazioni ionizzanti (Fig 3).
Per l’esecuzione sia dell’angio-TC che dell’angio-RM è necessario usare
mezzo di contrasto. Sebbene i mezzi di contrasto iodati di ultima generazione
utilizzati in TC siano molto meno nefrotossici del passato, creano comunque
dei problemi al rene mentre il gadolinio, che è il mezzo di contrasto utilizzato
in risonanza magnetica, non ha questi effetti collaterali.
Gli svantaggi principali della risonanza restano ancora i costi elevati, l’impossibilità di eseguire l’esame nei soggetti claustrofobici ed in quelli portatori di
protesi o clip metalliche o di pace-maker. Si possono avere, inoltre, degli artefatti che possono fuorviare soprattutto un esaminatore poco esperto.
Figura 2: Immagine ecografica di trombosi della vena cava inferiore con
trombo flottante
60
Capitolo 4
Nel panorama della diagnostica per immagini l’esame flebografico viene utilizzato sostanzialmente per il posizionamento dei filtri cavali o per il controllo
della terapia fibrinolitica. È opportuno comunque ricordare che è possibile eseguire due tipi di flebografia: quella ascendente e quella discendente.
La flebografia ascendente permette di studiare bene tanto il circolo venoso
profondo quanto il sistema delle perforanti e può risultare utile soprattutto per
avere un quadro anatomico completo prima di un eventuale intervento chirurgico sul sistema venoso profondo. La flebografia discendente, invece, è in
grado di dare importanti informazioni circa la funzionalità e la localizzazione
valvolare. Essa pertanto è utile nei casi in cui si pensa di intervenire sulle
valvole venose.
Certamente la flebografia fornisce immagini dettagliate circa l’anatomia venosa, tuttavia la notevole invasività rispetto ad altri esami, l’uso di mezzo di
contrasto e l’uso di radiazioni hanno reso la metodica utilizzata solo in casi
selezionati.
La principale e più importante conseguenza della trombosi venosa profonda è
rappresenta dalla possibilità di migrazione di particelle emboliche a livello
polmonare. È chiaro che lo sviluppo di un’embolia polmonare clinicamente
Figura 3: Trombosi della vena poplitea e della vena femorale superficiale di
Sn evidenziata con l’angio-RM
Trombosi venosa profonda
61
importante dipende, da un lato, dalle dimensioni dell’embolo che raggiunge i
polmoni, dall’altro dalle condizioni cliniche del malato. Quindi, la presenza
di una trombosi a livello del segmento iliaco desta più preoccupazione di una
trombosi della porzione infra-poplitea. Ma bisogna anche correlare la situazione clinica locale con quella generale, ovvero valutare la funzionalità respiratoria del paziente; in un soggetto con una malattia polmonare o con un solo
polmone, con una storia di neoplasia oppure con uno o più fattori di rischio
s’impone una sorveglianza attenta anche nelle trombosi molto distali e non
progredite verso i vasi di calibro maggiore.
Anche se, come detto prima, le forme primitive di TVP hanno dei meccanismi fisiopatologici non ancora ben chiariti esistono delle trombosi secondarie
provocate da malattie che possono essere diverse a seconda del distretto anatomico. Inoltre, le manifestazioni cliniche possono essere diverse a seconda
del tratto colpito e richiedono approcci diagnostici e terapeutici differenti.
Pertanto, parleremo in maniera separata delle trombosi venose profonde del
tratto popliteo-femorale e di quelle del tratto iliaco-cavale.
Distretto popliteo-femorale
Il coinvolgimento delle vene profonde degli arti inferiori è sicuramente quello che si verifica più frequentemente. In molti casi la trombosi ha un’origine
sconosciuta e rientra nelle forme iodiopatiche, mentre altre volte è possibile
identificare uno o più fattori predisponenti tra cui soprattutto prolungati periodi di immobilizzazione e la presenza di neoplasie. Gli interventi di chirurgia ortopedica a livello degli arti inferiori, ed in particolare del ginocchio,
rappresentano uno dei principali fattori di rischio di trombosi venosa profonda in questo distretto, a causa del prolungato periodo d’immobilizzazione
dell’arto che si associa anche all’edema post-operatorio e, spesso, anche al
traumatismo.
Diagnosi clinica
Il quadro clinico può essere silente oppure può essere caratterizzato da dolore
a livello del polpaccio o anche della coscia e dell’inguine, mai a livello delle
dita del piede. In genere il dolore inizia come una dolenzia o come crampi
notturni e senso di costrizione e si esacerba gradualmente nel giro di qualche
giorno, per diventare poi un dolore franco di tipo continuo che si accentua
con l’attività fisica e tende a migliorare, anche se poco, con il riposo a letto e
con l’arto sollevato. Sebbene il paziente possa riferire dolore a livello del pol-
62
Capitolo 4
paccio, questo non indica una localizzazione soltanto a livello delle vene di
questo segmento; vi è una scarsa correlazione tra la localizzazione del dolore
e l’estensione del trombo.
Il segno clinico principale è l’edema dell’arto interessato associato ad un rossore che indica lo stato d’infiammazione. In genere l’edema è monolaterale e
questo, da un certo punto di vista, facilita la diagnosi. La presenza di un edema bilaterale è spesso indice di malattie sistemiche, in particolare di uno
scompenso cardiaco congestizio, ma potrebbe essere anche dovuto ad una
trombosi cavale. È presente inoltre il segno della “fovea” che persiste per diversi minuti. L’arto, inoltre, si presenta caldo e dolente alla compressione. Il
paziente dovrebbe essere esaminato in posizione supina con le gambe flesse,
così da rilassare la muscolatura del polpaccio.
La compressione del gastrocnemio sul piano osseo tibiale evoca un vivace
dolore nel paziente con trombosi venosa profonda (segno di Bauer), dolore
che viene esacerbato anche dalla dorsi-flessione del piede sulla gamba (segno
di Homans).
In alcuni casi la gamba, anziché arrossata e calda, si può presentare pallida,
molto dolente e turgida con interessamento dell’intero arto inferiore e la presenza di circoli collaterali a livello inguinale. Questo quadro in genere configura una trombosi che coinvolge anche le vene iliache e che, in passato, era
conosciuto col nome di “arto da latte” poiché veniva riscontrato frequentemente nelle puerpere.
Esistono altre condizioni cliniche che possono simulare una TVP in questo
distretto e che è importante tener presenti per porre diagnosi differenziale. Le
artriti delle articolazioni degli arti inferiori si associano ad edema e dolore
che tende ad esacerbarsi col movimento. In questi casi bisogna pensare alla
presenza di un’artrite soprattutto se ci sono altre articolazioni che ne sono affette. Il linfedema è una delle condizioni in cui risulta molto difficile, se non
impossibile porre diagnosi differenziale con la trombosi venosa profonda al
solo esame clinico. Anche nel linfedema, infatti, l’arto si può presentare edematoso, teso, dolente. È presente il segno della fovea che persiste dopo la
digitopressione. L’ausilio delle metodiche strumentali risulta pertanto imprescindibile.
La presenza, alla palpazione, di un cordoncino duro e dolente lungo il decorso
di una vena superficiale è indice di tromboflebite superficiale, che potrebbe essere associata anche ad un interessamento del circolo venoso profondo.
Anche i traumi contusivi possono essere messi in diagnosi differenziale; questi si possono associare ad un ematoma, oltre che al gonfiore dell’arto. In genere un ematoma importante si verifica solo nei soggetti che assumono anticoagulanti e la diagnosi differenziale è facilitata dalla presenza del trauma
nella storia clinica del malato.
Trombosi venosa profonda
63
Diagnosi strumentale
L’indagine diagnostica principale in una trombosi venosa profonda del distretto popliteo-femorale è l’eco-color-Doppler. La sensibilità e la specificità
di quest’esame sono prossime al 100% per quanto riguarda l’esplorazione
della vena poplitea (Fig. 4) e delle vene femorali, mentre vi è una maggiore
possibilità di avere dei risultati falsi positivi o falsi negativi nell’esplorazione
delle vene intramuscolari (gemellari in particolare) e di quelle intermuscolari
(vene tibiali).
Le vene normali presentano delle pareti sottili che all’eco si presentano
“bianche” (iperecogene), mentre il flusso appare “nero” (anecogeno). Il flusso normale deve essere fasico con gli atti del respiro; deve, cioè, aumentare
nella fase espiratoria e diminuire in quella inspiratoria.
Figura 4: Rappresentazione ecografica di un’ostruzione della vena poplitea
64
Capitolo 4
Esistono dei segni diretti e dei segni indiretti di trombosi venosa profonda. I
segni diretti sono l’assenza di flusso all’interno del segmento venoso esplorato, ovvero la mancanza di segnale Doppler, l’incoprimibilità del vaso trombizzato, la visualizzazione del trombo all’interno del vaso. Bisogna precisare,
però, che il trombo appena formato (trombo fresco, tipico della fase acuta
della trombosi) non è visualizzabile all’ecografia poiché ha la stessa ecogenicità del sangue ed inoltre risulta soffice e comprimibile. Un trombo di vecchia data appare come un’immagine “brillante” ovvero nettamente iperecogena, è duro e non si lascia comprimere.
Il trombo può causare un’occlusione totale o parziale del vaso. Nel primo caso, quando il trombo è recente e, quindi anecogeno, l’unico segno visibile è
una dilatazione della vena con flusso assente. In genere il trombo inizia a retrarsi entro poche ore dalla sua formazione lasciando uno spazio, tra sé e la
parete vasale, all’interno del quale potrebbe essere presente una piccola quantità di flusso evidenziabile all’esame Doppler, con un’immagine a “binario”
abbastanza tipica. La presenza di un trombo che non occlude completamente
il lume vasale con una coda flottante è tipica di una trombosi di recente formazione. Un trombo di vecchia formazione apparirà, invece, molto rifrangente e sarà possibile vedere se ostruisce parzialmente o completamente il lume
venoso. In genere, però, i trombi dopo qualche tempo tendono a riassorbirsi
parzialmente determinando una ricanalizzazione incompleta del vaso. Da ciò
ne deriva che una trombosi di vecchia data è caratterizzata da un’immagine
endoluminale notevolmente iperecogena e dal profilo irregolare. La vena si
presenta con pareti sclerotiche ed ispessite ed il lume si potrà presentare ristretto rispetto alla norma.
Esistono anche segni indiretti di trombosi, il più importante dei quali è costituito dalla presenza di un flusso non più fasico con gli atti del respiro ma di
tipo continuo. Questo è un indice abbastanza certo di trombosi venosa nei distretti a valle (ovvero nelle zone prossimali del corpo rispetto al distretto in
esame) del segmento che si sta esaminando. Pertanto, la presenza di un flusso
di questo tipo a livello, ad esempio, della vena femorale comune e indice di
una trombosi a livello iliaco.
Alcuni problemi si possono avere nei pazienti con un esame eco-color-Doppler
negativo ma sintomatici. È stato infatti stimato che in circa il 30% dei casi di
trombosi limitata ai vasi infrapoplitei non è possibile porre diagnosi sulla base
del solo reperto eco-color-Doppler. Quindi, quando il paziente è sintomatico
ma il Doppler è negativo, può essere utile integrare con altre metodiche diagnostiche quale l’angio-RM o l’angio-TC. In realtà, queste metodiche non sempre
forniscono informazioni supplementari al Doppler nel distretto infrapopliteo,
mentre risultano estremamente importanti se il processo trombotico interessa il
distretto iliaco-cavale. Pertanto, se il Doppler è negativo ma il paziente è sin-
Trombosi venosa profonda
65
tomatico e sono state escluse altre cause responsabili della sintomatologia, è
sufficiente una stretta sorveglianza del paziente; ripetendo l’esame ultrasonografico dopo 5-7 giorni si riesce a dirimere i dubbi diagnostici.
Esami di laboratorio
Gli esami di laboratorio vengono effettuati per avere ulteriori informazioni
sulla storia naturale della malattia e per la verifica del risultato della terapia.
In particolare viene effettuato il dosaggio del fibrinogeno e dei D-dimeri.
I livelli plasmatici dei D-dimeri derivano dal rapporto tra la loro formazione e
la loro clearance. Questo test è stato anche proposto per l’esclusione della
diagnosi di TVP. Il test ha, infatti, un elavato valore predittivo negativo che
consente di escludere la diagnosi. Livelli elevati di D-dimeri possono essere
espressione di diverse patologie (C.I.D., infarto del miocardio, neoplasie,
traumi, emorragie, etc.).
La maggiore significatività del test si osserva nei pazienti sintomatici ma con
esame ultrasonografico negativo; in questi casi un dosaggio normale dei Ddimeri consentirà, quasi sempre, di escludere la diagnosi; non si può, infatti,
essere certi che il paziente sia assolutamente scevro dal rischio di trombosi.
In alcune condizioni quali l’iperfibrinolisi, per un’erronea definizione del valore limite, in caso di sintomatologia insorta da più di 7-10 giorni, il dosaggio
dei D-dimeri è nei limiti della norma, anche se si è verificata una trombosi.
Viceversa, in presenza dei sintomi e di positività del test bisognerà controllare il paziente nel tempo perché ad elevato rischio trombotico.
È inoltre fondamentale, nella diagnosi delle forme primitive, il dosaggio dei
fattori che sono associati ad un maggiore rischio trombotico; in particolare si
potrà avere un aumento dell’omocisteinemia e del fattore V di Leiden. Si potrà, invece, avere una riduzione dell’antitrombina III, inibitore delle serinaproteasi che inattiva la trombina; saranno ridotte anche le proteine C ed S.
Queste ultime sono fattori vitamina K-dipendenti che, quando convertiti in
forma attiva, diventano potenti anticoagulanti.
Terapia
Gli obiettivi della terapia della trombosi venosa profonda nel distretto popliteo-femorale sono rivolti essenzialmente alla prevenzione della progressione
del trombo e del distacco di particelle emboliche. Mentre gli anticoagulanti
(eparine e warfarina) hanno il compito di inibire l’accrescimento del trombo,
esistono diversi presidi terapeutici il cui obiettivo è l’eliminazione del trombo
all’interno del vaso (fibrinolisi e trombectomia).
66
Capitolo 4
Terapia medica
Il trattamento con anticoagulanti è indicato nelle trombosi venose acute poiché in quelle di vecchia data non sussiste un reale pericolo di formazione di
nuovi trombi.
Il trattamento iniziale consiste nella somministrazione di eparina che andrà poi
sostituita con la warfarina. Dopo che, con quest’ultimo farmaco, si sarà raggiunto il valore terapeutico del PT e dell’INR, l’eparina verrà sospesa. Il PT
deve essere compreso tra il 40% ed il 20% dell’attività di protrombina, mentre
l’INR, che è un indice più specifico dell’efficacia terapeutica, deve essere compreso tra 2,5 e 3,5. In genere il raggiungimento dei valori terapeutici si ottiene
dopo 3-5 giorni dall’inizio della somministrazione della warfarina.
L’eparina è un polisaccaride solfato carico negativamente che viene prodotto
nell’organismo dai mastociti. L’eparina inibisce la formazione della trombina
agendo sul fattore X attivo della cascata emocoagulativa. Oggi vengono utilizzate due grandi categorie di eparine: quelle non frazionate, o eparine ad
alto peso molecolare (HMWH), e quelle frazionate, di più recente introduzione, dette anche a basso peso molecolare (LMWH).
L’eparina non frazionata ha un peso molecolare compreso tra 4.000 e 40.000
D. Essa inibisce, attraverso l’AT III, la trasformazione dei fattori IX, X, XI,
XII nelle forme attive. L’eparina, pertanto, ha un’efficacia limitata nei soggetti con deficit dell’AT III nei quali la somministrazione di plasma fresco
congelato può far recuperare l’efficacia del trattamento eparinico. Inoltre,
l’eparina catalizza l’inibizione della trombina ad opera del cofattore eparinico
II. Essa viene utilizzata in commercio come sale sodico o calcico; quest’ultimo consente soltanto la somministrazione per via sottocutanea, mentre l’eparina sodica può essere somministrata per via endovenosa o anche sottocutanea. La somministrazione per via sottocutanea nella terapia della trombosi
venosa profonda acuta va praticata con due somministrazioni quotidiane in
quanto il picco d’efficacia si raggiunge dopo 4-6 ore e l’effetto anticoagulante
dura dalle 8 alle 12 h, a seconda della dose somministrata.
L’effetto della somministrazione endovenosa, invece, è immediato ed inoltre
l’infusione continua di eparina garantisce una farmacodinamica più lineare
rispetto alla somministrazione per via sottocutanea ed è associata a pochissimi fenomeni emorragici. Si può somministrare un bolo iniziale di 200-250
U.I./kg di eparina seguito dall’infusione continua di 1.000-2.000 U.I./h. La
risposta va monitorata con il controllo dei valori dell’aPTT che devono essere
mantenuti tra 1,5 e 2 volte i valori di riferimento. È, inoltre, importante controllare la conta piastrinica per la possibilità di sviluppo di anticorpi antipiastrine eparina-indotti. La somministrazione di eparina dovrebbe continuare
per 7-10 giorni prima di passare alla terapia anticoagulante orale.
Trombosi venosa profonda
67
Le principali complicanze legate alla somministrazione di eparine non frazionate sono rappresentate dall’emorragia, dall’osteoporosi e da una sindrome
particolare nota come sindrome trombocitopenica eparino-indotta.
L’emorragia si verifica nel 3-4% dei casi e rappresenta la complicanza più
grave. Essa può essere più frequente nei soggetti anziani per la presenza di
disturbi del metabolismo e, per lo stesso motivo, anche nei soggetti con alterazioni metaboliche quali diabetici, obesi o pazienti cachettici.
Esistono due tipi di trombocitopenia eparino-indotta, ma soltanto uno è associato ad un maggiore rischio di complicanze trombotiche. Il primo tipo, che si
verifica 2-3 giorni dopo la somministrazione dell’eparina, è transitorio e senza sequele cliniche. Il secondo tipo si verifica in circa il 4% dei pazienti sottoposti a trattamento eparinico. Questa condizione in genere insorge tra il 4°
ed il 15° giorno dall’inizio del trattamento eparinico ed è indipendente dalla
quantità, dalla modalità di somministrazione e dal tipo di eparina (sodica o
calcica) somministrata. Si tratta di una reazione immuno-mediata che porta
alla formazione di anticorpi diretti contro le piastrine oppure contro il complesso piastrine-eparina. La sindrome deve essere sospettata in tutti i pazienti
che hanno una riduzione marcata del numero di piastrine (>30%, oppure meno di 100.000 cellule/dl), nei pazienti che dimostrano una resistenza
all’eparina o in caso di manifestazioni trombo-emorragiche. La diagnosi viene confermata quando la conta piastrinica aumenta al momento della sospensione del trattamento eparinico. Nei soggetti in cui insorge questa sindrome,
l’eparina va sospesa e non andrebbero utilizzate nemmeno le eparine a basso
peso molecolare per il rischio di una reattività crociata. Possono essere utilizzati altri farmaci quali gli eparinoidi, oppure l’aspirina, ma solo qualora ve ne
fosse una necessità urgente.
L’osteoporosi si verifica nei soggetti che fanno uso di eparina non frazionata
da tanto tempo (in genere da più di sei mesi) ed è correlata a dosi elevate
(>10.000 U.I./giorno).
L’eparina a basso peso molecolare (LMWH) deriva dalla frammentazione, enzimatica o chimica, dell’eparina non frazionata ed è costituita da un frammento dal peso molecolare che varia a seconda della molecola e che si aggira
mediamente intorno ai 5.000 Dalton. L’LMWH ha un’azione strettamente dose dipendente e l’efficacia è assicurata dalla ridotta interazione con le proteine
plasmatiche diverse dall’AT III e con le piastrine. Essa va somministrata a dosi fisse che variano in base al tipo di molecola; in genere si utilizza una doppia
somministrazione giornaliera a scopo terapeutico, anche se un numero sempre
crescente di preparazioni rende possibile la mono-somministrazione anche a
dosi terapeutiche. Sebbene non sia necessario controllare i valori emocoagulativi, sarebbe opportuno valutare l’efficacia dell’effetto anti-Xa nei soggetti con
insufficienza renale ed in generale nei pazienti con disturbi metabolici.
68
Capitolo 4
L’LMWH, nella terapia della TVP, va embricata sin dal primo giorno con
la warfarina (a meno che non esistano controindicazioni particolari) fino al
raggiungimento di valori di INR compresi tra 2,5 e 3,5 (in genere l’effetto
terapeutico della warfarina si ottiene in 3-5 giorni). L’indroduzione
dell’eparina a basso peso molecolare ha molto ridotto l’utilizzo degli altri
tipi di eparine. La notevole maneggevolezza di questa molecola e la possibilità di non monitorare i valori emocoagulativi ne rende possibile l’utilizzo
domiciliare e attualmente l’LMWH rappresenta, presso molti Centri, la pietra miliare nel trattamento ambulatoriale della trombosi venosa profonda.
Essa trova impiego anche in alternativa alla terapia anticoagulante orale nei pazienti in cui quest’ultima è controindicata, ad esempio nelle donne in gravidanza. Sebbene, però, la possibilità di trattare i pazienti a domicilio sia uno dei
vantaggi più importanti di questo tipo di terapia, bisogna porre attenzione alle
condizioni generali dei malati. Sono diverse, infatti, le condizioni che possono
aumentare il rischio di emorragia quali ad esempio le coagulopatie in generale,
le epatopatie, le piastrinopenie, la presenza di ulcere, la tendenza a cadere delle
persone anziane. Sarebbe, inoltre, opportuno ospedalizzare i soggetti con pregressa TVP e, soprattutto, quelli con pregressa embolia polmonare (EP) nei
quali esiste un rischio maggiore di recidiva, anche se i dati in letteratura non
sono completamente univoci al riguardo. Un'altra considerazione molto importate è che la terapia domiciliare dovrebbe essere avviata nei soggetti più collaboranti, che siano in grado di capirne le problematiche e di collaborare con i
medici ed il personale paramedico.
Un ultimo accenno va fatto alle TVP insorte durante la gravidanza o alla fine.
L’LMHW può essere tranquillamente utilizzata in gravidanza a dosaggio terapeutico, mentre è opportuno sospenderne la somministrazione al momento del
travaglio e, naturalmente, del parto. La terapia potrà essere ripresa dopo il parto, già il giorno successivo, ed embricata con la warfarina che non è controindicata durante l’allattamento. Inoltre, poiché il puerperio rappresenta un periodo
ad alto rischio trombo-embolico la terapia andrà continuata almeno per 1 mese
dopo il parto o per 3 mesi dall’episodio di TVP.
Le complicanze della terapia con LMWH sono grosso modo le stesse delle
HMWH, anche se con un’incidenza ed una gravità inferiori. Bisogna però
precisare che in caso di gravi manifestazioni emorragiche il solfato di protamina, che agisce efficacemente nei riguardi dell’eparina non frazionata, ha
scarsi risultati con l’eaprina a basso peso molecolare e, in questo caso, sarebbe meglio somministrare plasma fresco. È opportuno, comunque, in caso di
complicanze, ospedalizzare il paziente per una migliore osservazione ed un
eventuale trattamento.
La necessità di adottare una terapia anticoagulante orale (TAO) nel trattamento delle TVP è stata validata da più studi.
Trombosi venosa profonda
69
Le due categorie di anticoagulanti orali sono i cumarinici (warfarina, dicumarolo e nicumadone) e l’indonedione che però viene utilizzato raramente a
causa dei suoi effetti collaterali.
La warfarina è l’anticoagulante orale maggiormente utilizzato. A seguito dell’assorbimento gastrointestinale, il 97% della warfarina si lega all’albumina,
mentre il restante 3% è responsabile dell’attività anticoagulante. L’emivita
plasmatica va da 36 a 40 ore ed il picco si ottiene dalle 2 alle 4 h ore dopo la
somministrazione. La warfarina interferisce con la sintesi epatica dei fattori
vitamina K-dipendenti (II, VII, IX, X); pertanto, il suo effetto si ottiene a seguito della naturale degradazione di tali fattori. È per questo motivo che l’effetto terapeutico si ottiene dopo alcuni giorni dall’inizio della sommonistarzione. La warfarina, inoltre, diminuisce la concentrazione della proteina C e
della proteina S per cui, se nei primi giorni della terapia non venisse somministrata l’eparina, si potrebbero verificare dei fenomeni trombotici soprattutto
nei pazienti che hanno già dei deficit congeniti di queste proteine.
La dose iniziale di warfarina è di circa 10 mg al giorno, mentre le dosi successive vengono somministrate in base ai valori del PT e dell’INR; quest’ultimo
deve essere compreso tra 2,5 e 3,5 volte i valori di riferimento; ovviamente valori troppo bassi indicano una scarsa efficacia della terapia, mentre valori troppo alti aumentano il rischio emorragico. La necessità di dover dosare la terapia
in base ai valori emocoagulativi costituisce il principale limite di questo farmaco. Nei primi giorni di terapia il paziente è infatti costretto a sottoporsi a prelievi ematici due o tre volte in una settimana, in quanto il dosaggio va personalizzato e varia da paziente a paziente. Ad esempio, il metabolismo delle persone
anziane potrebbe essere alterato così come si potrebbero avere concentrazioni
ridotte dei fattori della coagulazione; per questo nei soggetti anziani la dose iniziale potrebbe essere più bassa che nei soggetti giovani.
In genere dopo 7-10 giorni di controlli ematici si può ripetere il prelievo ematico anche ad intervallli di 20-25 giorni.
L’altro limite di questa terapia è rappresentato dall’autosomministrazione. Non
sempre, infatti, il paziente è in grado di assumere le dosi che gli vengono consigliate, per cui si possono avere dei fenomeni di sovra- o sottodosaggio. La
terapia va continuata per 6-8 mesi dall’episodio di trombosi venosa profonda.
La principale complicanza della terapia con warfarina è rappresentata dai fenomeni emorragici. Le emorragie fatali hanno un’incidenza di 1 caso/100/anno, mentre quelle non fatali hanno un’incidenza di 4-16 casi/100/anno. L’effetto della warfarina può essere antagonizzato entro 24 h
dalla somministrazione endovenosa di 20 mg di vitamina K oppure, in caso
di emorragie gravi, si può somministrare plasma fresco congelato.
La gangrena del derma è una rara, e potenzialmente devastante, complicanza
della terapia con la warfarina. La sua etiologia è stata attribuita alla trombosi
70
Capitolo 4
microvascolare che si verifica subito dopo la somministrazione nei soggetti
con deficit congeniti o acquisiti della proteina C.
Ci sono diverse sostanze che interferiscono con il metabolismo della warfarina. L’interferenza si può verificare sia nel potenziamento che nell’attenuazione dell’attività del farmaco. Si tratta sia di farmaci che di alimenti (Tab.
1). Ad esempio, tra i farmaci che aumentano l’attività della warfarina ricordiamo l’aspirina, l’amiodarone, l’omeprazolo, l’eritromicina, il cotrimossazolo, la ciprofloxacina. Gli alimenti che hanno lo stesso effetto sono l’aglio, la
salvia ed il pompelmo. Diminuiscono, invece, l’attività della warfarina la vitamina C, i barbiturici, il sucralfato, la dicloxacina, gli anticoncezionali orali,
gli antiasmatici. I prodotti alimentari che hanno lo stesso effetto sono tutti
quelli ricchi di vitamina K, come le verdure fresche a foglie verde scuro, ma
anche i cavoli, gli spinaci, i piselli, il grano integrale, il latte e i suoi derivati.
È chiaro che non si possono eliminare dalla dieta di un paziente alimenti così
importanti ma è, invece, giusto che il paziente segua un regime alimentare
equilibrato e soprattutto costante così da poter aggiustare le dosi del farmaco
in base al suo metabolismo.
Anche il diabete mellito e l’ipotiroidismo influiscono negativamente sull’azione della warfarina. L’alopecia, la dermatite, la febbre, la diarrea sono effetti indesiderati della terapia anticoagulante orale.
Se è vero che la terapia anticoagulante orale rappresenta un presidio farmacologico essenziale nel trattamento della trombosi venosa profonda acuta, così
come in altre condizioni in cui è fondamentale scongiurare il rischio di formazione di trombi quale la fibrillazione atriale, è altrettanto vero che esistono
delle condizioni cliniche che controindicano l’uso di questi farmaci. Le controindicazioni assolute sono rappresentate da fenomeni emorragici di recente
insorgenza (< 1 mese), nei quali il rischio di nuove emorragie è troppo elevato, e dalla gravidanza. La warfarina, infatti, oltrepassa la barriera placentare
ed esercita effetti teratogeni sul feto nei primi tre mesi di gravidanza; il farmaco è controindicato anche nelle ultime 6 settimane di gravidanza per il rischio di emorragie molto serie durante il parto.
Le condizioni che rappresentano una controindicazione relativa sono diverse
e tra queste ricordiamo la presenza di un aneurisma dell’aorta addominale, un
aneurisma cerebrale, una grave ipertensione, la presenza di ulcera peptica, di
varici esofagee (tutte condizioni in cui esiste chiaramente un aumento rischio
di sanguinamento) e l’età superiore agli 80 anni. I soggetti anziani, infatti,
possono avere alterazioni metaboliche che interferiscono con l’efficacia del
farmaco, oppure possono essere portatori di patologie che rendono rischioso
l’utilizzo degli anticoagulanti. Infine, non bisogna sottovalutare le difficoltà
che gli anziani possono avere nel seguire correttamente la terapia a causa della presenza di patologie neurologiche di diversa natura.
Trombosi venosa profonda
71
Tabella 1: Sostanze che interferiscono con il metabolismo della warfarina
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
•
WARFARINA
POTENZIANO L’AZIONE
ATTENUANO L’AZIONE
Amiodarone (antiaritmico)
• Alimenti ricchi di vit. K: verdure
fresche a foglie verde scuro,
broccoli, lattuga, cavoli, spinaci,
thè verde, asparagi, avena,
fagiolini, grano integrale, piselli
freschi
Latte e derivati, alcoolici
Omeprazolo (gastroprotettore,
• Vitamina C
inibitore pompa acida)
Fenilbutazone
• Barbiturici (antiepilettici)
Piroxicam (antinfiammatorio
• Carbazepina (antiepilettici)
ed antireumatico)
Propafenone (antiaritmico)
• Griseofulvina (antimicotico)
Eritromicina
• Rifampicina
Cimetidina (ulcera peptica,
• Sucralfato (antiulcera – citogel)
reflusso gastrico)
Steroidi
• Dicloxacina (antibiotico)
Clofibrato
• Diabete mellito
Propanololo
• Ipotiroidismo
Cotrimossazolo
• Anticoncezionali orali
Ciprofloxacina
• Antiasmatici
Tetramicina
Vaccino anti-influenzale
Aspirina
Norfloxacina (antibiotico)
Clima caldo prolungato
Aglio - Salvia - Pompelmo
Terapia elasto-compressiva
Sebbene la terapia compressiva risalga ai tempi di Ippocrate, i primi studi sul
bendaggio elastico sono stati pubblicati nel 1931 da Dickson-Wrigth.
Le prime calze elastiche sono state sviluppate nel 1940 da Conrad Jobst, un
ingegnere affetto da ulcere venose che da solo progettò delle calze elastiche
72
Capitolo 4
come terapia della sua malattia. Le calze elastiche determinano un gradiente
pressorio in senso caudo-craniale che si oppone in maniera meccanica alla
stasi venosa ed alla formazione dell’edema.
L’indicazione all’applicazione della terapia elasto-compressiva si pone immediatamente quando si fa diagnosi di trombosi venosa acuta del sistema venoso profondo dell’arto inferiore, in assenza di segni d’instabilità del trombo
(adesione non completa alla parete venosa, trombo flottante). In tal modo si
può permettere la deambulazione precoce del paziente, contrariamente a
quanto si riteneva fino a qualche anno fa quando si immobilizzava il paziente
per 5-6 giorni.
La terapia elasto-compressiva si avvale sia di fasce elastiche che di calze elastiche. Le calze elastiche in commercio hanno gradi diversi di compressione.
La loro azione è rivolta da aiutare il naturale flusso venoso verso il cuore,
imprimendo una pressione che è massima a livello della caviglia e diminuisce
risalendo verso la radice dell’arto.
Nella trombosi venosa profonda vanno usate calze che imprimono una pressione di 20-40 mmHg. Sebbene esistano diversi tipi di calze elastiche, quali
collant, mono-collant, calzini, etc., bisognerebbe evitare di applicare calze
che si fermano al ginocchio o al 1/3 inferiore di coscia.
Questo tipo di presidio determina, infatti, un’azione limitata alla sola
gamba; in questo modo, da un lato non svolge alcuna azione a livello di
coscia, dall’altro l’elastico posto nella parte superiore comprime il circolo venoso superficiale ostacolando il ritorno del sangue dalla gamba
verso la coscia.
La terapia elasto-compressiva, insieme all’anticoagulazione, rappresentano i
cardini della terapia della trombosi venosa profonda acuta del distretto popliteo-femorale, mentre la terapia chirurgica trova indicazioni particolari e non
viene utilizzata da tutti.
Terapia chirurgica
La terapia chirurgica della TVP acuta, il cui obiettivo è quello di ripristinare il flusso venoso il più rapidamente possibile, nel distretto infrainguinale si basa fondamentalmente su due tipi di tecniche: la fibrinolisi e la trombectomia.
È anche vero che, se per i vasi al di sopra del legamento inguinale ci sono
maggiori consensi circa la necessità di adottare anche un trattamento chirurgico oltre che medico, le indicazioni alla terapia chirurgica nel distretto infrainguinale non vengono accettate da tutti, mentre non si ritiene necessaria
una terapia diversa da quella medica per le trombosi venose profonde acute
del distretto infrapopliteo.
Trombosi venosa profonda
73
Fibrinolisi
La procedura consiste nella somministrazione di un farmaco attivatore del
plasminogeno tissutale che porta alla degradazione del trombo da parte della
plasmina. Le molecole disponibili in commercio sono rappresentate dalla
streptokinasi, dall’urokinasi, dall’attivatore tissutale del plasminogeno (tPA)
e dall’attivatore tissutale ricombinante del plasminogeno (rt-PA). Mentre la
streptokinasi, a causa della sua origine batterica, ha notevoli proprietà antigeniche che possono scatenare reazioni avverse, l’urokinasi, prodotta da proteine umane, e l’rt-PA, prodotto in laboratorio, non sono assolutamente antigenici.
Attualmente il farmaco utilizzato più frequentemente nella trombosi venosa
profonda è l’urokinasi. La fibrinolisi come scelta terapeutica per questo tipo
di patologia è stata introdotta nel 1968. Agli inizi veniva eseguita per via sistemica ed aveva il grande svantaggio della scarsa specificità d’azione del
farmaco a livello della zona trombizzata e dei notevoli effetti collaterali, essenzialmente di natura emorragica (6-30% di fenomeni emorragici). La trombolisi regionale, introdotta nel 1991, veniva, invece, eseguita, mimando la
tecnica della flebografia ascendente mediante puntura, in anestesia locale, di
una vena superficiale del dorso del piede con l’applicazione di un laccio emostatico al di sopra della caviglia per il passaggio dell’agente trombolitico
nel circolo venoso profondo. Attualmente la tecnica più utilizzata è la fibrinolisi in situ che si esegue in corso di esame flebografico. Con questa tecnica si raggiunge direttamente il trombo, riducendo le dosi di farmaco. Lo
svantaggio della metodica è quello di dover riposizionare più volte il catetere,
nel corso della procedura. La dose iniettata è, a seconda degli autori, di
100.000-250.000 U.I./h per un periodo di 24-36 h, con controlli flebografici
eseguiti ogni 8-12 h. La terapia andrà sospesa quando sarà dimostrata la
completa risoluzione della trombosi o la mancata progressione della trombolisi. Un’altra tecnica utilizzata è quella della fibrinolisi “pulsata” che consiste
nel somministrare piccole dosi di farmaco a pressione in modo da aumentare
la penetrazione nel trombo e ridurre i tempi d’azione.
Durante la terapia fibrinolitica andranno controllati i valori del fibrinogeno,
dei D-dimeri, la conta piastrinica ed il tempo di attivazione della trombina
ogni 6-8 ore. Dopo il trattamento fibrinolitico la terapia va continuata con la
somministrazione di anticoagulanti (prima eparina e poi anticoagulanti orali).
Il paziente andrà controllato nel tempo con esame ultrasonografico se la
trombosi non si estendeva oltre le vene iliache, mentre per la trombosi della
vena cava è preferibile utilizzare esami angio-TC o angio-RM.
La fibrinolisi va utilizzata sostanzialmente nelle trombosi venose insorte acutamente. Le indicazioni all’uso della fibrinolisi loco-regionale non sono
74
Capitolo 4
univoche. Secondo alcuni Autori bisogna utilizzare la fibrinolisi solo se la
trombosi è localizzata a livello dell’arto inferiore e se si estende al massimo
alle vene iliache. Essi, inoltre, ritengono che la fibrinolisi loco-regionale possa essere eseguita con successo entro un periodo compreso tra i 10 e i 28
giorni dall’inizio della sintomatologia clinica. Altri Autori, invece, sostengono che la terapia possa essere estesa a tutte le trombosi senza limiti di localizzazione e/o temporali. Altri ancora ritengono che non bisogna somministrare
il farmaco nelle TVP infragenicolate insorte da più di 10 giorni ed in quelle
recidive. Se le indicazioni non mettono d’accordo tutti, esiste, invece, maggiore consenso circa le controindicazioni. Le controindicazioni assolute sono
rappresentate dall’insufficienza renale, dall’ipertensione arteriosa, da un intervento chirurgico recente (meno di 4 giorni, comprese le biopsie), da un
trauma cranico, da un trauma maggiore, da un accidente cerebro-vascolare
insorto da meno di 6 mesi, da una retinopatia diabetica. Le controindicazioni
relative sono invece rappresentate dalla presenza di pericardite, dal trattamento con corticosteroidi, dalla gravidanza.
Trombectomia
Le indicazioni alla trombectomia in fase acuta si sono molto ridotte negli ultimi anni, soprattutto nel distretto popliteo-femorale, essenzialmente a causa
del miglioramento della tecnica di fibrinolisi. Oggi la trombectomia viene
riservata soprattutto alle condizioni di insuccesso della fibrinolisi. L’intervento chirurgico prevede la preparazione della vena a valle dell’ostruzione, una
venotomia e la compressione sulle masse muscolari dell’arto inferiore sia manuale che attraverso l’utilizzo di apposite bende elasto-compressive (benda di
Einsmarck) per ottenere l’espulsione dei trombi. Non bisogna, infatti, assolutamente eseguire manovre, quali ad esempio l’introduzione di un catetere di
Fogarty, che possano causare danni sia alle valvole che alle pareti venose. La
trombectomia è stata praticamente abbandonata visto la notevole probabilità di
una recidiva precoce di trombosi. La bassa velocità del flusso venoso e
l’impossibilità di eliminare i trombi all’interno dei rami muscolari rende questa
tecnica poco sicura ed espone il paziente ai rischi di un atto chirurgico.
Distretto iliaco-cavale
Vene iliache
Le lesioni ostruttive a livello delle vene iliache possono riconoscere una causa non compressiva, in genere per progressione della trombosi dal distretto
Trombosi venosa profonda
75
infrainguinale, oppure possono essere determinate da fenomeni compressivi
di natura sia neoplastica che non. La condizione si realizza più frequentemente a carico della vena iliaca sinistra a causa di una pinza osteo-vascolare rappresentata, anteriormente, dall’arteria iliaca Dx e posteriormente dai corpi
vertebrali L4-L5. La continua sollecitazione può portare ad una fibrosi sia
perivenosa che endoluminale. È stato, infatti, dimostrato che si formano delle
vere e proprie sinechie tra le pareti opposte della vena che possono determinare trombosi occludenti o non occludenti.
Le patologie neoplastiche che possono causare una trombosi iliaca sono ovviamente quelle a carico degli organi pelvici.
Infine si riconoscono anche altre cause quali linfoadenopatie o fibrosi retroperitoneali.
Diagnosi clinica
Il quadro clinico può variare, innanzi tutto, a seconda del tipo di trombosi che
si viene a determinare. Una trombosi non occludente, infatti, può decorrere
asintomatica. La presenza dei numerosi circoli collaterali che si instaurano tra
l’arto inferiore e le vene dell’addome fa sì che le trombosi non occludenti restino a volte misconosciute. La presenza di un arto edematoso anche se non
dolente, con circoli collaterali a livello pelvico ed addominale evidenti
all’ispezione, può far nascere il sospetto clinico di una trombosi del tratto iliaco. La maggior parte delle volte la diagnosi è casuale e viene fatta in corso
di esami eseguiti per altri motivi.
Una trombosi occludente che insorge in maniera acuta può dare, invece, una
sintomatologia che è sostanzialmente correlata all’estensione del trombo. Il
segno clinico principale è rappresentato dall’edema dell’arto inferiore e dal
dolore che presenta caratteristiche sovrapponibili a quanto detto a proposito
delle trombosi infrainguinali. Difficilmente una trombosi iliaca non si ripercuote sul deflusso venoso di tutto l’arto interessato e spesso si assiste alla
trombosi secondaria, più o meno estesa, delle vene dell’arto inferiore. L’interessamento acuto del distretto femoro-iliaco può causare una quadro clinico
grave che si potrà manifestare a livello dell’arto inferiore sotto forma di
phlegmasia alba dolens.
Vena cava inferiore
L’ostacolo al deflusso ematico a livello della vena cava inferiore può determinare, a seconda dell’estensione del trombo e delle modalità di insorgenza,
una sintomatologia che va dal semplice edema all’insufficienza renale ed all’ipertensione portale.
76
Capitolo 4
Le cause che portano all’ostruzione della vena cava inferiore possono essere
schematicamente divise in cause neoplastiche e cause non neoplastiche.
Tra le patologie neoplastiche, gli adenocarcinomi renali mostrano una notevole tendenza a proliferare nella vena renale e quindi nella vena cava, potendo dare origine a trombi che possono raggiungere l’atrio Dx.
I tumori ovarici, uterini e retroperitoneali determinano soprattutto fenomeni
compressivi a carico della vena cava inferiore, mentre i tumori epatici e pancreatici hanno una più spiccata malignità.
Il leiomiosarcoma è un tumore che prende origine dalla stessa vena cava, precisamente dalle fibrocellule muscolari lisce; la localizzazione a carico della
cava inferiore ha una maggiore frequenza rispetto all’interessamento della
vena cava superiore.
Tra le forme non neoplastiche, la trombosi venosa primitiva è sicuramente
quella più frequente e costituisce da sola il 70-75% di questo gruppo. Altre
cause sono le malformazioni congenite e le fibrosi retroperitoneali.
Le conseguenze di un’ostruzione della vena cava inferiore variano in base
all’estensione, al tempo di insorgenza ed alla natura del blocco.
La presenza di un ostacolo al flusso nella vena cava inferiore determina un aumento della pressione a monte del sistema, quindi a livello endo-addominale e
degli arti inferiori, mentre causa una caduta pressoria a livello dell’atrio di Dx.
È chiaro che quanto più la lesione è prossimale (e, quindi, più vicina all’atrio
Dx) e quanto più la sua insorgenza è stata rapida, tanto maggiore sarà la gravità
del quadro clinico a causa dello scarso sviluppo dei circoli collaterali.
In genere, se l’ostruzione si arresta al di sotto delle vene renali, si riesce a
creare un circolo di compenso attraverso rami venosi (vene lombari, vena
spermatica di Sn, vena ovarica, vena azygos ed emiazygos) che mettono in
comunicazione il sistema cavale inferiore con quello superiore; in questo caso il quadro clinico potrà essere meno severo; questa è la situazione più frequente.
La condizione più grave si realizza se l’ostruzione raggiunge le vene sovraepatiche, con sviluppo di una sindrome di Budd-Chiari; in questi casi, infatti,
oltre all’ostacolato deflusso dagli arti inferiori si crea un’ostruzione anche al
drenaggio del circolo celiaco-mesenterico.
Diagnosi clinica
Il paziente può essere quasi del tutto asintomatico oppure può presentarsi con
un quadro clinico quasi catastrofico. Ad esempio, una trombosi non occlusiva
della vena cava inferiore dovuta ad un trombo di origine neoplastica aggettante nel lume del vaso, viene diagnosticata in maniera casuale durante lo
studio della neoplasia.
Trombosi venosa profonda
77
Nei casi di trombosi occludente instauratasi in breve tempo il paziente potrà
riferire un notevole senso di pesantezza a carico degli arti inferiori, insorto
abbastanza rapidamente, che si associa a parestesie o veri e propri dolori,
fino a raggiungere l’impotenza funzionale, con lo sviluppo di una claudicatio venosa. Il paziente potrà anche riferire la comparsa di ematuria (che si
associa a proteinuria con oliguria, iperazotemia ed ipercreatininemia) nei
casi in cui siano interessate le vene renali. Se l’ostruzione è ancora più alta,
con interessamento delle vene sovraepatiche, si presenterà anche un quadro
di ascite associato allo sviluppo di varici esofagee, disprotidemia e fenomeni emorragici.
Obiettivamente si può riscontrare la presenza di un imponente edema degli arti
inferiori che si estende a livello del bacino e degli organi genitali (edema a pantalone) con notevole tensione della cute che appare pallida e che mantiene la
fovea. Il quadro più grave è quello della phlegmasia cerulea dolens. In questo
caso si ha una trombosi massiva del letto venoso con cianosi progressiva che
procede dalle parti declivi verso le regioni centrali del corpo. Tale quadro è legato allo sviluppo di una pressione interstiziale molto alta che tende ad equiparare la pressione del capillare arterioso annullando, in questo modo, il gradiente
pressorio che garantisce la progressione del flusso ematico. La notevole pressione che si sviluppa all’interno dell’arto determina, quindi, una condizione di
ischemia arteriosa con scomparsa dei polsi periferici. Si possono sviluppare
flittene emorragiche e l’arto può andare incontro ad un quadro di gangrena, in
genere umida, che mette in pericolo la vita del paziente, soprattutto per
l’insorgenza di uno stato di shock ipovolemico legato al sequestro ematico e
alla massiva perdita di liquidi nell’interstizio. Fortunatamente le condizioni di
ischemia venosa sono abbastanza rare (2-10%).
Nelle forme occlusive acute l’esordio del quadro clinico potrà essere un’embolia polmonare che potrà risultare fatale se l’embolo è di grosse dimensioni,
oppure potrà essere meno imponente e permettere di trattare il paziente in
modo da evitare altre possibili embolie.
Nelle forme di trombosi venosa profonda ad andamento cronico si può notare
lo sviluppo di circoli collaterali a livello dell’addome e del torace, mentre a
livello degli arti inferiori si possono formare varici, discromie cutanee, ulcere
venose.
Diagnosi strumentale
La diagnosi di trombosi del tratto iliaco-cavale viene fatta, a volte, in maniera casuale nel corso di indagini, per lo più ecotomografiche, volte a studiare una neoplasia od un’altra patologia addominale o pelvica. L’esame
ultrasonografico (in particolare l’eco-color-Doppler) rappresenta uno stru-
78
Capitolo 4
mento semplice per porre almeno il sospetto di un ostacolo al deflusso venoso, sospetto che autorizza l’esecuzione di indagini più approfondite quali
un esame TC o RM.
L’esame ultrasonografico fornisce, anche in questa sede, informazioni
circa la cosiddetta età del trombo (trombo fresco od inveterato) e
sull’entità dell’ostacolo (trombo occludente o non occludente). L’esame
risulta di grande utilità se ci sono masse ab estrinseco che comprimono
la vena. Bisogna comunque tener conto che, nell’esame di un vaso addominale, la diagnostica ultrasonografica può risultare particolarmente
indaginosa e necessita di un’adeguata preparazione del paziente (paziente a digiuno e con anse prive di aria, se possibile). Nonostante la
possibilità di utilizzare dei mezzi di contrasto per amplificare il segnale,
la metodica ultrasonografica a livello della vena cava inferiore trova notevoli limitazioni. Pertanto, quando l’esame ultrasonografico evidenzia
una trombosi che dai vasi di gamba prosegue nei vasi iliaci, è indicata
l’esecuzione di ulteriori esami diagnostici.
L’angio-TC spirale è in grado di fornire informazioni esaurienti e definitive
riguardanti sia il lume venoso, in particolare per ciò che concerne il trombo
endoluminale, che eventuali masse, neoplastiche o meno. È possibile, con un
solo esame, avere informazioni sia sugli organi e sulle strutture endocavitarie
eventualmente interessate da patologie espansive, che su problemi che riguardano l’anatomia ed il lume dei vasi.
L’angio RM è una metodica che si sovrappone alla TC, sia dal punto di
vista delle indicazioni che delle informazioni che riesce ad offrire. A seconda della tecnica usata il flusso ematico viene visualizzato in nero mentre le pareti vasali in bianco (spin-echo), oppure il flusso sarà bianco e le
pareti nere (gradient-echo; più usata). La presenza di un trombo non occludente di recente formazione verrà pertanto evidenziata come
un’immagine nera nel contesto del flusso venoso che occupa una vena dilatata i cui margini, a livello del trombo, appaiono sfumati per la presenza
di infiammazione perivasale. Quando il trombo inizia a retrarsi si potrà
notare la presenza di una piccola quantità di flusso (immagine bianca) attorno al trombo (immagine nera), mentre la trombosi cronica verrà riconosciuta per la presenza di un lume in cui è presente flusso, anche se non
occupa completamente il vaso (ci sono cioè segni di ricanalizzazione); la
vena potrà conservare un aspetto dilatato e saranno evidenti circoli collaterali di compenso.
Infine, bisogna ricordare anche l’esame flebografico il cui ruolo oggi
resta confinato a condizioni particolari, soprattutto terapeutiche, quali
l’istituzione di una terapia fibrinolitica oppure l’inserimento di un filtro
cavale.
Trombosi venosa profonda
79
Terapia
Anche la terapia dell’ostruzione venosa iliaco-cavale deve avere come obiettivi
l’eliminazione della causa, l’eliminazione dell’ostacolo, la ricostruzione di una
buona via di deflusso venoso, la prevenzione di fenomeni embolici polmonari.
Anche in questo caso è necessario distinguere le forme acute da quelle croniche
oltre che le trombosi occludenti da quelle non occludenti.
Nei casi insorti acutamente s’impone un approccio terapeutico il più tempestivo possibile. Le maggiori dimensioni dei vasi in questo distretto rispetto
a quello popliteo-femorale e, quindi, la possibilità che si abbiano dei
fenomeni embolici di maggiore gravità, un quadro clinico più severo, con
una maggiore possibilità di sviluppare una sindrome post-trombotica se non
viene rimosso il trombo, fanno assumere un atteggiamento più aggressivo,
soprattutto in caso di trombosi venosa profonda acuta di tipo occlusivo.
Pertanto, se da un lato è importante instaurare una terapia anticoagulante
per prevenire la formazione di nuovi trombi, dall’altro, soprattutto a livello
cavale, è importante ottenere in prima istanza la rimozione del trombo seguita dall’anticoagulazione orale che viene instaurata in modo del tutto analogo a quanto detto per la trombosi venosa profonda acuta del distretto popliteo-femorale. Anche in questo caso le scelte terapeutiche che si possono
adottare per ottenere la rimozione del trombo sono la trombolisi e la trombectomia chirurgica.
Per quanto riguarda la trombolisi nelle trombosi iliaco-cavali, la tecnica
d’esecuzione è quella in situ mediante puntura e cateterizzazione, sotto controllo flebografico, della vena femorale comune omolaterale o della vena femorale comune controlaterale. Alcuni Autori utilizzano un doppio accesso sia
dal basso, che dall’alto, mediante puntura della vena giugulare interna. La
modalità d’esecuzione, i dosaggi e la sorveglianza post-procedurale sono uguali a quanto detto in precedenza.
La chirurgia diretta può trovare indicazione in caso di fallimento della trombolisi. La rimozione di un trombo che occlude le vene iliache o la vena cava
può essere l’unico metodo per risolvere il quadro clinico.
Nella trombectomia iliaco-cavale si utilizza un catetere di Fogarty. La via
d’accesso sarà differente a seconda della localizzazione della trombosi. In
caso di interessamento dei soli vasi iliaci si accede con un’incisione all’inguine, a livello della vena femorale comune omolaterale. Se la trombosi è
soltanto a livello della vena iliaca comune si potrà anche adottare un accesso
extraperitoneale in modo da raggiungere la vena iliaca senza penetrare nella
sacca peritoneale. Se la trombosi è estesa anche a livello cavale, oltre
all’accesso omolaterale, si accederà anche dal lato controlaterale per l’introduzione di un catetere a palloncino da posizionare a monte del trombo e da
80
Capitolo 4
gonfiare prima di eseguire la trombectomia per controllare eventuali particelle emboliche.
In realtà per le trombosi del solo distretto iliaco non c’è accordo unanime circa la trombectomia chirurgica. Alcuni Autori, infatti, ritengono che sia ancora
sufficiente la sola terapia anticoagulante orale, senza riscontrare nelle loro
casistiche un aumento delle complicanze. Se la trombosi interessa la vena cava inferiore si accederà attraverso una laparotomia laterale destra (accesso
transperitoneale).
La valutazione dell’efficacia di queste tecniche non è molto semplice anche
perché vengono riportati spesso studi non randomizzati o studi che non analizzano le singole tecniche separatamente. La pervietà immediata varia dal
50% all’80% per quanto riguarda la fibrinolisi, mentre si attesta intorno
all’85% per la trombectomia chirurgica. Per quanto riguarda la pervietà a distanza, essa è più o meno sovrapponibile tra le due tecniche e si attesta intorno al 60% a due anni. È opportuno ricordare che, mentre fino a circa 20
anni fa la morbi-mortalità dopo trattamento fibrinolitico era abbastanza alta,
ora si attesta tra lo 0 e il 3%, a seconda delle casistiche. Più in particolare, le
complicanze più comuni in corso di trattamento fibrinolitco sono gli ematomi
in sede di puntura che richiedono un’evacuazione (2.5%), le emorragie nella
sede di puntura (1,3%), l’embolia polmonare (1,3%). Per quanto riguarda,
invece le complicanze della trombectomia è più difficile trovare dati che analizzino le singole complicanze. In letteratura viene posto l’accento sulla notevole riduzione della mortalità post-operatoria nell’ultimo ventennio, mortalità
che attualmente si attesta al di sotto dell’1%.
Trattamento endovascolare della TVP iliaco-cavale
L’introduzione ed il continuo sviluppo delle metodiche endovascolari nel panorama terapeutico della chirurgia vascolare ha permesso di estendere
l’impiego di questi presidi anche al trattamento delle lesioni steno-ostruttive
venose. In particolare l’angiopalstica e lo stent venoso sono impiegati soprattutto per le TVP che interessano i segmenti sovra-inguinali, quindi vene iliache e vena cava. Il rationale dell’utilizzo di questi presidi terapeutici risiede
nel fatto che il solo trattamento anticoagulante orale, nel distretto venoso sovra-inguinale, può causare una ricanalizzazione incompleta o una mancata
ricanalizzazione, nei casi di insuccesso. Si possono pertanto presentare pazienti affetti da SPT per la presenza di una stenosi iliaco-cavale residua. Sebbene non esistano ancora delle indicazioni assolute allo stenting venoso, le
principali condizioni anatomiche in cui tale metodica viene utilizzata sono
rappresentate da lesioni steno-ostruttive croniche del segmento venoso sovrainguinale sostenute da incompleta e/o mancata ricanalizzazione in seguito a
Trombosi venosa profonda
81
trattamento anticoagulante orale o da fenomeni compressivi da parte di masse
neoplastiche. Sebbene le forme stenotiche residue siano più frequenti (fino
all’80% dei casi secondo alcuni Autori) quelle da compressione non sono certamente rare.
Oltre che sul piano anatomico è possibile porre indicazione anche in base al
quadro clinico. In particolare lo sviluppo di una SPT sostenuta da una lesione
steno-ostruttiva interessante i segmenti venosi prossimali, con o senza reflusso, può rappresentare un’indicazione all’eliminazione della causa stenoostruente. Anche in caso di incontinenza delle vene perforanti di gamba, prima di ricorrere alla chirurgia di questo distretto è necessario risolvere prima
le lesioni prossimali se presenti. È stato, infatti, dimostrato che se non si risolve prima la lesione prossimale si verifica una recidiva ulcerosa dopo chirurgia delle perforanti nel 100% dei casi.
Sebbene l’indicazione principale alla terapia endovascolare sia rappresentata
dalla lesioni steno-ostruttive croniche, alcuni Autori utilizzano queste metodiche anche per le forme acute, dopo aver eseguito la fibrinolisi. Loro, infatti ritengono che lo stenting sia utile nella prevenzione delle restenosi sostenute sia
da fenomeni cicatriziali a carico della parete venosa, scatenati dalla reazione
infiammatoria che accompagna tutte le trombosi, sia da masse ab estrinseco per
le quali non è stato possibile attuare un trattamento di exeresi chirurgica.
Dal punto di vista tecnico la metodica si realizza mediante accesso venoso
femorale sia chirurgico che percutaneo. Previa eparinizzazione sistemica si
introduce, su di una guida rigida, per via anterograda prima il catetere con
palloncino (in genere da 8 mm) col quale si ottiene la dilatazione della lesione. Sebbene i risultati possano essere soddisfacenti dopo la semplice dilatazione, sono frequenti fenomeni di restenosi precoce a causa dell’elasticità
della parete venosa che risponde alla dilatazione con un restringimento (fenomeno denominato elastic recoil). Per questo molti Autori inseriscono sempre uno stent dopo la dilatazione. Dopo aver estratto il catetere con palloncino, lo stent viene introdotto con un apposito sistema di rilascio ed aperto a
livello della lesione precedentemente dilatata. In genere si utilizzano stent
autoespandibili di 12 mm. L’ulteriore dilatazione con pallone dello stent dipende dal risultato al controllo flebografico post-procedurale (Fig. 5). La
principale complicanza che si può verificare è l’insuccesso tecnico. Esso può
dipendere soprattutto dall’impossibilità a cateterizzare correttamente la vena
(circa il 10% dei casi) a causa di fenomeni cicatriziali che interessano il segmento venoso colpito dalla trombosi. Questo può causare un’effrazione della
parete venosa durante il passaggio della guida, oppure può creare una falsa
strada per cui la guida viene introdotta in un collaterale e non nel lume principale. In entrambi i casi non si riuscirà a dilatare la lesione né ad inserire uno
stent.
82
Capitolo 4
L’altra complicanza è rappresentata dalla trombosi precoce. In questo
caso bisogna ricorrere al trattamento fibrinolitico o alla trombectomia
chirurgica. È possibile, inoltre, che si verifichino embolizzazioni di materiale trombotico a livello polmonare mentre la dissecazione venosa è
molto improbabile data la differente struttura della parete venosa rispetto a quella arteriosa.
Nell’immediato post-operatorio si procede ad anticoagulazione, prima con eparina (a basso peso molecolare o eparina sodica a seconda delle preferenze),
poi con anticoagulanti orali.
La mobilizzazione deve essere precoce, ma preceduta dall’applicazione di un
bendaggio elasto-compressivo o di una calza elastica. La dimissione in genere avviene al raggiungimento dei valori terapeutici di anticoagulazione (2,5 <
INR < 3,5).
La terapia anticoagulante orale va proseguita per circa due mesi dalla dimissione ed i controlli possono essere effettuati con eco-color-Doppler dopo un
mese e con una angio-RM o angio-TC dopo 6 mesi.
I risultati sono soddisfacenti e la pervietà primaria ad 1 anno varia tra il 60%
e l’83%, mentre la pervietà secondaria è di circa il 93%.
Figura 5: Immagine intraprocedurale di trattamento endovascolare di una
trombosi della vena cava inferiore; A: dilatazione con palloncino; B: apertura
dello stent; C: controllo flebografico post-procedurale
Trombosi venosa profonda
83
Vena cava superiore
Le trombosi che interessano la vena cava superiore sono legate nella maggior
parte dei casi a processi di natura neoplastica, soprattutto a carico del polmone (70% dei casi). I numerosi rapporti anatomici che il vaso contrae a livello
del mediastino anteriore e la sua relativa scarsa mobilità spiegano come numerosi processi espansivi possano determinare fenomeni compressivi o interessare direttamente la parete del vaso. Va detto però che, attualmente, tra le
cause di trombosi della vena cava superiore vanno assumendo sempre maggiore rilevanza quelle iatrogene, dovute al posizionamento endoluminale di
cateteri quali quelli di Swan-Ganz, cateteri di derivazione peritoneo-giugulare, cateteri venosi centrali. Oltre alle neoplasie, altre cause che possono determinare un’ostruzione della vena cava superiore sono i processi espansivi di
natura benigna quali i gozzi immersi, le cisti mediastiniche, gli aneurismi
dell’aorta ascendente ed, infine, i tumori a partenza dalla parete cavale quali i
leiomiomi o i leiomiosarcomi. L’ostruzione della vena cava superiore causa
un brusco aumento della pressione venosa a monte dell’ostruzione ed una caduta della pressione a livello dell’atrio Dx. È chiaro che la gravità del processo trombotico è legata anche alla velocità d’insorgenza e da questo punto di
vista i processi espansivi che crescono più lentamente consentono la costituzione di un discreto compenso emodinamico. Altra valutazione importante da
fare, in funzione della prognosi, è quella relativa alla sede dell’ostruzione rispetto allo sbocco della vena azygos nella vena cava superiore. Se
l’ostruzione si ferma a monte dello sbocco della vena azygos (8-9% dei casi)
si crea un buon compenso emodinamico attraverso le vene intercostali,
mammarie e vertebrali. Se, invece, l’ostruzione si verifica a valle dello sbocco della vena azygos (18-19% dei casi) si può ugualmente creare un buon circolo di scarico attraverso l’inversione del flusso che dalle vene azygos rientra
nella cava inferiore attraverso la vene lombari, freniche, epigastriche e la vena renale di destra. Quando, invece, l’ostruzione coinvolge lo sbocco
dell’azygos nella cava superiore (72-73% dei casi) le possibilità di un compenso emodinamico sono molto scarse per cui si crea uno stato di notevole
ipertensione venosa nei distretti brachio-cefalici.
Diagnosi clinica e strumentale
In genere il quadro clinico diventa evidente solo in caso di ostruzione completa della cava superiore, mentre le trombosi non occludenti, di solito, non
sono clinicamente significative. Il quadro clinico che insorge in caso di ostruzione ha un andamento rapidamente ingravescente e appare importante sin
dall’esordio. Il paziente può riferire sintomi soggettivi quali acufeni, cefalea
84
Capitolo 4
gravativa, vertigini, notevole dispnea, sonnolenza anche diurna e ritardo psichico con scarsa reattività agli stimoli. Si possono presentare segni quali convulsioni, emorragie congiuntivali ed epistassi. Il paziente riferisce che trova
sollievo solo con il tronco in posizione eretta e così dorme con più cuscini o
in posizione seduta. Obiettivamente, si riscontrano il tipico edema a mantellina (edema di collo, spalle e terzo superiore del torace) e cianosi del volto e
degli arti superiori che aumenta, caratteristicamente, in posizione declive. Si
nota l’evidente turgore delle giugulari ed in generale delle vene superficiali
della parte superiore del tronco, con la possibilità di sviluppo di circoli collaterali a livello del torace e dell’addome che mettono in comunicazione la vena cava superiore con l’inferiore.
Anche se la diagnosi può essere fatta sulla base del quadro clinico, bisogna
completare le indagini diagnostiche con esami strumentali invasivi e non, per
poter precisare la sede e l’entità dell’ostruzione ma anche per poter studiare
l’eventuale processo espansivo che l’ha determinata. L’esame eco-colorDoppler può fornire ancora informazioni importanti circa la presenza di una
trombosi cavale, anche se si tratta di informazioni indirette. Infatti, data la
presenza delle strutture ossee e dell’aria contenuta nei polmoni, risulta quasi
impossibile visualizzare la vena cava superiore con tale metodica. Pertanto
l’esame viene condotto a livello delle vene succlavie (Fig. 6) dove si può notare il notevole rallentamento del flusso e la perdita della sua fasicità con
l’attività respiratoria.
Per una diagnosi diretta è necessario eseguire indagini angio-TC o angio-RM
che, oltre ad importanti informazioni riguardanti l’estensione del trombo e la
sua età, permettono di evidenziare anche eventuali formazioni che hanno causato la trombosi. Tuttavia, per la trombosi della vena cava superiore, l’esame
che permette la diagnosi di certezza è la flebografia. Questa va effettuata incannulando contemporaneamente le vene succlavie e iniettando nello stesso
momento il mezzo di contrasto.
Terapia
La terapia della trombosi della vena cava superiore ha subito notevoli sviluppi soprattutto nell’ultimo decennio. Mentre la terapia medica con anticoagulanti resta il presidio terapeutico più frequentemente utilizzato, la terapia fibrinolitica e la terapia endovascolare rappresentano le metodiche più innovative che stanno guadagnando spazio in quest’ambito.
Il tipo di terapia da utilizzare dipende anche dalla causa che ha determinato la
trombosi.
La terapia medica può essere utilizzata sia da sola che dopo trattamento fibrinolitico. In quest’ultimo caso trova indicazione soprattutto se la trombosi è asso-
Trombosi venosa profonda
85
ciata alla presenza di cateteri endovenosi quali quelli per la chemioterapia o per
la nutrizione parenterale o i pace-maker. La terapia anticoagulante può essere
intrapresa da sola soprattutto nelle forme di trombosi non associate ad una
compressione estrinseca. In caso di compressione estrinseca deve essere effettuato, ove possibile, un intervento di asportazione della massa comprimente.
Gli obiettivi della terapia anticoagulante sono quelli di prevenire dei nuovi fenomeni trombotici e, in definitiva, gli episodi di embolismo polmonare; non è
attiva, invece, sulla riduzione del trombo già formato. Pertanto l’efficacia della
terapia va valutata in termini di risoluzione e/o miglioramento della sintomatologia piuttosto che in termini di pervietà. È documentato che la terapia antiocoagulante determina un miglioramento della sintomatologia in più del 90% dei
pazienti nei primi mesi e non esistono differenze significative tra l’uso degli
anticoagulanti orali e l’uso delle eparine a basso peso molecolare.
Il vantaggio principale della terapia chirurgica è quello di asportare il trombo
dalla vena e di restituire la normale pervietà al vaso. La trombectomia trova,
attualmente, indicazione solo se la causa è rappresentata da un catetere venoso centrale, da un pace-maker o da un catetere per emodialisi. Infatti, in presenza di una massa che comprime la cava, si determina, in tempi anche rapidi, una lesione permanente dell’intima, che porta ad una nuova trombosi dopo la trombectomia.
Figura 6: Rappresentazione ecografia di una trombosi della vena succlavia
86
Capitolo 4
L’accesso chirurgico alla cava superiore prevede una sternotomia o più
raramente una toracotomia laterale Dx. In presenza di una massa che
comprime la vena cava superiore ma non la infiltra (ad esempio i gozzi
immersi oppure tumori mediastinici benigni), è sufficiente la resezione
della massa. Nei casi in cui persiste una stenosi della cava è possibile anche effettuare un rimodellamento mediante l’applicazione di un pacth di
allargamento della parete venosa; in genere si utilizza un pacth in pericardio bovino o in vena. Se, invece, è presente un’infiltrazione della parete
venosa, è indicata la resezione della massa e del tratto di cava infiltrato,
con conseguente confezionamento di un by-pass. In quest’ultimo caso il
PTFE è il materiale di scelta.
Oggi è possibile disporre di protesi tubulari di grande diametro anche armate.
Il primo tipo di protesi utilizzata è stata la vena autologa (in genere la vena
femorale comune), seguita dal Dacron. Gli studi effettuati hanno dimostrato
che il PTFE è il materiale che garantisce la pervietà più lunga per questo tipo
di chirurgia. In termini di pervietà questo tipo di by-pass garantisce una pervietà immediata superiore all’85% ed una pervietà a distanza di circa il 75%.
Tuttavia, per quest’ultimo punto, i dati sono fortemente influenzati dalla malattia neoplastica di base.
La terapia endovascolare sta sostituendo in maniera sempre più importante la
terapia chirurgica. Attualmente viene utilizzata nelle trombosi prossimali
(vena cava superiore o inferiore, ma anche vene iliache). Consiste nella dilatazione con palloncino della vena, seguita dall’inserimento di uno stent autoespandibile.
L’accesso può essere ottenuto dalla vena giugulare interna o dalla vena femorale comune. Questa tecnica trova indicazione nelle sindromi cavali correlate
a malattia neoplastica con invasione mediastinica che sono resistenti alla terapia medica e nelle quali non è possibile ricorrere all’exeresi chirurgica, nelle stenosi associate a fibrosi mediastinica, nelle stenosi della vena cava secondarie ad intervento chirurgico. Non mancano, tuttavia, casi in letteratura
in cui il trattamento endovascolare viene scelto come opzione primaria. In
questi casi si procede prima al trattamento fibrinolitico, seguito dall’immediato impianto dell’endoprotesi. Ad esempio, si ricorre allo stenting primario
della cava superiore nei casi di carcinoma polmonare. Questa neoplasia risponde abbastanza bene alla chemioterapia e alla radioterapia. Tuttavia un
effetto collaterale che si verifica quasi sempre è la fibrosi degli organi della
cavità toracica che può causare una stenosi della vena cava superiore. Il posizionamento di un stent può migliorare o anche risolvere il quadro clinico
(Fig. 7).
Nel caso in cui si decida di posizionare uno stent, è bene sempre conservare
lo sbocco della vena azygos, qualora, naturalmente, essa sia pervia. È oppor-
Trombosi venosa profonda
87
tuno ricordare che questo tipo di chirurgia data la maggiore fragilità delle pareti venose, richiede delle équipe esperte in questo campo.
Attualmente, nei centri che utilizzano questa metodica, il tasso di successo
tecnico va dal 90% al 100%; il tasso di pervietà primaria è di circa il 78%,
mentre il tasso di mortalità è di circa il 3% e quello di morbilità del 10%. In
letteratura viene, inoltre, descritto un tasso di recidiva a 12 mesi che varia tra
lo 0 ed il 45%; in questi casi è possibile trattare il paziente con l’inserimento
di un nuovo stent o con terapia medica.
Sindrome post-trombotica
Considerata fino a 15-20 anni fa una vera e propria piaga sociale, oggi la gravità clinica di quella che rappresenta la principale complicanza tardiva della
trombosi venosa profonda è stata notevolmente ridimensionata, grazie al miglioramento delle conoscenze circa le basi fisiopatologiche della sindrome e
al notevole miglioramento della terapia dopo l’introduzione dell’eparina e
della contenzione elastica a scopo profilattico.
Figura 7: Trattamento endovascolare di una stenosi della vena cava superiore
nel punto di sbocco del tronco braccio-cefalico di sinistra, con doppio accesso femorale ed omerale omolaterale. A: attraversamento della lesione con catetere; B: inserimento di stent e controllo flebografico
88
Capitolo 4
Affinché si possa parlare di sindrome post-trombotica (SPT) è necessario che
nella storia clinica del paziente sia presente una trombosi venosa profonda.
Quando invece non è possibile documentare né anamnesticamente né strumentalmente la presenza o gli esiti di TVP si preferisce parlare d’insufficienza venosa cronica senza specificarne l’etiologia. L’incidenza precisa
della malattia non è ben definita ed in letteratura si attesta intorno al 30% dei
pazienti che hanno avuto una TVP.
La base fisiopatologia della SPT riconosce due momenti principali: l’estensione del processo trombotico, cui fa seguito lo sviluppo dei circoli collaterali, ed il processo di ricanalizzazione del vaso.
Dopo la sua formazione, il trombo può andare incontro ad una crescita progressiva con coinvolgimento di distretti venosi contigui; questo porta ad un aumento consequenziale della pressione venosa. L’aumento pressorio sarà responsabile della deviazione del sangue verso i vasi non interessati dalla trombosi ed in
particolar modo verso il circolo superficiale, con inversione del normale flusso
venoso nel sistema delle perforanti. Il circolo collaterale che viene a formarsi
dipenderà dal livello della trombosi: se essa è localizzata a livello infra-popliteo
si svilupperanno, in tempi anche abbastanza rapidi, dei buoni circoli di compenso a livello di gamba; se è interessata tutta la vena femorale superficiale allora il sangue verrà deviato verso la vena grande safena; se l’ostruzione interessa anche la vena femorale comune il sangue verrà drenato verso i vasi epigastrici, mentre l’ostruzione della vena iliaca porterà allo sviluppo del circolo venoso emorroidario e genitale. Infine, in caso d’interessamento della vena cava
inferiore, si svilupperanno i circoli dell’addome e del torace, a seconda del livello della trombosi. L’ipertrofia e la visibilità di questi circoli superficiali che,
normalmente, non sono visibili è un chiaro segno di un ostacolo al normale deflusso venoso. L’inversione di flusso che porta allo sviluppo dei circoli collaterali è dovuta, da un lato, all’incremento pressorio all’interno del circolo profondo, dall’altro è correlata ai processi fisiopatologici che portano al rimodellamento del trombo ed alla ricanalizzazione del vaso. Quest’ultimo processo si
verifica in circa il 90% dei casi ed è dovuto a meccanismi di fagocitosi ed alla
fibrinolisi mediata dalla fibrinolisina plasmatica. Anche la pressione esercitata
dalla colonna ematica sulla superficie del trombo contribuisce al processo di
rimodellamento. Una ricanalizzazione completa porterà al ripristino di
un’accettabile funzionalità da parte del circolo venoso profondo, ma una ricanalizzazione parziale porta ad uno scompenso funzionale. Sebbene il processo
di ricanalizzazione comporti la distruzione delle valvole, si è visto che il compenso emodinamico viene in gran parte garantito da una corretta funzione della
pompa muscolare.
L’instaurarsi di un’insufficienza del circolo venoso profondo è in stretta relazione con la rapidità del processo di ricanalizzazione e con le recidive. Si è
Trombosi venosa profonda
89
visto, infatti, che una ricanalizzazione che avviene in tempi molto lunghi e la
presenza di recidive trombotiche correlano con una maggiore incidenza di
insufficienza del circolo venoso profondo. In particolare è stato osservato che
nei pazienti con trombosi recidivanti, la frequenza di sindrome post-trombotica è sei volte maggiore che in quelli senza recidive. Il periodo più importante per l’osservazione del paziente è il primo anno dall’evento trombotico. La
ricanalizzazione, completa o parziale che sia, si sviluppa nell’arco di 3-4 mesi
e comunque tutti gli eventi più importanti da un punto di vista della prognosi
avvengono nell’arco del primo anno.
La presenza di alcune condizioni quali l’obesità, l’ortostatismo prolungato,
gli sforzi, la tosse e gli starnuti, che si oppongono al ritorno del sangue venoso al cuore, possono causare la deviazione della corrente ematica verso il circolo superficiale che, già impegnato nel supplire il circolo profondo, tende a
diventare insufficiente ed a sviluppare varici secondarie (post-trombotiche).
D’altra parte, l’instaurarsi di una condizione di ipertensione venosa anche a
livello del circolo superficiale può determinare la comparsa di lipodermatosclerosi, di eczemi, di ulcere. Nel 1982 Browse e Burnard proposero che le
basi fisiopatologiche che portano ai segni obiettivi tipici della SPT, ed in particolare allo sviluppo dell’ulcera, fossero caratterizzate dalla formazione di
una cuffia di fibrina pericapillalre così come avevano osservato istologicamente. Suggerivano che l’aumento della pressione capillare, a seguito
dell’aumento della pressione venosa, determinava un maggior passaggio di
proteine plasmatiche, compreso il fibrinogeno, attraverso la parete venosa.
Inoltre, la determinazione della capacità fibrinolitica di questi pazienti dimostrava che essa era ridotta rispetto al normale e questo permetteva il persistere
della cuffia di fibrina. Secondo questa teoria la conseguente ipossigenazione
tissutale resta alla base dello sviluppo dell’ulcera. Tuttavia, questa teoria è
stata contestata da alcuni studi che hanno rilevato come la quantità di fibrina
presente in queste strutture non modifica eccessivamente la quantità di ossigeno ceduta alla cute. In realtà, in letteratura, vi sono pochi studi basati sulla
misurazione diretta dell’ossigenazione della cute eseguiti in pazienti con malattia venosa, soprattutto per difficoltà tecnologiche ed organizzative. Molti
più studi, invece, sono stati condotti sulla misurazione della pressione transcutanea dell’ossigeno; essi dimostrano un’effettiva riduzione dell’ossigeno a
livello della cute di questi pazienti. La teoria più recente propone che alla base delle alterazioni tissutali della malattia venosa vi sia un fenomeno di “intrappolamento” dei globuli bianchi al di fuori dei capillari con conseguente
occlusione di questi ultimi. I primi studi su questa teoria furono condotti da
Moyses e coll. nel 1987; a questi hanno fatto seguito tanti altri lavori.
Oltre al danno meccanico causato dall’intrappolamento delle cellule bianche, esisterebbe anche un danno causato dall’attivazione dei leucociti, con
90
Capitolo 4
conseguente liberazione di sostanze chemiotassiche, radicali superossido
ed enzimi proteolitici. In questo fenomeno sono interessati tutti i tipi di
leucociti.
Ad esempio, dai monociti si liberano alcune citochine (IL1 e TNFα) che possono determinare, tra l’altro, l’attivazione delle cellule endoteliali con conseguente passaggio di molecole di peso molecolare maggiore. Ancora, l’IL1
agisce sulle cellule endoteliali stimolando la produzione di inibitori della fibrinolisi quali l’inibitore dell’attivatore del plasminogeno (PAI); questo potrebbe spiegare, rispettivamente, il passaggio di macromolecole quali il fibrinogeno e la minore attività fibrinolitica che già venivano espressi nella teoria
della cuffia di fibrina. Inoltre, studi bioptici condotti su prelievi effettuati su
zone di lipodermatosclerosi hanno evidenziato la presenza di cellule macrofagiche e, in misura minore, di linfociti T, suggerendo quindi un substrato
fisiopatologico di tipo infiammatorio.
È stato inoltre osservato che l’IL1 determina la liberazione delle metalloproteasi da parte dei condrociti. Queste sono un gruppo di proteine enzimatiche alla base del sistema di regolazione del riassorbimento tissutale; determinano, infatti, il riassorbimento del collagene e del proteoglicano. Oltre alle
modificazioni emodinamiche a livello del circolo venoso, nella SPT si crea
anche un’insufficienza del sistema linfatico con frequenti episodi di linfangite
e linfadenite. A questi si aggiungo, infine, episodi di spasmo arterioso riflesso
e lo sviluppo di anastomosi artero-venose.
Diagnosi clinica
Il quadro clinico della SPT può essere caratterizzato da sintomi e segni diversi da paziente a paziente e può assumere forme anche gravi che costituiscono
fonte di invalidità importante.
Il paziente può riferire senso di pesantezza ed affaticamento che aumentano
con la stazione eretta prolungata, le stagioni e gli ambienti caldi ed il ciclo
mestruale.
Può essere presente dolore profondo di tipo urente durante la marcia (che
si sviluppa a causa dell’ipertensione venosa), che raggiunge il picco durante la fase di contrazione dei muscoli del polpaccio (claudicatio venosa). In seguito allo sviluppo delle ulcere si potranno avere fenomeni di
superinfezione batterica.
Dal punto di vista obiettivo il segno caratteristico è l’edema dell’arto inferiore che si può presentare di consistenza molle, oppure, quando è associato ad
interessamento dei vasi linfatici, di consistenza dura, con segni di ipodermite
e lipodermatosclerosi. Si noterà, in questo caso, la presenza di una cellulite
indurativa, con placche dure e scure che si formano soprattutto a livello peri-
Trombosi venosa profonda
91
malleolare dove i fenomeni di sclerosi possono portare alla formazione di anelli fibrosi che stringono la cute intorno all’osso.
Il segno clinico più grave riconducibile alle alterazioni fisiopatologiche
della SPT è rappresentato dall’ulcera flebostatica. Questa si presenta
con un aspetto rotondeggiante, margini rilevati e fondo grigiastro. Si
localizza, in genere, nella regione sopramalleolare mediale, ovvero nel
territorio delle perforanti di Cockett ormai completamente insufficienti.
La presenza dell’ulcera causa un dolore di tipo continuo che si esacerba
alla palpazione. L’ulcera può andare incontro a fenomeni d’infezione
sia batterica che micotica.
Dobbiamo ricordare, infine, la presenza di gozzi varicosi a livello dell’arto
inferiore; essi rappresentano la conseguenza ultima del sovraccarico funzionale del circolo venoso superficiale (varici secondarie).
Diagnosi strumentale
L’iter diagnostico nella SPT ricalca sostanzialmente quello per lo studio
dell’insufficienza venosa cronica, sia del circolo venoso profondo che del
circolo superficiale.
L’eco-color-Doppler rappresenta l’esame principe nella valutazione del reflusso quale indice d’insufficienza venosa. Sarebbe opportuno valutare, nel corso
dell’esame, anche la velocità e la durata del reflusso.
La pletismografia a luce riflessa viene usata per la misurazione delle pressioni venose a livello dell’arto inferiore. Durante la deambulazione, normalmente, la pressione nelle vene dorsali del piede cade a valori compresi tra 0 e
20 mmHg e, quando il paziente interrompe l’esercizio, sono necessari circa
20 sec. affinché essa torni ai valori di riposo.
Nei pazienti con insufficienza venosa cronica del circolo profondo si verifica una mancata riduzione dei valori pressori durante la deambulazione oppure un tempo di recupero dei valori di base molto breve o ancora, come in
genere si verifica, l’insieme dei due eventi. Studi condotti con metodiche
combinate (doppler, pressioni venose e flebografia) hanno dimostrato che
nei pazienti che presentano ulcerazioni perimalleolari esiste un’alterazione
delle valvole sia del circolo superficiale che delle perforanti. È stata, inoltre, dimostrata la presenza dell’incontinenza primitiva della valvola della
vena poplitea nella patogenesi del reflusso venoso e della sintomatologia
della SPT.
Ancora oggi alcuni ritengono opportuno eseguire una flebografia per la precisazione del livello anatomico del reflusso, per pianificare poi l’intervento chirurgico. Tuttavia, la notevole attendibilità di altri esami meno invasivi ha
quasi azzerato le indicazioni della flebografia.
92
Capitolo 4
Terapia
Terapia medica
Il trattamento medico della SPT è incentrato, da un lato, sull’elasto-compressione dell’arto inferiore e dall’altro sulla cura delle lesioni tipiche della
SPT, in particolare dell’ulcera venosa (Fig. 8).
Nel 1956 Anning ha riportato uno studio nel quale aveva ottenuto la guarigione
di 100 pazienti trattati con bendaggio elastico e successivamente con calze elastiche. La recidiva dopo 1-3 anni era stata pari al 59% e la maggior parte delle
recidive si era presentata nei pazienti che non avevano indossato le calze elastiche dopo la guarigione. Sebbene il meccanismo con il quale le calze elastiche
portano un beneficio clinico nelle trombosi cronicizzate del circolo venoso profondo non sia del tutto chiarito, si è visto empiricamente che l’utilizzo di questo
presidio terapeutico porta, nei malati con SPT, ad un miglioramento sia della
sintomatologia soggettiva che dei segni obiettivi. In genere vengono utilizzate
calze che esercitano una compressione alla caviglia compresa tra 18 e 40
mmHg. Il paziente dovrà indossare le calze elastiche durante le fasi attive della
giornata mentre potrà toglierle quando va a dormire. Se sono presenti lesioni
trofiche infette è indicata una terapia antibiotica sistemica, prima ad ampio
spettro e poi mirata sulla base dell’antibiogramma.
Negli ultimi anni si è posta una notevole attenzione sull’utilizzo di nuove terapie locali per l’ulcera venosa. Si tratta di medicazioni avanzate che si sono dimostrate in grado di accelerare la guarigione delle ulcere e di migliorare i risultati rispetto alla semplice detersione ed al bendaggio elasto-compressivo.
Figura 8: Ulcera cutanea da stasi venosa
Trombosi venosa profonda
93
Tabella 2: quadro riassuntivo delle principali medicazioni oggi utilizzate
Tipo di
medicazione
Aspetto del fondo della lesione
Nero
(necrotico)
Giallo Essudativo
(secco
(umido)
fibrinoso)
Schiume
++
Aspetto del tessuto
di granulazione
Rosso
Rosso
(infetto) (umido)
++
++
Idrofibre
+++
++
+++
Garze
NaCl
+++
+++
++
+
+++
+++
Alginati
Idrocolloidi
+
++
Idrogel
++
+++
++
+++
++
+
+++
+++
Pellicole
non adesive
Enzimi
+
++
+
Pellicole
adesive
Rosso
Rosso
(sanguinante) porpora
++
+++
+++
+
L’ulcera può presentarsi necrotica, fibrinosa, infetta, granuleggiante, in
fase di riepitelizzazione. Il requisito fondamentale per il trattamento topico dell’ulcera venosa è rappresentato dalla preparazione del letto della
lesione che consiste nella rimozione del tessuto necrotico e delle componenti essudative in modo da favorire lo sviluppo del tessuto di granulazione. Questo courettage ha lo scopo di pulire il fondo dell’ulcera e prepararla ad accogliere le medicazioni avanzate che hanno, invece, il compito di accelerare la guarigione.
I requisiti fondamentali di una buona medicazione dovrebbero essere:
non aderire al fondo dell’ulcera né lasciare residui, essere impermeabile
ai liquidi ma permettere gli scambi gassosi, creare una barriera contro
batteri e miceti, stimolare la crescita del tessuto di granulazione, avere
costi ragionevoli.
Il panorama delle medicazioni avanzate oggi è abbastanza vario (Tab. 2).
94
Capitolo 4
Una medicazione ideale, tuttavia, ancora non esiste né è possibile stilare un
protocollo uguale per tutti i tipi di ulcera. Notevole interesse ha suscitato negli ultimi anni l’uso del gel piastrinico. Il razionale del suo utilizzo si basa sul
fatto che le sostanze presenti all’interno del gel non fanno altro che amplificare i normali processi di guarigione di una ferita.
La riparazione dei tessuti è un processo dinamico costituito da tre momenti fondamentali: infiammazione, formazione del tessuto di granulazione, rimodellamento.
I protagonisti principali di questi tre eventi sono la matrice extracellulare, le
cellule del tessuto leso, i fattori di crescita. Un qualsiasi stimolo lesivo mette
in moto, normalmente, la proliferazione cellulare attraverso l’attivazione dei
fattori di crescita che, in questo contesto, sono mediatori essenziali e potenti
per spingere le cellule a replicarsi.
Negli ultimi anni sono apparsi sempre più definiti il ruolo e l’importanza
rivestiti dalle piastrine; in particolare si è osservata la capacità di questi
elementi corpuscolati del sangue di favorire l’induzione di uno stimolo
rigenerativo molto efficace. Le piastrine, infatti, possono essere paragonate a dei veri e propri laboratori-magazzini cellulari che elaborano, immagazzinano e quindi rilasciano, se attivate, numerosi fattori di crescita
(PDGF, TGF-β, EGF, IGF-I/II) capaci di stimolare la replicazione delle
cellule d’origine mesenchimale (come fibroblasti, osteoblasti e cellule
endoteliali) oltre che di esercitare una azione chemiotattica verso macrofagi, monociti e polomorfonucleati, svolgendo un ruolo centrale nel processo di riparazione delle ferite.
Da quest’osservazione è nata l’idea di ottenere, partendo dal sangue intero,
un iperconcentrato piastrinico i cui elementi costituenti conservassero tutte
le proprietà originarie delle piastrine e che, adeguatamente trattato, potesse
essere applicato direttamente sul tessuto leso per sfruttarne le potenzialità
rigenerative.
Significativi risultati sono stati ottenuti con l’applicazione “in situ” di
piastrine autologhe ed omologhe iperconcentrate e attivate in forma di
gel (gel piastrinico) mediante l’uso di calcio gluconato (o cloruro) e
Batroxobina (farmaco ad attività procoagulante simil-trombinica)
(Figg. 9, 10).
Il gel piastrinico, nella maggior parte dei casi, determina, inoltre, una notevole riduzione dell’entità del dolore, fino alla sua completa scomparsa in
alcuni casi.
Il gel piastrinico non va utilizzato nelle ulcere francamente infette; è necessario prima rendere sterile la lesione con un accurato courettage e con terapia
antibiotica mirata per via sistemica (la terapia antibiotica locale può determinare dermatiti da contatto).
Trombosi venosa profonda
95
Figura 9: in alto a destra: sacche contenenti derivato del plasma da attivare
con trombina e Ca2+ per ottenere la gelificazione; in alto a sinistra ed in basso: attivazione del gel piastrinico con Batroxobina e calcio gluconato
A
B
Figura 10: A: Ulcera flebostatica al III distale della gamba DX. B: applicazione
di gel piastrinico
96
Capitolo 4
Terapia chirurgica
Il panorama delle tecniche chirurgiche che possono essere utilizzate per la correzione del reflusso venoso alla base della sindrome post-trombotica è molto
vasto e complesso. Le cause che portano alla trombosi venosa profonda possono essere, infatti, di diverso tipo e localizzate a vari livelli; per questo motivo a
volte si è obbligati a risolvere solo una parte delle turbe emodinamiche con interventi limitati. Inoltre, non è sempre semplice distinguere, soprattutto nei casi
inveterati, se la sindrome è causata dall’insufficienza del circolo superficiale,
del circolo profondo o di entrambi. Il punto fondamentale, pertanto, resta se e
quando ricorrere alla terapia chirurgica. La maggior parte degli Autori ritiene
che si debba procedere solo se i trattamenti medici, il cui cardine resta la contenzione elastica, hanno fallito. Si ritiene, infatti, che l’indicazione al trattamento chirurgico vada posta, non tanto sulla base del quadro emodinamico e quindi
strumentale, quanto sulla gravità del quadro clinico.
Possiamo dire che esistono due grandi tipi di interventi: quelli che trovano indicazione nei casi di ostruzione del vaso venoso (esecuzione di by-pass, sostituzione del vaso) e quelli che trovano indicazione nei casi in cui prevale
l’incontinenza valvolare (ricostruzione delle valvole, legatura delle perforanti).
I by-pass più eseguiti sono il by-pass safeno-femorale ed il by-pass femorofemorale cross-over. Il primo è stato introdotto da May-Husni e consiste nella
connessione tra la vena safena, pervia, ed il circolo venoso profondo omolaterale (distretto popliteo-femorale). Le indicazioni a tale tipo di intervento sono
abbastanza limitate; è necessario, infatti, che il processo trombotico sia limitato alle sole vene femorale superficiale o poplitea. La vena safena, ma anche
le vene tibiali e quelle pelviche devono, invece, essere indenni da processi
trombotici. I risultati non sono molto soddisfacenti. Gruss ha presentato un
lavoro nel quale dimostrava il miglioramento del quadro clinico in 5 pazienti
su 12, ma nel corso del follow-up si è verificata la chiusura del by-pass in
quasi tutti i pazienti. Il by-pass femoro-femorale cross-over è gravato da un
minor tasso di complicanze rispetto al precedente ed è tecnicamente più semplice. Consiste nella connessione tra due vene femorali comuni utilizzando la
vena safena come condotto soprapubico. Trova indicazione in caso
d’ostruzione unilaterale limitata ad un vaso a valle delle vene femorali (come
ad esempio della vena iliaca esterna) con sintomatologia clinica caratterizzata
da claudicatio venosa senza lesioni trofiche gravi. Hallidau ha dimostrato, in
una casistica personale di 32 pazienti, una pervietà a 5 anni pari al 75%, con
un successo clinico del 89%. Questo intervento ha subito delle modifiche nel
tempo, la più consistente delle quali è rappresentata dalla scelta del materiale
protesico: non più la safena, che risulta troppo poco resistente ai fenomeni
compressivi cui può andare incontro nel percorso soprapubico, ma una prote-
Trombosi venosa profonda
97
si in PTFE armata, ovvero provvista di un rinforzo esterno che riveste la protesi con un andamento spiraliforme.
Nei pazienti con gravi disturbi, come ulcere ed induratio della gamba, nei
quali la valutazione emodinamica mostra la presenza d’incontinenza valvolare del circolo venoso profondo, possono essere messi in atto interventi di valvuloplastica, di trasposizione o di autotrapianto.
La valvuloplastica, introdotta da Kistner, è stato uno dei primi interventi eseguiti per la riparazione di un reflusso venoso alla base della SPT. Può essere
eseguito dall’interno della vena, dopo una flebotomia, oppure dall’esterno del
vaso. In quest’ultimo caso è di più facile esecuzione e meno rischioso dal
punto di vista trombotico. Trova indicazione nei pazienti con gravi disturbi
trofici della cute (ulcere resistenti alla terapia conservativa), con elevati valori
pressori ma con pervietà del circolo profondo.
Gli interventi di trasposizione consistono nel portare un segmento venoso incontinente su di un altro con valvole continenti. Per esempio si può trasporre
la vena femorale superficiale incontinente sulla vena femorale profonda o
sulla safena che sono continenti. Ancora, si eseguono interventi di trapianto
venoso, ovvero si interpone un segmento venoso provvisto almeno di due
valvole continenti a livello del circolo venoso profondo incontinente. Generalmente per questo tipo d’intervento il segmento venoso continente da trapiantare viene prelevato dal distretto axillo-omerale.
Si è visto che, tra questi tipi d’intervento, quello a rischio maggiore di trombosi post-operatoria è la valvuloplastica, seguita dalle trasposizioni, mentre i
trapianti hanno il rischio più basso.
La scelta del tipo d’intervento, secondo quanto si evince dalla letteratura, non dipende tanto dal diverso rischio trombotico, quanto dall’esperienza personale. Nonostante lo studio di questa malattia vada avanti da molti anni ed i miglioramenti nelle
tecniche terapeutiche siano stati notevoli, i successi tecnici restano limitati e va posta ancora l’attenzione sulla terapia medica e soprattutto sull’elastocompressione.
Chirurgia delle perforanti
Le vene perforanti sono spesso interessate nella patogenesi della sindrome
post-trombotica determinando un reflusso verso il circolo venoso superficiale
che è responsabile delle lesioni trofiche tipiche di questa patologia. La legatura delle vene perforanti va eseguita in casi molti selezionati e prevede
l’individuazione delle perforanti incontinenti. Grazie al miglioramento delle
tecniche eco-color-Doppler oggi è possibile “mappare” le perforanti incontinenti in maniera non invasiva. Nella stragrande maggioranza dei casi sono le
vene di Cockett ad essere insufficienti. L’intervento può essere eseguito sia
con tecnica chirurgica classica che per via endoscopica.
98
Capitolo 4
Mentre alcuni Autori preferiscono eseguire la legatura delle perforanti solo
dopo la guarigione delle ulcere ed adottando la tecnica chirurgica classica,
altri preferiscono avvalersi della tecnica endoscopica anche in presenza di
ulcera, a patto però che quest’ultima non sia infetta ed appaia granuleggiante.
La tecnica classica prevede un’incisione sulla faccia mediale della gamba ed
aggressione delle vene perforanti nel tratto sottofasciale (sec. Linton). Nei
casi meno gravi le vene possono essere aggredite anche nel tratto soprafasciale (sec. Cockett). Felder e Dodd hanno proposto un’incisione cutanea rispettivamente sulla faccia posteriore e postero-mediale di gamba in modo da evitare la ferita chirurgica sulla faccia mediale (che in genere è quella interessata
dalle turbe trofiche tipiche della SPT). L’intervento consiste nella preparazione della vena che viene sezionata tra legature.
La tecnica endoscopica (SEPS: chirurgia endoscopica sottofasciale delle perforanti) si avvale dell’uso di strumenti che permettono piccoli accessi situati
lontano dalle ulcere attive o dall’area di discromia cutanea.
Bisogna disporre di un sistema principale dotato di un palloncino (spacemaker), che viene utilizzato per separare il muscolo dalla fascia, e di un trocar di servizio. La fibra ottica viene inserita nel sistema principale, mentre la
pinza per l’eventuale dissezione e la clippattrice vengono inserite nel trocar di
servizio (Fig. 11). È necessario, inoltre, disporre di un sistema video e di un
insufflatore di anidride carbonica. Dopo aver inciso la cute sulla faccia mediale della gamba, tre dita trasverse inferiormente al margine inferiore del
condilo mediale della tibia, si prepara accuratamente la fascia.
Dopo aver inciso la fascia in senso trasversale, il sistema principale viene letteralmente avvitato ad essa. Il trocar di servizio, nel quale viene inserita
Figura 11: SEPS, introduzione di spacemaker e chiusura di una vena con clip
metalliche
Trombosi venosa profonda
99
l’ottica, si introduce per via percutanea a livello del versante mediale del polpaccio, 5 cm inferiormente al sistema principale. Si effettua una dissezione
gonfiando il palloncino per ampliare lo spazio sottofasciale. Viene insufflata
anidride carbonica attraverso un cavo collegato al sistema principale. Se
quest’ultimo non è saldamente ancorato alla fascia, l’anidride carbonica può
fuoriuscire rischiando di compromettere la riuscita dell’intervento. Tutte le
perforanti individuate vengono sezionate tra clip introdotte attraverso il secondo trocar. Alla fine della procedura è bene tenere l’arto sollevato di circa
30° per circa 3 ore. Il principale vantaggio della SEPS rispetto alle tecniche
chirurgiche tradizionali è la minore incidenza di complicanze delle ferite. In
letteratura sono stati riportati risultati incoraggianti, con guarigione accelerata
delle ulcere.
Le controindicazioni della SEPS sono l’obesità, le estese alterazioni cutanee,
una TVP recente e l’occlusione della vena poplitea.
100
Capitolo 4
5. Embolia polmonare
L’embolia polmonare è un evento patologico acuto causato dall’ostruzione
dell’albero arterioso polmonare da parte di trombi migrati dal sistema venoso (Fig.
1). Essa è caratterizzata da quadri clinici differenti legati all’entità dell’ostruzione. Il
quadro clinico può essere caratterizzato dalla riduzione della gittata cardiaca, da
vasospasmo polmonare, da ipertensione arteriosa, dalla compromissione
dell’ossigenazione ematica e dal bronco-spasmo. Soggetti normali possono tollerare
un’ostruzione del 60-70% dei vasi polmonari ma pazienti con preesistenti patologie
cardiache o polmonari tollerano male occlusioni anche molto più contenute.
L’embolia polmonare rappresenta una tra le più frequenti cause di morbimortalità ospedaliera nonostante il miglioramento delle conoscenze circa la
sua patogenesi, della diagnosi e del trattamento. L’incidenza stimata negli
USA è di circa 630.000 casi/anno. L’embolia polmonare spesso complica un
intervento chirurgico, tuttavia può manifestarsi anche in corso d’insufficienza
cardiaca congestizia, malattie polmonari croniche, neoplasie.
L’embolia polmonare massiva è spesso improvvisa, nonostante venga preceduta da fenomeni di microembolizzazione che restano, però, silenti. Il 90%
dei decessi si verifica entro 2 ore dall’insorgenza dei primi sintomi. A causa
dell’alta incidenza e della diagnosi spesso difficile, l’embolia polmonare è
una malattia insidiosa che in molti pazienti rappresenta la causa principale di
morte (5-10% di tutti i decessi ospedalieri).
Figura 1: Ostruzione embolica di rami dell’arteria polmonare di Sn
101
102
Capitolo 5
Etiopatogenesi
Nel 90% dei casi di embolia polmonare si associa una forma clinica di trombosi venosa. I fattori predisponenti dell’embolia polmonare sono: una pregressa TVP, l’immobilizzazione per un periodo superiore ai 3 giorni, il sesso
(donne > uomini), gli interventi chirurgici (ortopedici, oncologici addominali,
neurochirurgici), la grave obesità, la malattia neoplastica, lo scompenso cardiaco, i traumi a carico degli arti inferiori, l’ictus, la trombofilia (deficit o resistenza alle proteine C e/o S, deficit antitrombina III, anticorpi anticardiolipina, iperomocisteinemia).
L’arteria polmonare destra è più frequentemente coinvolta della sinistra così
come i lobi polmonari inferiori sono interessati più dei superiori. Gli emboli
fatali hanno spesso diametro maggiore di 1 cm, possono essere lunghi fino a
50 cm e originano generalmente dal distretto venoso degli arti inferiori e dal
plesso pelvico.
Quadro clinico
La diagnosi di embolia polmonare è resa difficoltosa dall’aspecificità dei sintomi e segni cardio-respiratori. I sintomi e segni dell’embolia polmonare sono estremamente variabili, in rapporto al numero e al volume degli emboli;
questi ultimi possono interessare il tronco dell’arteria polmonare (emboli
massivi) e determinare una grave insufficienza cardio-respiratoria con morte
improvvisa, oppure possono interessare le diramazioni dell’arteria polmonare
causando un quadro clinico che può essere del tutto silente oppure si può caratterizzare per importanti conseguenze se le condizioni ventilatorie del paziente sono già compromesse.
I segni classici sono l’emottisi, lo sfregamento pleurico, il respiro affannato,
la cianosi, il ritmo di galoppo, mentre reperti aspecifici sono tachicardia, tachipnea, dispnea, broncospasmo e dolore toracico pleurico. All’esame obiettivo del torace, l’infarto polmonare si manifesta come una zona di ipofonesi
con riduzione del murmure vescicolare, si apprezzano inoltre ronchi crepitanti e soffio bronchiale.
L’embolia polmonare può essere distinta in varie forme.
L’embolia polmonare acuta massiva è caratterizzata dall’occlusione improvvisa di almeno il 50% di una o di entrambe le arterie polmonari, con conseguenti disturbi gravi dell’emodinamica polmonare e delle funzioni ventilatorie. I pazienti possono presentare grave dispnea acuta, shock e morte improvvisa. Il 10% dei decessi si verifica nella prima ora, molti pazienti non riescono a raggiungere l’ospedale.
Embolia polmonare
103
Il dolore toracico può essere un elemento diagnostico. Il paziente presenta
grave difficoltà respiratoria, cianosi, ipotensione arteriosa o shock circolatorio. L’aumento della pressione venosa centrale indica uno scompenso cardiaco Dx. All’esame obiettivo del cuore si può riscontrare lo sdoppiamento del
secondo tono con predominanza della componente polmonare.
L’embolia polmonare acuta submassiva si caratterizza per un quadro clinico
stabile con funzionalità respiratoria ridotta e dispnea non ingravescente che in
genere non si associa ad un cuore polmonare acuto.
L’embolia polmonare acuta non massiva si caratterizza per sintomi dovuti ad
ischemia o infarto di un piccolo segmento polmonare. In un soggetto sano, le
piccole embolie polmonari che interessano meno del 50% della circolazione
sono spesso asintomatiche.
Reperti clinici caratteristici sono il dolore toracico di tipo pleurico, secondario ad irritazione della pleura, l’emottisi e la dispnea. L’iperpiressia è un rilievo comune e può portare ad un’errata diagnosi di polmonite. Il paziente è
spesso tachipnoico, con respiro superficiale, secondario al dolore pleurico.
L’ipossia è solitamente assente perché lo scambio gassoso è solo lievemente
compromesso. L’ipocapnia è frequente, data la cospicua eliminazione di anidride carbonica indotta dalla tachipnea e dall’iperventilazione. Occasionalmente sono presenti sfregamento pleurico, versamento pleurico o addensamento polmonare.
L’ipertensione polmonare da tromboembolia cronica è correlata a ripetute
embolie polmonari silenti o all’inadeguata rimozione di un precedente embolo polmonare. L’ostruzione del letto arterioso polmonare causa un aumento
delle resistenze arteriolari polmonari ed un sovraccarico cronico del ventricolo Dx. I pazienti presentano un progressivo aumento della dispnea ed una ridotta tolleranza allo sforzo. Possono essere presenti segni di ipertrofia delle
cavità cardiache Dx, come l’ingombro parasternale all’Rx ed il rigurgito tricuspidale all’ecocardiogramma. L’Rx del torace può rilevare una dilatazione
delle arterie polmonari e del cuore Dx. L’ipertrofia ed il sovraccarico del ventricolo Dx possono essere identificati anche con un ECG.
Diagnosi strumentale
I dati clinici o di laboratorio non consentono di porre diagnosi certa di embolia polmonare. Tuttavia, in caso di sospetto, va sicuramente eseguita
un’emogasanalisi che fornisce dati certi sulla funzionalità respiratoria.
Tra gli esami ematochimici è fondamentale anche il dosaggio del D-dimero.
L’embolia polmonare è generalmente associata ad ipossiemia (moderata), ma
una normale pressione parziale di ossigeno è presente fino al 25% dei pazien-
104
Capitolo 5
ti con un’embolia polmonare accertata; nella maggior parte dei casi il livello
arterioso di anidride carbonica è basso a causa dell’iperventilazione; i pazienti con embolia polmonare minore più difficilmente hanno una pressione parziale arteriosa di ossigeno anomala rispetto ai pazienti con un’embolia polmonare massiva, ma ciò dipende in parte anche dalla presenza di precedenti
malattie cardio-respiratorie.
Le modificazioni dell’ECG sono in rapporto all’entità dell’embolia polmonare: sono presenti nell’80% dei casi di embolia polmonare massiva e sono rappresentate soprattutto dalla comparsa di aritmie, dalla variazione dell’onda T
o dell’asse QRS (spostamento a destra, blocco di branca destra).
Più importante dell’ECG è l’ecocardiogramma che potrà evidenziare una dilatazione del ventricolo e dell’atrio destri, un’ipocinesia ventricolare destra,
un rigurgito tricuspido-mitralico o una dilatazione dell’arteria polmonare.
La radiografia del torace può risultare spesso alterata, anche se in maniera aspecifica, con segni di versamento pleurico (impegno dello spazio costo-frenico), sollevamento dell’emidiaframma, atelettasie, alterazioni delle dimensioni cardiache.
Un’indagine diagnostica più accurata è la scintigrafia polmonare perfusionale, in grado di identificare una zona di alterata perfusione polmonare in modo
sensibile ma aspecifico. Infatti, un deficit localizzato di perfusione polmonare, indicativo di ostruzione vascolare, può essere riscontrato anche in caso di
atelettasia, cisti, bolle enfisematose, broncopneumopatia acuta e cronica,
neoplasie. È possibile utilizzare anche la scintigrafia polmonare ventilatoria,
per evidenziare anche la funzione ventilatoria settoriale del polmone attraverso l’impiego di gas marcati con particelle radioattive.
In passato per una diagnosi certa di embolia polmonare veniva eseguita
l’angiografia polmonare indicata nei casi con quadro clinico significativo e
scintigrafia ventilatoria-perfusionale negativa. Attualmente tale metodica è
stata quasi del tutto soppiantata dall’angio-TC, indagine meno invasiva e con
una sensibilità molto elevata, in grado di confermare la presenza di emboli
anche nelle diramazioni distali dell’albero vascolare polmonare.
Terapia
Il trattamento varia in base alla gravità, alla durata ed alla forma clinica
dell’embolia polmonare.
In caso di embolia polmonare acuta massiva, si deve provvedere all’immediata rianimazione del paziente aumentando la pressione sistemica e migliorando la saturazione d’ossigeno. Una volta accertata la diagnosi si può iniziare il trattamento che può essere convenzionale, con eparina, o aggressivo con
trombolisi o embolectomia.
Embolia polmonare
105
Il trattamento trombolitico è riservato ai pazienti con grave insufficienza cardio-respiratoria, ipotensione, oliguria o ipossiemia. Lo scopo è la dissoluzione attiva del trombo, riducendo così le resistenze polmonari e migliorando la
circolazione polmonare. La lisi può interessare anche la fonte originaria del
trombo, in modo da prevenire altre embolie. La somministrazione può avvenire per via endovenosa sistemica, ma è più logico l’uso della trombolisi loco-regionale in pazienti sottoposti ad angiografia polmonare.
L’embolectomia è indicata nel caso di controindicazione alla trombolisi o,
più spesso, nel caso in cui quest’ultima sia stata inefficace. Essa può essere
eseguita sia per via chirurgica tradizionale, mediante sternotomia, sia per via
percutanea usando i dispositivi per l’embolectomia arteriosa. Talvolta può
essere associata alla trombolisi. L’embolectomia chirurgica, benché efficace,
è associata ad un elevato tasso di mortalità immediata (30-50%) ma, nei pazienti che superano l’intervento, la sopravvivenza ad 8 anni risulta pari al
70% circa.
In caso di embolia polmonare acuta submassiva spesso i pazienti sono emodinamicamente stabili, ma mostrano ugualmente, all’ecocardiogramma,
importanti disfunzioni del ventricolo Dx. L’insufficienza ventricolare Dx
ha prognosi sfavorevole e ciò ha sollevato dubbi sull’uso di una terapia più
aggressiva per l’aumento delle complicanze ad essa legate. Sono in atto ulteriori ricerche a proposito, intanto si procede così come visto nelle forme
massive.
Nell’embolia polmonare acuta non massiva, al primo sospetto bisogna iniziare la terapia eparinica sistemica in attesa della conferma diagnostica, dopo la
quale si inizia la terapia anticogulante orale e, raggiunto il range terapeutico
ottimale, si sospende l’eparina sodica. La fase acuta, si affronta con
l’infusione continua di eparina sodica alla dose di circa 1.000-1.500 U.I./h
dopo un bolo iniziale di 5.000 U.I.
La prognosi dell’EP dipende soprattutto dalle affezioni preesesistenti o concomitanti, dalla rapidità con cui viene instaurata una corretta terapia farmacologica e da un’adeguata prevenzione della TVP. Quest’ultima attualmente si
basa sulla somministrazione di anticoagulanti orali nei pazienti con TVP. Bisogna ricordare che non v’è un accordo unanime sul tipo di trattamento medico da adottare nella prevenzione della TVP. In particolare, l’avvento delle
eparine a basso peso molecolare (LMWH) ha creato una specie di dicotomia
circa la migliore scelta terapeutica. Infatti, mentre alcuni Autori sono convinti
della necessità di usare la warfarina, altri hanno riscontato un maggior rischio
di episodi embolici in corso di trattamento con anticoagulanti orali (17%) rispetto alle eparine a basso peso molecolare (9%). Pertanto non esiste una linea guida rispettata da tutti, ma il concetto fondamentale è che il paziente deve, comunque, essere sottoposto ad anticoagulazione.
106
Capitolo 5
Embolia polmonare e gravidanza
La tromboembolia venosa, sebbene rara, è una delle cause maggiori di mortalità materna. Anche se il rischio maggiore si ha durante il post-partum, non è
raro che l’embolia polmonare si presenti nell’ultima fase della gravidanza. Il
parto cesareo è associato ad un rischio più alto rispetto al parto naturale. La
diagnosi può essere difficoltosa per il timore di esporre il feto a radiazioni. La
prima scelta nella diagnostica non invasiva rimane comunque l’eco-colorDoppler. L’esame iniziale dovrebbe essere l’eco-color-Doppler delle vene
degli arti inferiori seguito, in caso di risultato normale, dalla scintigrafia polmonare perfusionale. Se quest’ultima è normale, si può evitare la terapia anticoagulante. Se la scintigrafia polmonare non dovesse essere diagnostica, è
necessrio eseguire un’angiografia polmonare o un’angio-TC.
La warfarina non va usata in gravidanza a causa del suo effetto teratogeno sul
feto. L’effetto è particolarmente grave nel primo trimestre, nelle fasi più avanzate può causare anomalie del sistema nervoso centrale. Il trattamento di
scelta è dato dalle eparine non frazionate e dalle eparine a basso peso molecolare. Sono stati usati anche filtri cavali con buoni risultati. Nel post-partum, il
trattamento è simile a quello delle pazienti non gravide in quanto la warfarina
non è escreta in quantità significative nel latte materno.
Embolia polmonare e neoplasie
Il tromboembolismo venoso può rappresentare sia la prima manifestazione di
una neoplasia occulta sia la complicanza di una neoplasia già diagnosticata.
Nelle trombosi venose in corso di neoplasia già diagnosticata devono essere
incluse le trombosi venose post-chirurgiche, le trombosi venose indotte dalla
chemioterapia e le trombosi venose che complicano il posizionamento di un
catetere venoso a permanenza.
La riduzione del rischio trombotico esige misure di profilassi, quali la somministrazione di eparina non frazionata, eparine a basso peso molecolare o
l’adozione di mezzi fisici di prevenzione nei pazienti neoplastici allettati o
sottoposti a procedure chirurgiche. Più complesso è il problema della profilassi a lungo termine nei pazienti neoplastici sottoposti a chemioterapia.
Studi randomizzati controllati hanno dimostrato la riduzione della prevalenza
di trombosi venose conseguenti al posizionamento di un catetere venoso a
permanenza con 1 mg/die di warfarina.
Embolia polmonare
107
Filtri cavali
Si tratta di sistemi impiantabili all’interno della vena cava inferiore che hanno
lo scopo di catturare il materiale embolico proveniente dal circolo venoso degli arti inferiori, impedendone la migrazione verso il circolo polmonare.
La fabbricazione di quasi tutti i filtri cavali tiene conto del fatto che la probabilità di incontrare la traiettoria di un embolo è maggiore al centro del lume
del vaso, dove il flusso è maggiore, rispetto alle zone periferiche dove il flusso è ridotto. Pertanto la porzione del filtro situata al centro del vaso presenta
maglie ristrette, mentre la parte periferica è dotata di maglie più ampie.
I filtri (Fig. 2) sono costituiti da fili metallici che possono essere o meno riuniti al vertice; nel primo caso la loro forma ricorda la superficie di un cono.
Una volta che l’embolo è intrappolato nel vertice del filtro, esso va incontro a
lisi spontanea oppure viene sminuzzato nella struttura filtrante grazie alla
compressione esercitata dal flusso di sangue in senso centripeto. Si formano
piccoli frammenti embolici che non causano problemi clinicamente evidenti
al circolo polmonare. Anche se l’80% del volume del cono filtrante è occupato da materiale embolico, la vena cava inferiore rimane pervia per il 50%, evitando così il rischio di una grave trombosi.
Un filtro, per un corretto funzionamento, deve essere posizionato in modo
tale da far coincidere il suo vertice con l’asse maggiore del vaso, con un errore consentito di 15 gradi.
A
B
C
D
Figura 2: A): Filtro a nido d’uccello, B): Filtro di Greenfield, C): Filtro di Prothia,
D): Tempofilter
108
Capitolo 5
Le caratteristiche principali dei filtri cavali sono la capacità di captare gli
emboli di diametro ridotto (almeno 5 mm); la scarsa occlusività, grazie ad
una struttura sottile tale da occupare una ridotta porzione della sezione cavale
che consente di mantenere così un flusso sovrapponibile a quello fisiologico;
bassa trombogenicità, grazie sia alla scarsa occlusività ed al mantenimento di
un flusso laminare tra i fili del filtro, sia evitando zone di ristagno; sono dei
composti biocompatibili, resistenti e relativamente facili da utilizzare. Questi
dispositivi vengono impiantati per via percutanea (Fig. 3) e posizionati nella
vena cava inferiore sia al di sotto che al di sopra delle vene renali (Figg. 4, 5).
Attualmente vi sono tre tipi di filtro cavale: permanente, temporaneo e temporaneo di lunga durata. I filtri permanenti sono stati i primi ad essere introdotti
ed hanno subito nel tempo un miglioramento nei materiali caratterizzato soprattutto dall’utilizzo di leghe meno trombogene e di sistemi d’introduzione più
piccoli. In effetti, il problema principale dei filtri permanenti è rappresentato
dalla trombosi del filtro stesso e/o della vena utilizzata per l’inserimento del
filtro. Pertanto sono stati introdotti i filtri temporanei. La caratteristica principale è rappresentata dal fatto che vengono utilizzati per periodi non superiori ai
dieci giorni. Oltre questo limite temporale le maglie del filtro cominciano ad
essere inglobate dal neoendotelio e la rimozione risulta molto difficile, se non
impossibile. Essi pertanto vengono utilizzati soprattutto in concomitanza di un
trattamento fibrinolitico, oppure in previsione di un intervento chirurgico in sostituzione della terapia anticoagulante. Infine, il filtro temporaneo a lunga durata ha la caratteristica di poter restare nella vena cava per un periodo di quattro
settimane senza essere inglobato dall’endotelio.
Figura 3: Posizionamento trans-giugulare di un filtro cavale
Embolia polmonare
109
Figura 4: Filtro cavale posizionato nella vena cava inferiore al di sopra delle
vene renali.
Figura 5: Controllo radiologico del filtro cavale.
110
Capitolo 5
Le indicazioni comunemente accettate sono una TVP prossimale recente e la
controindicazione assoluta alla terapia anticoagulante (recente episodio emorragico); complicanze da terapia anticoagulante ben condotta; embolie
polmonari ricorrenti e/o progressione della TVP nonostante adeguata terapia
anticoagulante; scarsa risposta o difficile gestione della terapia anticoagulante. I filtri possono essere anche utilizzati al posto della terapia anticoagulante
nei pazienti con storia di pregressi fenomeni trombo-embolici che devono
essere sottoposti ad intervento chirurgico. In questo caso, infatti, non è possibile somministrare farmaci anticoagulanti per il rischio emorragico correlato
all’intervento. Ancora, i filtri possono essere utilizzati, in sostituzione della
terapia anticoagulante, nelle donne in gravidanza ad alto rischio embolico durante il parto oppure nei casi di immobilità prolungata associata a grave ipertensione polmonare. Non ci sono, invece, consensi univoci all’impianto di un
filtro cavale in caso di malattia tromboembolica in pazienti con ridotta riserva
polmonare, embolia polmonare cronica non trattata, trombo flottante in vena
cava. In queste situazioni la decisione viene presa caso per caso. Alcuni Autori sono addirittura contrari al posizionamento di questi dispositivi. Loro,
infatti, ritengono che i filtri costituiscono un potenziale pericolo di embolizzazione durante le manovre di posizionamento. Inoltre è stato evidenziato, in
uno studio multicentrico, che il posizionamento di un filtro cavale senza una
corretta terapia anticoagulante non migliora la prognosi in quanto, se da un
lato si riduce il numero dei fenomeni embolici, dall’altro aumentano i casi di
trombosi recidivanti causate spesso dalla trombosi del filtro stesso.
Le complicanze dei filtri cavali sono rappresentate da: una trombosi nel punto
d’inserimento che rappresenta una delle complicanze più frequenti ed è correlata al diametro del sistema d’introduzione; la migrazione del filtro verso le
cavità cardiache con conseguenti turbe del ritmo, perforazioni, infarto del
miocardio, tamponamento cardiaco; la trombosi cavale si verifica soprattutto
con i filtri permanenti ed è secondaria alla trombosi del filtro stesso. Ancora,
si possono verificare perforazioni vascolari, ad esempio della cava (dovuta
agli uncini che ancorano il filtro alla parete).
6. Patologie dell’arto superiore
Malattia poco conosciuta fino a qualche tempo fa, la trombosi delle vene
ascellare e succlavia ha assunto un interesse sempre crescente. La prima descrizione clinica dettagliata viene attribuita a von Schroetter nel 1884, anche
se Paget nel 1875 riportò un lavoro su trombosi spontanee delle vene ascellari
e sottoclaveari osservate da altri medici negli anni precedenti. Pertanto la
condizione generale di trombosi axillo-succlavia viene anche riportata come
sindrome di Paget-Schroetter.
La trombosi venosa dell’arto superiore viene comunemente distinta in primaria e secondaria. La forma primaria è legata ad una conformazione troppo
restrittiva della gabbia toracica e si verifica soprattutto negli atleti o nei
pazienti con sindrome dello stretto toracico superiore, mentre la forma secondaria, oggi più frequente, è su base iatrogena ed è legata alle manovre di
cateterizzazione quali quelle per la misurazione della PVC, per l’emodialisi,
per il posizionamento di pace-maker cardiaci o di presidi per chemioterapia.
Etiologia
La trombosi venosa primaria è legata alla compressione cronica delle
vene ascellare e succlavia all’interno dello stretto toracico. La vena
succlavia decorre, infatti, anteriormente al muscolo scaleno, posteroinferiormente alla faccia mediale della clavicola ed al di sopra della prima
costa. Le strutture che possono comprimere la vena sono varie e vengono
riconosciute nel tendine del muscolo piccolo pettorale, nel legamento
costo-coracoideo, nella prima costa, nel tendine del muscolo piccolo
rotondo ed anche nella testa dell’omero che agirebbe attraverso il tendine
del muscolo piccolo rotondo. Nei soggetti con sindrome dello stretto
toracico superiore i movimenti di abduzione dell’arto superiore
determinano un peggioramento della sintomatologia.
Tutte le trombosi che non riconoscono nella loro etiologia una causa compressiva possono essere classificate come forme secondarie. Rientrano in
questa forma tutte le lesioni da cateterismo così come le trombosi da causa
tumorale, da irradiazione, da iniezione di sostanze ipertoniche o sclerosanti e
da condizioni di ipercoagulabilità.
Spesso le trombosi che insorgono a seguito di cateterismo per dialisi o per
posizionamento di pace-maker restano asintomatiche; tuttavia, mentre nel
caso di un pace-maker la comparsa di trombosi non costringe alla rimozione
del catetere, essa impone invece l’adozione di una nuova via d’accesso per la
111
112
Capitolo 6
dialisi. Il trattamento radioterapico può determinare problemi sia a carico dei
vasi arteriosi che di quelli venosi. La fibrosi conseguente al trattamento
sembra essere la causa principale della trombosi tanto nel trattamento radioterapico che in quello chemioterapico.
Le malattie neoplastiche possono causare la trombosi venosa sia per la compressione esercitata sui vasi venosi che per lo stato di ipergcoagulabilità associato alla neoplasia.
Diagnosi
Diagnosi clinica
Nel 1942 un giovane De Bakey descriveva la trombosi venosa primaria dell’arto superiore in questo modo: “la trombosi, in genere, colpisce il sesso
maschile ed il braccio destro. Quando è interessato il braccio sinistro è perché
o il soggetto è mancino oppure ha sottoposto il braccio ad uno sforzo
particolare. In genere i soggetti colpiti sono giovani, robusti, muscolosi, che
praticano sport o lavori manuali particolarmente stressanti per il braccio”.
La trombosi, anche se raramente, si può presentare senza un’apparente ragione ed il soggetto si troverà improvvisamente un arto gonfio e dolente. La
modalità d’insorgenza potrà variare da forme acute severe a forme banali. In
genere il rapporto braccio Dx/Sn è di 2:1 mentre il rapporto uomo/donna è di
circa 4:1.
I segni e i sintomi più comuni sono rappresentati dal gonfiore, dal dolore,
dalla cianosi, dallo sviluppo di vene superficiali prominenti che assolvono il
compito di circoli collaterali per il drenaggio venoso. L’arto può essere interessato dalle dita della mano all’ascella e coinvolgere anche la base del collo
ed il petto, a seconda del livello di ostruzione. L’edema, che resta il segno
clinico principale, così come la cianosi, in genere, si risolvono dopo tre
settimane. In fase acuta è possibile palpare, a livello ascellare, una vena dilatata e di consistenza dura. Lo sviluppo dei circoli collaterali sarà particolarmente evidente soprattutto a livello della spalla, mentre la vena giugulare
interna non è, di solito, interessata. La presenza di turgore di questa vena,
tuttavia, deve mettere in allarme per la possibile presenza di una trombosi
della vena cava superiore.
La sintomatologia può comprendere anche sintomi neurologici quali parestesie e riduzione della forza prensile massima. Questo, ovviamente, accade
quando la sintomatologia venosa si inscrive nell’ambito di una sindrome
della stretto toracico superiore. Potranno, infine, essere presenti i segni e i
sintomi dell’embolia polmonare anche se questa decorre, nella maggior parte
Patologie dell’arto superiore
113
dei casi, in maniera asintomatica. L’incidenza di embolia polmonare nei casi
di TVP dell’arto superiore sembra aumentata rispetto a circa 20 anni fa,
attestandosi attualmente intorno al 10-30%. In realtà tale aumento sembra
essere correlato più al miglioramento delle capacità diagnostiche che ad un
vero aumento dell’incidenza. L’embolia polmonare può sopraggiungere durante la fase acuta oppure dopo la remissione dei sintomi; in quest’ultimo
caso essa può essere la spia di un nuovo episodio trombotico oppure di una
progressione del precedente trombo.
Diagnosi strumentale
Sicuramente possono essere utili il Doppler e l’eco-color-Doppler ma la visualizzazione della vena succlavia con tali metodiche è resa difficile dalla
presenza della clavicola. Pertanto, sono soprattutto l’angio-TC e l’angio-RM
a fornire le informazioni più utili in caso di TVP dell’arto superiore. L’angioRM dà immagini abbastanza dettagliate circa l’estensione del trombo, la
presenza di una trombosi completa o parziale e la presenza di segni di
ricanalizzazione. L’angio-TC risulta, invece, più utile per evidenziare la
presenza di strutture che comprimono la vena.
La flebografia fornisce le informazioni più significative per la diagnosi e per
la valutazione della corretta forma di trattamento. In particolare essa può
essere utile, come esame di secondo livello, per valutare gli effetti del movimento dell’arto superiore sul flusso venoso.
Terapia
Il trattamento prevede sostanzialmente gli stessi presidi descritti a proposito
della TVP degli arti inferiori e, pertanto, si può avvalere sia della terapia
medica che di quella chirurgica.
Anche se per motivi non ben chiari, la prognosi sembra essere peggiore per le
forme primarie rispetto a quelle secondarie; per questo viene instaurata, in
genere, una terapia più aggressiva nelle forme primarie. L’utilizzo della
terapia trombolitica, attraverso l’infusione di urokinasi, seguita dalla resezione della prima costa qualora in causa, rappresentano le strategie chirurgiche più appropriate nelle forme primarie.
La trombolisi può essere effettuata per via sistemica o loco-regionale. Per via
sistemica s’iniettano circa 200.000 U.I. di urokinasi come dose di attacco in
circa 5 minuti; a queste segue l’infusione di circa 1.000-1.500 U.I./kg/h dello
stesso farmaco. La terapia viene proseguita per circa 10 giorni monitorando i
valori emocoagulativi ed i prodotti di degradazione del fibrinogeno ogni 12
114
Capitolo 6
ore. Dopo la dimostrazione flebografica della lisi del trombo si prosegue la
terapia per altri 2-3 giorni.
È importante sottolineare che si ottengono buoni risultati se il trattamento
viene iniziato non oltre 8-10 giorni dall’insorgenza della trombosi.
Esiste una possibilità di circa il 40% di sanguinamento dalla sede della puntura, mentre in circa il 28% dei pazienti si potrà osservare ematuria.
L’introduzione della terapia trombolitica locale ha migliorato i risultati. Tale
approccio, infatti, si associa ad un minore rischio emorragico e ad una più elevata
efficacia. Il catetere viene introdotto di solito attraverso la vena basilica e portato all’interno del trombo dopo aver effettuato un esame flebografico. S’infondono
250.000 U.I. di urokinasi in un’ora ed altre 250.000 U.I. nell’ora successiva, per
continuare poi con una dose di 1.000/h nelle successive 24-72 ore. Prima di sospendere l’infusione di urokinasi si instaura una terapia anticoagulante con eparina
sodica che deve essere seguita dalla somministrazione di anticoagulanti orali per
circa 3 mesi, mantenendo un range terapeutico di INR compreso tra 2,5 e 3,5.
In alternativa alla terapia trombolitica può essere utilizzata la trombectomia
chirurgica. Tale procedura viene eseguita tramite catetere di Fogarty con accesso retroclaveare o trans-ascellare.
Nonostante un iniziale successo delle terapie sopra descritte, si potrà osservare una nuova trombosi se persiste l’insulto compressivo; è necessario, in
questi casi, procedere alla rimozione della struttura comprimente.
Nelle forme secondarie che spesso decorrono asintomatiche o pauci-sintomatiche, la terapia anticoagulante sembra essere la scelta più adatta. Il principale obiettivo della terapia è, ovviamente, quello di prevenire la progressione della trombosi ed evitare fenomeni di embolia polmonare. Nei pazienti
nei quali non è possibile avviare una terapia anticoagulante si possono ottenere ottimi risultati sollevando il braccio ed utilizzando delle fasciature
elastiche; questo non annulla il rischio di embolia polmonare.
Trattamento endovascolare delle TVP dell’arto superiore.
Anche in questo distretto venoso si è osservato, negli ultimi anni, un notevole
incremento nell’uso della terapia endovascolare per il trattamento delle trombosi
soprattutto a carico della vena succlavia utilizzata come accesso venoso per
l’inserimento di un catetere venoso centrale (CVC). Dall’analisi della letteratura,
il trattamento endovascolare viene utilizzato più frequentemente in caso di TVP
insorte in pazienti in trattamento emodialitico con CVC utlizzato per l’emodialisi.
Lo sviluppo di una TVP in questi pazienti si verifica in circa il 7% dei casi e
risulta essere indipendente dalla gestione del catetere.
Anche la presenza di un pace-maker dallo stesso lato di una fistola arterovenosa confezionata al polso aumenta il rischio di trombosi della vena cen-
Patologie dell’arto superiore
115
trale (80% dei casi con pace-maker dallo stesso lato della fistola contro il
20% con pace-maker dal lato opposto o senza pace-maker).
L’esecuzione della tecnica rispecchia sostanzialmente quanto detto a proposito del distretto sovra-inguinale. Anche in questo caso viene scelto l’accesso
femorale come via preferenziale e si utilizzano introduttori di 7-10 F con
palloni di circa 6-8 mm di diametro (Fig. 1). Questo accesso è seguito dal
posizionamento di stent autoespandibili o espandibili su pallone.
La procedura viene preceduta da eparinizzazione sistemica mentre nel postoperatorio si somministra eparina che viene poi embricata con anticoagulanti
orali per un periodo di almeno 2 mesi.
Il controllo post-operatorio può essere effettuato con eco-color-Doppler e/o
angio-TC o angio-RM a distanza di 1, 6, 12 mesi.
Esistono alcune note tecniche da tenere in considerazione che hanno un
grande impatto sulla pervietà a distanza di questa procedura. La presenza di
una fistola artero-venosa omolateralmente allo stent può determinare la
trombosi dello stent.
Lo sviluppo di una trombosi precoce dello stent può determinare la necessità
di legare la fistola e crearne una nuova controlateralmente. Questo dimostra
quanto sia importante non impiantare il pace-maker dallo stesso lato della
fistola oppure impiantare il pace-maker dal lato dominate del paziente visto
che in caso di un eventuale confezionamento di fistola artero-venosa per
accesso emodialitico di solito si sceglie il lato non dominante. Queste,
tuttavia, non rappresentano regole generali ma vengono stabilite caso per
caso.
Figura 1. Flebografia: evidente ostruzione della vena succlavia Dx. B: ottima
ricanalizzazione dopo dilatazione con palloncino
116
Capitolo 6
Comunque la pervietà primaria ad 1 anno dello stenting della succlavia è
stimata intorno al 70%, mentre se si esegue la sola angioplastica la pervietà
scende al 40%.
Letture consigliate
Robert B. Rutherford: Chirurgia Vascolare Antonio Delfino Editore, 1998
Vol. I e II
Wesley S. Moore: Compendio di Chirurgia Vascolare Antonio Delfino Editore, 2000
Enciclopedie Medico-Chirurgicale: Tecniche Chirurgiche-Chirurgia Vascolare Editions Scientifiques et Medicales Elsevier SAS Roma-Parigi, Vol..
I e II
Enciclopedie Medico-Chirurgicale: Angeiologie Editions Scientifiques et
Medicales Elsevier SAS Parigi
Società Italiana di Chirurgia Vascolare ed Endovascolare: Chirurgia Vascolare: patologia, diagnosi e trattamento delle malattie vascolari di interesse
chirurgico Edizioni Minerva Medica, Torino 2001
Hallett J.W: Compendio di Chirurgia Vascolare ed Endovascolare Elsevier
2005
D’Addato M., Bracale G.C., Odero A., Spartera C., Stella A.: Il follow-up in
Chirurgia Vascolare Edizioni Minerva Medica, Torino 1998
Spartera C.: Chirurgia delle arterie Masson Editore, 2005
117
118
QUADERNI DI CHIRURGIA VASCOLARE
(di prossima pubblicazione)
4. Insufficienza cerebro-vascolare.
5. Arteriopatia ostruttiva cronica degli arti inferiori.
Finito di stampare nel mese di ottobre del
dalla «ERMES. Servizi Editoriali Integrati S.r.l.»
Ariccia (RM) – via Quarto Negroni,
per conto della «Aracne editrice S.r.l.» di Roma