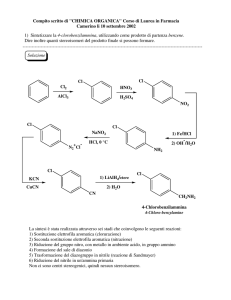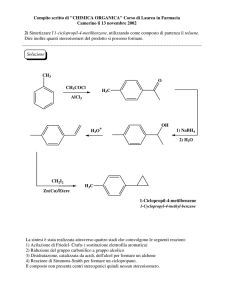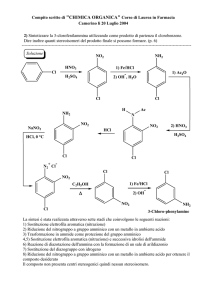
Capitolo 5
CompostiAromatici
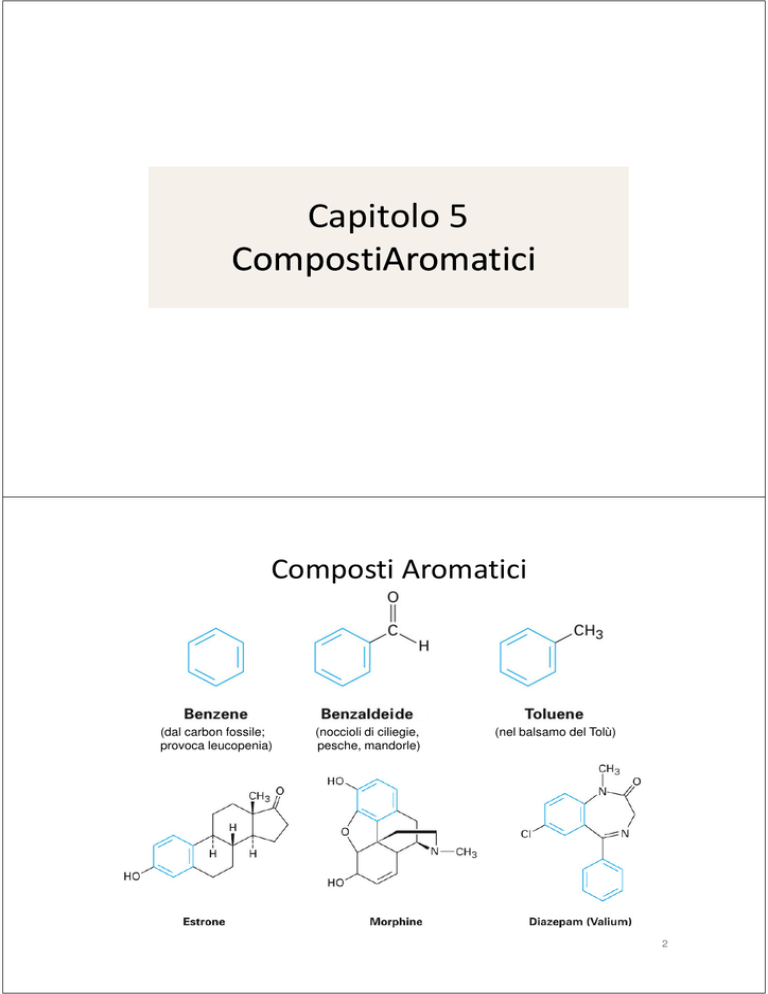
Composti Aromatici
(dal carbon fossile;
provoca leucopenia)
(noccioli di ciliegie,
pesche, mandorle)
(nel balsamo del Tolù)
2
Composti Aromatici: Nomenclatura
benzene
CH3
OH
NH2
toluene
fenolo
anilina
O
H2C
H
O
CH3
O
OH
CH
stirene
benzaldeide
acetofenone
acido benzoico
3
Composti Aromatici: Nomenclatura
(Ph)
Areni
(Bn)
4
Composti Aromatici: Nomenclatura
Benzeni disostituiti: prefissi
1.
orto- (o-)
2. meta- (m-)
3. para- (p-)
orto-Diclorobenzene
posizione relativa 1,2
posizione relativa 1,3
posizione relativa 1,4
meta-Dimetilbenzene
para-Clorobenzaldeide
Benzeni polisostituiti
4-bromo-1,2-dimetilbenzene
2,5-dimetilfenolo
2,4,6-trinitrotoluene
5
Struttura e Stabilità del Benzene
6
Struttura e Stabilità del Benzene
p
•
•
•
•
π
•
•
sp2
π
7
Struttura e Stabilità del Benzene
Calori (entalpie) di
idrogenazione
[36 kcal/mol]
8
Aromaticità e regola di Hückel
Proprietà comuni ai composti aromatici:
• Struttura ciclica, coniugata, planare, simmetrica
• Stabilità (Risonanza)
• Scarsa reattività
Regola di Hückel: numero totale di elettroni p(π) = 4n + 2
Benzene
Tre doppi legami
Sei elettroni π
(n = 1)
9
Antiaromaticità e regola di Hückel
Antiaromatici
• Non planari (C8)
• Non simmetrici
• Reattivi
Ciclobutadiene
Cicloottatetraene
Due doppi legami
Quattro elettroni π
Quattro doppi legami
Otto elettroni π
elettroni π ≠ 4n + 2
= 4n
10
Aromaticità e regola di Hückel
11
Aromaticità e regola di Hückel
12
Composti Aromatici Eterociclici
13
Eterocicli Aromatici
Piridina
X
Pirimidina
14
Eterocicli Aromatici
Pirrolo
Imidazolo
15
Eterocicli Aromatici
Tiofene
Furano
O
16
Composti Aromatici Policiclici
17
Naftalene
Energia di stabilizzazione ≈60 kcal/mol
(dal calore di idrogenazione)
18
Composti Aromatici Policiclici
Chinolina
Isochinolina
Indolo
Purina
Guanina
Triptofano
Adenina
Chinina (alcaloide, antimalarico)
19
Sostituzione Elettrofila Aromatica
(SEAr)
benzene
alchene
benzene sostituito
prodotto di addizione
20
Sostituzione Elettrofila Aromatica (SEAr)
21
Alogenazione Elettrofila Aromatica
22
Sostituzione Elettrofila Aromatica (SEAr)
23
Sostituzione Elettrofila Aromatica (SEAr)
intermedio
carbocationico
reagenti
prodotti
24
Alogenazione Elettrofila Aromatica
Non utilizzabile con F2
25
Alogenazioni Biologiche
Formazione elettrofilo:
Tiroxina (ormone tiroideo,
regola crescita e metabolismo)
26
Nitrazione Elettrofila Aromatica
Miscela solfo-nitrica
Acido nitrico
(più debole)
Acido solforico
(più forte)
Ione nitronio
Coloranti
Farmaci
27
Solfonazione Elettrofila Aromatica
Acido solforico fumante
28
Idrossilazione Elettrofila Aromatica
• Nei processi biologici
Coenzima FADH2
29
idroperossido
donatore di “OH+”
30
Alchilazione Elettrofila Aromatica
Alchilazione di Friedel-Crafts:
31
32
Alchilazione Elettrofila Aromatica
Limitazioni dell’alchilazione di Friedel-Crafts:
1. Elettrofili: solo alogenuri alchilici
2. Substrati: non procede su diversi derivati benzenici
3. Alcuni gruppi R possono dare trasposizione
33
34
Acilazione Elettrofila Aromatica
(non traspone)
Alchil aril chetone
Riduzione di
Clemmensen
Alchil aril chetone
Alchil benzene
35
Alchilazioni Aromatiche Biologiche
Organofosfato
Ione difosfato (PPi)
36
Difosfato di fitile
Acido 1,4-diidrossinaftoico
Fillochinone (vitamina K1)
37
Effetto dei Sostituenti sulla SEAr
• Influenzano la reattività
disattivanti
attivante
38
• Influenzano l’orientazione
o/p orientante
m orientante
39
Effetto dei Sostituenti sulla SEAr
Possono essere classificati come:
• Attivanti, orto/para-orientanti
• Disattivanti, meta-orientanti
• Disattivanti (debolmente), orto/para-orientanti (solo alogeni)
Disattivanti
meta-orientanti
Disattivanti
orto/para-orientanti
Attivanti
orto/para-orientanti
40
Effetto dei Sostituenti sulla SEAr
Sostituente
Reattività
Orientazione
‒R (alchile), ‒Ar (arile)
‒OH (idrossi), ‒OR (alcossi),
‒NH2 , ‒NHR, ‒NR2 (ammina)
‒NHC(=O)R (ammide)
Attivante
orto/para
‒alogeno
Disattivante
orto/para
‒NO2 (nitro), ‒CN (ciano)
‒CHO (aldeide), ‒COOH (acido)
‒COR (chetone), ‒COOR (estere),
‒SO3H (solfonico)
Disattivante
meta
41
Effetto dei Sostituenti sulla SEAr
• Effetto di elettron-donazione e elettron-attrazione
‒ a livello del substrato
(aumentano/diminuiscono la densità di carica sull’anello)
‒ a livello del carbocatione intermedio
(stabilizzano/destabilizzano la carica positiva)
‒ di tipo induttivo
(legato a differenze di elettronegatività)
‒ per effetto della risonanza
(legato alla coniugazione)
42
Effetto dei Sostituenti sulla SEAr
Reattività
Attivante
Disattivante
debole
Disattivante
forte
43
• Gruppi attivanti: elettron-donatori
aumentano la densità di carica sull’anello
orbitale π
• Gruppi disattivanti: elettron-attrattori
diminuiscono la densità di carica sull’anello
O
H
C
O
H
O
C
H
C
H
...
ef f etto induttivo
ef f etto di risonanza
44
• Gruppi attivanti: elettron-donatori
stabilizzano la carica positiva del carbocatione intermedio
CH3
CH3
E
+
H
E
...
ef f etto induttivo
H
OH
OH
O
E
+
E
E
H
H
...
ef f etto di risonanza
45
• Gruppi disattivanti: elettron-attrattori
destabilizzano la carica positiva del carbocatione intermedio
46
Gruppi attivanti, o/p-orientanti
47
Gruppi disattivanti, m-orientanti
48
Effetto dei Sostituenti sulla SEAr
• Gruppi attivanti: elettron-donatori (X)
• Gruppi disattivanti: elettron-attrattori (Y=Z)
49
Effetto dei Sostituenti sulla SEAR
Sostituente
Reattività
Orientazione
Effetto
induttivo
Effetto di
risonanza
‒CH3 (alchile)
Attivante
orto/para
Debolmente
donatore
‒
‒OH, ‒NH2
Attivante
orto/para
Attrattore
Fortemente
donatore
‒alogeno
Disattivante
orto/para
Attrattore
Debolmente
donatore
‒NO2, ‒CN
‒CHO, ‒COOH
‒COR, ‒COOR
‒SO3H
Disattivante
meta
Fortemente
attrattore
Fortemente
attrattore
50
Ossido/Riduzioni dei Composti Aromatici
• Ossidazioni e riduzioni degli anelli aromatici avvengono
con estrema difficoltà
• La presenza di un anello aromatico ha conseguenze sulla
reattività redox dei gruppi alchilici degli areni (Ph-R)
51
Ossido/Riduzioni dei Composti Aromatici
• Ossidazione degli alchil-benzeni con KMnO4 o Na2Cr2O7
52
Ossido/Riduzioni dei Composti Aromatici
Intermedio: radicale benzilico
Dopamina
Enzima: dopamina β-monoossigenasi
Noradrenalina
(neurotrasmettitore)
(contiene Cu-O•)
53
Ossido/Riduzioni dei Composti Aromatici
• Riduzione degli acil-benzeni con H2/Pd
54
Esempi di Sintesi Organica: Benzeni Polisostituti
1.
Effetti orientanti che si rinforzano a vicenda:
2.
Effetti orientanti antagonisti:
55
Esempi di Sintesi Organica: Benzeni Polisostituti
3.
Effetti sterici:
56