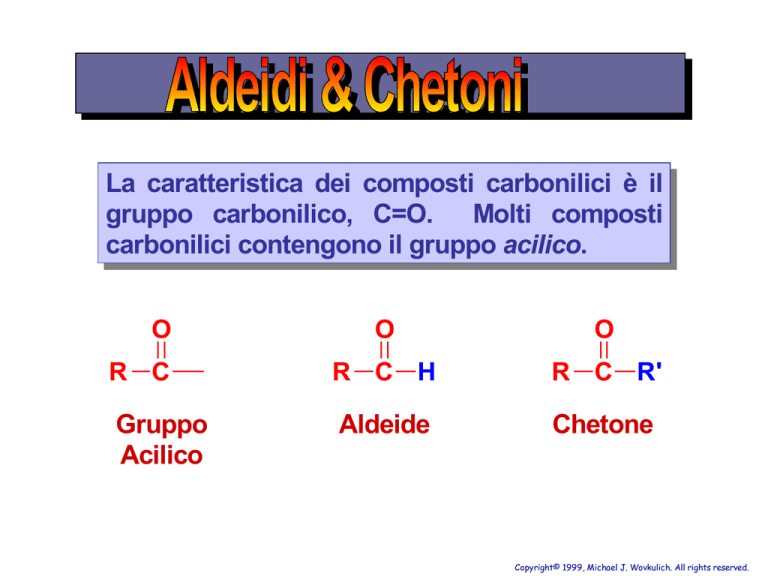
La caratteristica dei composti carbonilici è il
gruppo carbonilico, C=O. Molti composti
carbonilici contengono il gruppo acilico.
O
O
O
R C
R C H
R C R'
Gruppo
Acilico
Aldeide
Chetone
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Nomenclatura delle
aldeidi
O
O
HCH
CH3CH
metanale
formaldeide
etanale
acetaldeide
O
CH3
O
CH3CH2CH
CH3CHCH 2CH
propanale
propionaldeide
3-metilbutanale
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Nomenclatura delle aldeidi
Cl
O
CH3CHCHCH2CH
4-cloro-3-etilpentanale
CH2CH3
CH3
O
CH3CHCH2CH2CHCH
2-etil-5-metilesanale
CH2CH3
CH3 O
CH3CH CCH2CH
3-metil-3-pentenale
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
O
CASI SPECIALI
C
H
H
formaldeide
O
O
C H
benzaldeide
C
H
CH3
acetaldeide
Devi
Saperli !!
Nomenclatura dei chetoni
O
CH3CCH3
propanone
acetone
O
CH3CCH2CH3
2-butanone
O
CH3CHCCHCH3
Cl
2-cloro-4-metil-3-pentanone
CH3
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Nomenclatura dei chetoni
O
CH3
CH3CCH2CCH3
4,4-dimetil-2-pentanone
CH3
O
CH3CH2CH CHCCH3
3-esen-2-one
O
CH3CH CHCCHCH3
2-cloro-4-esen-3-one
Cl
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Il gruppo carbonilico
Il doppio legame carbonio-ossigeno è polarizzato,
con una parziale carica negativa sull’ossigeno ed
una parziale carica positiva sul carbonio.
Mappa del
potenziale
elettrostatico
O
C
Carbonio
polarizzato
positivamente
Ossigeno
polarizzato
negativamente
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Il gruppo carbonilico
Il gruppo carbonilico polarizzato è un sito
reattivo.
Il carbonio è elettronpovero e
l’ossigeno elettronricco.
Il carbonio
elettrofilo
reagisce con
basi e
nucleofili.
δO
C
δ+
L’ossigeno
nucleofilo
reagisce con
acidi ed
elettrofili.
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
NUCLEOFILO
( NUOVO TERMINE )
Gli alcheni sono donatori di coppie elettroniche
(basi di Lewis) o un…
NUCLEOFILO
( = amante del nucleo )
Il legame π
Ha un’alta
Densità
elettronica
BASE DI LEWIS
.
.
Donatore di coppie
elettroniche
SOMIGLIANZE
BASE = NUCLEOFILO
ACIDO = ELETTROFILO
Tutte le basi di Lewis sono nucleofili
Ma una base forte può non essere un buon
nucleofilo e vice versa.
Tutti gli acidi di Lewis sono elettrofili,
Ma un acido forte può non essere
Un buon elettrofilo e vice versa.
DIFFERENZE
Parametri cinetici
parametri termodinamici
nucleofilo
base
electrofilo
acido
Sono in relazione
Alla velocità di
reazione
Sono in relazione alla posizione
Di un equilibrio (energie di legame)
ESEMPIO
Un reattivo che reagisce velocemente è un buon
NUCLEOFILO
Un reattivo che forma un legame forte (prodotto stabile)
È una buona base.
Addizione Nucleofila al carbonile
Condizioni neutre
..
O:
C
-:Nu
+
.. _
:O:
slow
C
Nu
.. _
:O:
C
Nu
fast
+
H2O
o un acido
Nucleofili forti
(di solito carichi)
..
:O H
C
Nu
Ione
alcossido
Addizione nucleofila al carbonile
Catalisi Acida
..
O:
C
+
+
H
Più reattivo rispetto
al substrato non
protonato
H
C
..
:O
.. +
O H
C
fast
+
:O
H
slow
+
:Nu
C
Nu
(+)
Nucleofili deboli
(di solito non carichi)
pH 5-6
Addizione di Alcoli
Si addizionano 2 molecole di alcol
Addizione della prima molecola
O
R C R' + ROH
H+
O H
R C R'
EMIACETALE
O R
Addizione della seconda molecola
O H
R C R'
O R
+
H+
ROH
O R
R C R' + H O
O R
ACETALE
H
ACETALI E EMIACETALI
R
C O
ROH
H aldeide
R
C
H
OH ROH
OR
emiacetale
R
C O
R
ROH
chetone
R
C
R
OH ROH
OR
(emichetale)*
*non usa più
R
OR
C
H
OR
acetale
R
OR
C
R
OR
(chetale)*
*non usa più
Ciclizzazione di Monosaccaridi
Solo gli zuccheri sembrano formare
emiacetali stabili
emiacetale
O
H
H
HO
H
H
1
1C
C
2
3
4
OH
H
H
OH
HO
H
H
OH
5
6
CH2 OH
glucoso
..
O
..
H
H
2
3
4
OH
H
OH
5
6
CH2 OH
glucopiranoso
:O:
FURANOSI E PIRANOSI
H
4
: O:
5
O
O
2
3
OH
1
6
H
..
4
H
O
O:
3
piranoso
H
H
2
H
1
O
5
O
furano
O
pirano
OH
Sono sempre
possibili due
anomeri
furanoso
Per chiarezza non
Sono indicati gli
OH
ANOMERI
β-D-(+)-Glucose
H
: O:
O
O
OH
H
H
Carbonio anomerico
H
: O:
H
O
Non sono
Rappresentati
gli OH
(emiacetale)
O
H
OH
α-D-(+)-Glucose
Gli anomeri differiscono nella
Configurazione del carbonio anomerico
Glucoso
OH
OH
H2C
HO
O
emiacetale
H
HO
H2C
HO
OH
OH
α-D-(+)-Glucose
HO
O
OH
OH
H
β-D-(+)-Glucose
[α] = + 18.7°
34%
[α] = + 112.2°
66%
O
H
H
HO
H
H
1
OH
C
2
3
4
OH
H
HO
OH
5
6
H2C
CH2 OH
..
O
..
H
HO
< 0.001%
H
Equilibrium mixture:
: O:
O
[α] = + 52.7°
OH
H
Catena aperta
CH2OH
CH2OH
H
Cellobioso
H
O b OH
OH H
c
H
HO
H
H
OH
β-D-(+)-Glucose
L’uomo non
Idrolizza i legami
CH2OH
O
OH H
β-1,4
H
O
.. :
H
OH
c
O a OH
OH H
H
b O
H
HO
H
OH
CH2OH
H
H
OH H
a
enzima
Legame β-1,4-Glicosidico
Se continui si
ottiene cellulosa.
O
OH
H
OH
Cellobiose
ADDIZIONE DI AMINE AL
GRUPPO CARBONILICO
Reazioni con C=O :
AMINE PRIMARIE danno imine
Amine secondarie danno enamine
Amine terziare non reagiscono
AMINE:
H
R
R
R N H
R N H
R N R
primarie
secondarie
..
..
..
terziarie
AMINE PRIMARIE
IMINE
Formazione di Imine Semplici
R
C
R
..
O + H 2N
R
C
R
N
R + H 2O
R
an imine
RIMUOVERE
Meccanismo della Reazione
Nu debole – catalisi acida
H
H-O
2
G
..
NH2 +
R
..
O
.. 1
C
R
Addizione acido
catalizzata
G
..
N
H
R
C
O
R
H
slow
G
H
H
H-O-H
+
+
H
Perdita di H2O
R
..
N
G
R
C
H
G
+
N
H
H-O
H
R
H
H-O-H
+
C
imina
G
R
deprotonazione
..
N
..
OH
..
R
Scambio di protone
fast
..
H R
+
N C O H
R
C
R
+
+
H-O-H
H
Reagenti di Grignard
I reagenti di Grignard sono alogenuri di
organomagnesio, che contengono un legame
carbonio magnesio.
R X
+
Mg
ether
R Mg X
Reattivo di
Grignard
R = 1º, 2º, or 3º alchile, arile, o
alchenile
X = Cl, Br, or I
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Reattivo di Grignard
Br
+
Mg
ether
Mg Br
Bromuro di
fenilmagnesio
CH3CH2Cl
+
Mg
ether
CH3CH2MgCl
Cloruro di
etilmagnesio
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Reattivi di Grignard
I reattivi di Grignard contengono un legame C-Mg
altamente polarizzato.
δ
δ
C Mg
X
L’atomo di carbonio è sia un nucleofilo (reagisce con
elettrofili) che una base (reagisce con acidi).
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Reattivi di Grignard
I reattivi di Grignard reagiscono con aldeidi e chetoni
via addizione nucleofila per dare gli alcoli.
δ
O
Cδ
Aldeide o
chetone
δ δ
C Mg X
etere
MgX
O
C C
H 3O
Reattivo
intermedio
di
OH
Grignard
+ HOMgX
C C
alcol
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Prevedi i prodotti
O
HCH
1. ether
+
CH3MgI
formaldeide
O
CH3CH
1. ether
+
CH3MgI
aldeide
O
CH 3CCH3 +
chetone
2. H3O
2. H 3O
1. ether
CH3MgI
2. H3O
CH3CH2OH
Alcol 1°
OH
CH3CHCH3
Alcol 2°
OH
CH3CCH3
CH3
Alcol 3°
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Sintetizza il 2-Metil-1-Propanolo
Metodo retrosintetico.
CH3
CH3 C CH2OH
H
Alcol 1º
CH 3
CH2OH
CH3 C
H
CH3
H
CH3 C MgBr
H
Reattivo di
Grignard
C O
H
formaldeide
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
La sintesi del 2-Metil-1-Propanolo
CH3
CH3C Br
H
CH3
CH3C MgBr
H
Reattivo di
Grignard
Mg
ether
H
C O
+
H
formaldeide
CH3
CH3C MgBr
H
Reattivo di
Grignard
1. ether
+
2. H3O
CH3
CH3C CH2OH
H
Alcol 1º
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Sintesi dell’ 1-fenil-1-Propanolo
OH
C6H5 C CH 2CH 3
OH
C CH2CH3
C 6H 5
H
H
Alcol 2º
O
C6H5 MgBr
Reattivo di
Grignard
C CH2CH3
H
aldeide
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
La sintesi dell’ 1-fenil-1-propanolo
C6H5 Br
Mg
ether
C6H5 MgBr
Grignard
reagent
O
C6H5 MgBr + C CH2CH3
Grignard
reagent
H
aldeide
1. ether
+
2. H3O
OH
C6H5 C CH2CH3
H
2º alcohol
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Una seconda via per la sintesi dell’
1-fenil-1-propanolo
OH
C 6H5 C CH 2CH 3
H
OH
C6H5 C
CH2CH3
H
2º alcohol
O
C 6H5 C
H
aldeide
BrMg CH2CH3
Grignard
reagent
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Seconda sintesi dell’ 1fenil-1-propanolo
Br
CH2CH3
Mg
ether
BrMg CH2CH3
Reattivo di
Grignard
O
C6H5 C + BrMg CH2CH3
H
aldeide
Reattivo di
Grignard
1. ether
+
2. H3O
OH
C6H5 C CH2CH3
H
Alcol 2º
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Sintetizza il 2-Metil-1-Fenil-2-Butanolo
OH
OH
C6H5CH2
C CH2CH3
C6H5CH2
C CH2CH3
CH3
O
MgBr
C CH2CH3
CH3
CH3
Alcol 3º
C6H5CH2
chetone
Reattivo
di
Grignard
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Sintesi del 2-Metil-1-Fenil-2Butanolo
Br
CH3
Mg
ether
MgBr
CH3
Reattivo di
Grignard
O
C6H5CH2
MgBr
C CH2CH3 + CH3
chetone
1. ether
+
2. H3O
Reattivo di
Grignard
OH
C6H5CH2
C CH2CH3
CH3
Alcol 3º
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Una seconda via per la sintesi
del 2-Metil-1-Fenil-2-Butanolo
OH
OH
C6H5CH2
C CH2CH3
C CH2CH3
C6H5CH 2
CH3
CH3
Alocol 3º
O
C6H5CH2 MgBr
Reattivo
di
Grignard
C CH2CH3
CH3
chetone
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
La seconda sintesi del
2-Metil-1-Fenil-2-Butanolo
C6H5CH2
Br
Mg
ether
O
C6H5CH2
MgBr + C CH2CH3
CH3
Reattivo
di
Grignard
chetone
C6H5CH2
MgBr
Reattivo di
Grignard
1. ether
+
2. H3O
OH
C6H5CH2
C CH2CH3
CH3
Alcol 3º
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Una terza via per sintetizzare il
2-Metil-1-Fenil-2-Butanolo
OH
OH
C6H5CH2
C CH2CH3
C6H5CH2
CH3
C
CH2CH3
CH3
Alcol 3º
O
C6H5CH2
C
BrMg CH2CH3
CH3
chetone
Reattivo
di
Grignard
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
La terza via per la sintesi del
2-Metil-1-Fenil-2-Butanolo
Br
CH2CH 3
Mg
ether
O
C6H5CH2
C
CH3
chetone
+ BrMg
CH2CH3
Reattivo
di
Grignard
BrMg CH2CH3
Reattivo di
Grignard
1. ether
+
2. H 3O
OH
C6H5CH2
C CH2CH3
CH3
Alcol 3º
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
Sintetizza il 3-Pentanone
O
CH3CH2
C CH2CH3
O
CH3CH2
C
CH2CH3
O
CH3CH 2 MgBr
Reattivo di
Grignard
H C H
BrMg CH2CH3
formaldeide
Reattivo di
Grignard
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
La sintesi del 3-pentanone
Mg
ether
CH3CH2Br
CH3CH2MgBr
H
+
C O
H
Reattivo di
Grignard
CH3CH2MgBr
Reattivo di
Grignard
1. ether
+
2. H3O
formaldehyde
CH3CH2CH2OH
Alcol 1º
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
CH3CH2CH2OH
PCC
O
+ CH3CH2CH
Reattivo di
Grignard
CH3CH2CH
aldeide
Alcol 1º
CH3CH2MgBr
O
1. ether
+
2. H3O
OH
CH3CH2CCH2CH3
H
aldeide
OH
CH3CH2CCH2CH3
H
Alcol 2º
PCC
Alcol 2º
O
CH3CH2CCH2CH3
chetone
(3-pentanone)
Copyright© 1999, Michael J. Wovkulich. All rights reserved.
TAUTOMERIA CHETO-ENOLICA
Tautomeria cheto-enolica
H
O
K
C C
O
C C
H
cheto
enol
Per molti chetoni, all’equilibrio la
Forma chetonica prevale
Regola generale: gli enoli sono instabili
ol
O
H
C
C
ENOLi :
( hanno -OH legato ad un doppio legame)
ene
OH
NOTA :
I fenoli non sono enoli e sono stabili
perché aromatici
TAUTOMERIA
ENOLO
CHETO
O H
H 3C C CH 2
O
TAUTOMERI :
H 3C C CH2
specie in equilibrio
che differiscono per
posizione di un
protone
e di un doppio
legame.
H
ENOLO INSTABILE
H
La forma enolicaOnonH è favorita,
O
H
enol
H3C C CH2
+
H O H
keto
H
E
N
E
R
G
Y
rapidamente torna chetone.
Per interconvertire i tautomeri
Un protone viene trasferito
…..
Meccanismo
La tautomeria e’ catalizzata da tracce di
Acidi o basi
CATALISI
BASICA
..
O:
H
cheto
.. H-O:
..
O:
C C
C C
H
.. H-O: +
..
..
: O:
- ..
- ..
: O:
C C
C C
enolo
Strutture di risonanza
IONE
ENOLATO
..
H-O:
H
La tautomeria e’ catalizzata da tracce di
Acidi o basi
..
CATALISI
ACIDA
..
O:
H-O-H
+
H
C C
H
CHETO
.. H
+O
C C
..
H
:O-H
H
: O:
C C
H
..
+
H-O-H
+
H
ENOLO
PERCENTUALE DI CHETONE
O
OH
4.1 x 10-4 %
O
OH
CH3 C CH3
H2C
C CH3
O
H2C
CH C CH3
H2C
< 2 x 10-4 %
OH
CH C CH2
2.5 x 10-3 %
FATTORI CHE STABILIZZANO
LA FORMA ENOLICA
La percentuale di enolo in
1,3-Dichetoni sono più alte
O
O
H3C C CH2 C H
O
O
H3C C CH2 C CH3
O
O
H3C C CH2 C OC2H5
OH
O
H3C C C C H
OH
98 %
O
H3C C C C CH3
OH
80 %
O
H3C C C C OC2H5 8 %
O
H
R
O
O
R
H
H
R
O
R
H