Tecniche immunochimiche
Diagnostica biochimico-clinica
Lezione 4
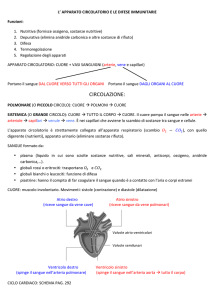
Risposta immunitaria
Il sistema immunitario serve per distinguere ciò che è proprio (self) da ciò che è estraneo
all’organismo (not self). Qualsiasi molecola o organismo patogeno capace di indurre una
risposta immunitaria è detto antigene.
Immunogenicità e Antigenicità
ANTIGENE: molecola che, introdotta in un organismo, è in grado di attivare la risposta
anticorpale. Gli antigeni sono tipicamente macromolecole solubili in acqua e che
possiedono un alto grado di complessità chimica. Le proteine eterologhe (cioè,
provenienti da organismi diversi) di massa molecolare >10000 Da sono generalmente
degli ottimi antigeni, mentre i piccoli peptidi non sono di solito antigenici.
Due sono essenzialmente le proprietà di un antigene:
IMMUNOGENICITÀ: capacità di indurre una risposta immunitaria
ANTIGENICITÀ: capacità di reagire in maniera specifica con i prodotti finali delle
risposte immunitarie (anticorpi e/o recettori di membrana)
Immunogenicità e Antigenicità
Da che cosa dipende l’immunogenicità di una sostanza?
Estraneità: il sistema immunitario è in grado di discriminare il “self” dal
“non self”, di conseguenza, le molecole estranee ad un determinato
organismo hanno capacità immunogenica;
Specie animale: le proprietà immunogene di un antigene variano a
seconda della specie animale utilizzata per la produzione di anticorpi;
Peso molecolare: più è elevato il peso molecolare della molecola in
esame e maggiore sarà la possibilità di avere una risposta immunogenica;
Degradabilità: macromolecole insolubili sono più immunogene di quelle
più piccole e solubili, poiché vengono più facilmente fagocitate ed elaborate
dal sistema macrofagico;
Complessità chimica e strutturale delle molecole: l’eterogeneicità chimica
apporta immunogenicità. Omopolimeri hanno bassa immunogenicità se
confrontata con eteropolimeri dello stesso peso molecolare. Gli antigeni
proteici risultano tanto più immunogeni quanto più sono complessi i loro
livelli di organizzazione molecolare (struttura terziaria e quaternaria).
Risposta immunitaria
Anche se le cellule B vivono pochi giorni a meno che non siano stimolate dal loro antigene,
alcune cellule B con memoria riconoscono il loro antigene dopo settimane o anche dopo
anni, producendo una risposta immunitaria più rapida e massiva (risposta secondaria).
Risposta immunitaria
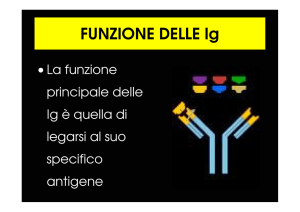
La risposta immunitaria umorale è mediata dagli anticorpi (immunoglobuline),
glicoproteine che possiedono domini costanti e domini variabili, in grado di riconoscere
antigeni specifici che sono prodotti dai linfociti B.
Risposta immunitaria
Il sistema immunitario è storicamente separato in due rami: immunità cellulare e immunità
umorale. L'immunità umorale è mediata da molecole in soluzione (anticorpi e
complemento). L'immunità cellulare è quella mediata da cellule, come i neutrofili e i
macrofagi che sono in grado di fagocitare e distruggere materiale estraneo.
Le immunoglobuline differiscono a livello delle catene pesanti
Gli anticorpi, prodotti dalle plasmacellule, appartengono al gruppo di proteine note come
immunoglobuline (Ig), classificabili in cinque diverse classi: IgG, IgA, IgM, IgE, e IgD. Le 5
classi di Ig differiscono per il tipo di catene pesanti e per la composizione in subunità.
Funzioni delle immunoglobuline
IgD: Ig di membrana. Concentrazione bassa nel siero. Funzione: segnale per la
proliferazione del clone B e il suo differenziamento in plasmacellule.
Valori: 3 mg/dl
IgE: estremamente bassa nel siero. Responsabili dei fenomeni di ipersensibilità di
tipo immediato (es. reazioni allergiche). IgE + allergene liberazione di
istamina.
Valori: 30 µg/dl
Funzioni delle immunoglobuline
IgG: maggior classe presente nel siero (80%)– sono le uniche Ig che passano dalla
madre al feto attraverso la placenta
Valori: 600 – 1800 mg/dl
IgA: concentrazione bassa nel siero, alta nelle secrezioni (saliva, latte, secrezioni
intestinali)
Valori: 90-400 mg/dl
IgM: PM circa 970.000Da – molecole complesse – risposta immunitaria primaria –
sono presenti oltre che nel siero anche sulla membrana dei linfociti B (Ig di
membrana)
Valori: 80-190 mg/dl
Struttura delle IgM
Le IgM, le prime ad essere secrete in risposta all’antigene, sono costituite da 5 molecole a
forma di Y disposte intorno ad una subunità centrale J. Sono efficaci contro i microrganismi.
Struttura delle IgG
Gli anticorpi strutturalmente più semplici sono le IgG, glicoproteine costituite da due
catene leggere (L) e due catene pesanti (H) che interagiscono mediante ponti disolfuro e
interazioni non covalenti formando una molecola simmetrica a forma di Y.
L’enzima proteolitico papaina
rompe le IgG in una regione a
cerniera
producendo
due
frammenti Fab (antigen binding)
identici ed un frammento Fc (c,
facilmente cristallizabile). Le IgG
legano gli antigeni in tre regioni
ad ansa presenti nei domini
variabili.
Legame antigene-anticorpo
L’associazione tra antigene-anticorpo coinvolge interazioni di van der Waals, idrofobiche,
ioniche e legami idrogeno. La specificità e l’affinità dipendono da una straordinaria
complementarità strutturale tra le due molecole (sistema chiave-serratura).
Legame antigene-anticorpo
L’unione che si instaura tra un antigene ed il corrispondente anticorpo porta alla
formazione di quello che viene definito IMMUNOCOMPLESSO. La formazione degli
immunocomplessi determina una serie di eventi finalizzati alla definitiva distruzione o
neutralizzazione dell’antigene.
Immunogenicità e Antigenicità
Affinità: forza dell’interazione antigene-anticorpo, misurata dalla
costante di equilibrio della reazione di associazione;
Reazione antigene-anticorpo: reazione dinamica e reversibile tra un
anticorpo e un antigene per dare origine al complesso antigene-anticorpo.
E’ caratterizzata da una costante di equilibrio definita;
Immunogeno: sostanza antigenica che, in contatto con un ospite
immunocompetente, è capace di stimolare la produzione di anticorpi
specifici;
Sito legante anticorpale: regione della molecola anticorpale capace di
combinarsi con il corrispondente determinante antigenico;
Determinante antigenico (epitopo): elemento strutturale della molecola
antigenica riconosciuto dall’anticorpo e capace di combinarsi con il
corrispondente sito legante anticorpale;
Marcatore: sostanza (radioisotopo, enzima, fluoroforo ecc) che introdotta
nella struttura di un reagente (antigene, aptene, anticorpo) ne consente la
rivelazione.
Tecniche immunochimiche
La specificità delle reazioni antigene-anticorpo e la sensibilità di “marcatori” (enzimi,
isotopi, sostanze fluorescenti, radicali liberi) possono essere combinate insieme per
compiere un “dosaggio immunologico”, ossia quantificare con precisione una sostanza
antigenica, presente nei fluidi biologici.
Tecniche immunochimiche
IMMUNODOSAGGI
Metodi con marcatura
Metodi senza marcatura
(traccianti radioisotopici, enzimatici,
fluorimetrici, bioluminescenti,
chemiluminescenti)
Agglutinazione
Precipitazione
Se avviene in soluzione acquosa
Se avviene in
matrice solida
Diretta
Indiretta
Se l’Ag è corpuscolato se l’Ag solubile, si fa adsorbire o
(cellule,batteri)
legare covalentemente a carrier
insolubili (e.g. sfere di lattice)
Reazioni di agglutinazione diretta
L’agglutinazione è un fenomeno dovuto all’aggregazione e alla sedimentazione di un
antigene dopo reazione con l’anticorpo. Si eseguono quando si vuole ricercare la presenza
di anticorpi nel siero di un paziente per diagnosticare una malattia infettiva (Siero immune
paziente + antigene corrispondente) oppure quando si vuole identificare un microrganismo
in base agli antigeni che possiede (Sospensione antigeni microbici + anticorpi specifici).
Si cercano le IgM: poiché hanno una durata limitata, la loro presenza è indice di risposta
immune contro una malattia in corso
Reazioni di agglutinazione
Reazioni di agglutinazione:determinazione del gruppo sanguigno
Le reazioni di agglutinazione vengono utilizzate per deteriminare il gruppo sanguigno.
Reazioni di agglutinazione:determinazione del gruppo sanguigno
La procedura consiste nel verificare la reazione del sangue di una persona con due diversi
tipi di siero immune contenente anticorpi anti-A o anti-B. Su un vetrino vengono poste due
gocce di sangue, ad una di esse viene aggiunta una goccia del siero "ANTI-A" e sull'altra una
goccia del siero "ANTI-B".
+
Se non si verifica alcuna reazione il sangue in esame appartiene al gruppo 0 (zero), se
invece si ha agglutinazione solo con l’anti-A è del gruppo A, se reagisce con l’anti-B è del
gruppo B, e se osserviamo la reazione di agglutinazione con l’anti-B e con l’anti-A il sangue
appartiene al gruppo AB.
Reazioni di agglutinazione: test di Combs diretto
Il test di Combs diretto per rilevare la presenza di anticorpi fissati alla superficie dei globuli
rossi viene eseguito anche per confermare la diagnosi di anemia emolitica autoimmune
dove gli anticorpi attaccano gli eritrociti del paziente stesso.
Reazioni di agglutinazione: test di Combs indiretto
Il test di coombs indiretto viene eseguito prima di una procedura medica che prevede un
eventuale scambio di sangue tra due pazienti (quale una trasfusione o la gravidanza).
Reazioni di agglutinazione indiretta
Nei test di agglutinazione indiretta l’antigene solubile si fa adsorbire o legare
covalentemente a carrier insolubili (eg. sfere di lattice)
Reazioni di agglutinazione indiretta
INFEZIONE BATTERICA: ricerca della Proteina C reattiva (CRP), prodotta dal fegato
• In vitro lega il polisaccaride C dello Pneumococco
• In vivo può legare: polisaccaridi batterici, funghi, parassiti unicellulari etc
• Aumenta nelle malattie reumatiche di natura infiammatoria, alcuni tumori e in numerose
condizioni patologiche
Test di agglutinazione con un Ab anti-CRP
La Proteina C reattiva, contenuta nel siero, causa l'agglutinazione di particelle di lattice
ricoperte di anticorpo anti-PCR.
Reazioni di agglutinazione indiretta
Reazioni di precipitazione
In adatte condizioni sperimentali e con adatti rapporti stechiometrici, se un antigene
solubile viene messo a contatto con un siero contenente anticorpi specifici, si può ottenere
la precipitazione del complesso antigene-anticorpo, anche di peso molecolare molto
elevato.
Reazioni di precipitazione
Il reticolo si forma solo quando la concentrazione degli antigeni e degli anticorpi è ottimale
cioè si creano dei “ponti” tra un immunocomplesso e l’altro.
Reazioni di precipitazione
Il test di precipitazione può essere effettuato in una provetta (Test di precipitazione ad
anello, Ring test). Ag e Ab diffondono in provetta. L’anello di precipitato si forma dove essi
raggiungono la zona di equivalenza.
Immunodiffusione
Se l’immunoprecipitazione avviene in un gel di agar, piastra Petri o su un vetrino si parla
più propriamente di Immunodiffusione.
Metodi di immunodiffusione più comuni per il dosaggio di antigeni:
Immunodiffusione radiale semplice
Immunodiffusione doppia
Immunoelettroforesi
Immunodiffusione radiale semplice
L’antigene diffonde nell’agar in cui è presente l’Ab. Si forma un anello di precipitazione il
cui diametro sarà funzione della concentrazione dell’antigene stesso.
Immunodiffusione doppia
Sia l’Ag che l’Ab diffondono radialmente dai pozzetti scavati nell’agar. Quando si raggiunge
la zona di equivalenza si forma l’alone di precipitato.
Immunodiffusione doppia
Utilizzando questa tecnica (Ouchterlony test) è possibile stabilire se due antigeni hanno
epitopi antigenici identici o parzialmente identici oppure se non hanno epitopi in comune.
Epitopi identici
Ag
Ab
Epitopi non identici Epitopi parzialmente identici
Immunodiffusione doppia
Il test di Ouchterlony test può anche essere utilizzato per stimare la concentrazione relativa
degli antigeni.
400
2000
80
A/S
0
16
3
Plasmaproteine dosabili con metodi immunologici
Immunoelettroforesi
L'immunoelettroforesi è una tecnica che unisce la specificità della reazione di
immunoprecipitazione con la separazione di molecole mediante elettroforesi. Solitamente
si utilizza un gel d'agarosio su cui si praticano due incisioni parallele e si scavano alcuni
pozzetti. Nei pozzetti si depositano gli antigeni e si fa avvenire l'elettroforesi.
Al termine dell'elettroforesi, le due incisioni parallele sono riempite con un antisiero
opportuno e si lascia in incubazione per una notte. Gli antigeni diffondono radialmente e gli
anticorpi diffondono lateralmente dando quindi luogo ad archi di precipitazione.
Immunoelettroforesi
L'immunoelettroforesi viene usata per indagini qualitative:
Nell’alterato anabolismo delle IgG (gammapatie mono- e policlonali)
Nello studio delle anomalie della sintesi proteica (analbuminemia, agammaglobulinemia,
ecc)
Metodi radioimmunologici (RIA, Radio-Immuno-Assay)
Metodo, per la misura di proteine, ormoni ecc. in fluidi biologici, basato sulla competizione,
tra un antigene non marcato ed una quantità nota dello stesso antigene marcato, per il
legame con un numero limitato e costante di siti anticorpali (DOSAGGI COMPETITIVI ED IN
DIFETTO DI REATTIVO)
Antigene non marcato, Ag
Antigene marcato (125I), Ag*
Anticorpo, Ab
Isotopi
Il termine isotopo indica quegli elementi che posseggono un uguale numero atomico
(protoni) (Z) pur avendo numero di massa (protoni+neutroni) (A) differente.
Il termine più corretto per indicare una specie atomica con un nucleo formato da un
determinato numero atomico e un determinato numero di neutroni N è nuclide o, se
radioattivo, radionuclide. Un radionuclide è un nuclide instabile che decade emettendo
energia sotto forma di radiazioni. I radioisotopi sono isotopi radioattivi, cioè radionuclidi di
uno stesso elemento chimico.
Isotopi
La radioattività è un insieme di processi fisico-nucleari attraverso i quali alcuni nuclei
atomici instabili o radioattivi (radionuclidi) decadono in un certo tempo detto tempo di
decadimento, in nuclei di energia inferiore raggiungendo uno stato di maggiore stabilità
con emissione di radiazioni ionizzanti.
Storicamente i decadimenti nucleari sono stati raggruppati in tre classi principali:
decadimento alfa, beta e gamma. Nel decadimento alfa e beta cambia il numero di protoni
nel nucleo e quindi il numero di elettroni che vi orbitano attorno (cambiando così la natura
chimica dell'atomo stesso), il decadimento gamma avviene fra stati eccitati dello stesso
nucleo e comporta solo la perdita di energia.
Tecniche radioimmunologiche (RIA)
1. All’equilibrio, dopo aver separato l’immunocomplesso marcato dall’antigene marcato
libero, si procede alla misura della radioattività (dosaggio dei raggi γ) delle due soluzioni:
(F)= antigene free
(B)= antigene bounded
concentrazione nota
concentrazione nota
Ag*
+
Ab
(F)
Ag*Ab
(B)
Radioattività legata (B)
radioattività libera(F)
all'equilibrio (A)
Tecniche radioimmunologiche (RIA)
Separazione dell’antigene libero da quello legato all’anticorpo
Filtrazione su gel
Precipitazione con anti Ab
Centrifugazione
Tecniche radioimmunologiche (RIA)
2. Costruzione retta di taratura. Supponiamo di aggiungere lo stesso tipo di antigene, ma
non marcato in quantità note.
C2
C1
C3
Aumentando la concentrazione dell’antigene non marcato, favorisco la COMPETIZIONE con
l’antigene marcato per i siti di legame sull’anticorpo.
Tecniche radioimmunologiche (RIA)
Sempre separando l’immunocomplesso dall’antigene libero, si misura la radioattività delle
due soluzioni monitorando lo spiazzamento dell'antigene marcato:
Ag*Ab
+
Ag
Ag*Ab + AgAb
ogni volta che si aggiunge una quantità nota di
il rapporto (B)
Radioattività legata(B)
Radioattività libera(F)
antigene non marcato, tale rapporto diminuisce
all’aumentare della quantità di antigene non
marcato)
Per differenza tra A (tutti gli Ab occupati dall’Ag marcato) e B (Ab legano sia Ag
radioattivo che normale) s'individua la quantità di Ag freddo legato a Ab.
Maggiore è la concentrazione di Ag non radioattivo minore è la quantità di Ag*
radioattivo legato all'Ab.
Tecniche radioimmunologiche (RIA)
Ag*Ab
Si può costruire una retta di taratura, che riporta in grafico tale rapporto in funzione delle
concentrazioni note di antigene non marcato usate libero.
Ag non marcato
(scala decimale)
Ag non marcato
(scala logaritmica)
Tecniche radioimmunologiche (RIA)
Una volta costruita la retta di taratura si può analizzare un sistema in cui l’antigene non
marcato si trova in un fluido biologico a concentrazione ignota che viene determinata per
interpolazione sulla retta di taratura. La concentrazione di anticorpo, in difetto rispetto alla
quantità necessaria per legare tutto l’antigene presente e la concentrazione di antigene
marcato sono entrambe note.
La tecnica del dosaggio radioimmunologico è comune in vari ambiti clinici: diagnosi del
diabete (dosaggio insulina), dell’ipertensione, di patologie correlate a disfunzioni tiroidee e
dell'ormone della crescita, dosaggio nel sangue di sostanze stupefacenti o applicazioni
forensi (antidoping).
Applicazioni RIA in biochimica clinica
Tecniche radioimmunologiche (RIA)
Vantaggi del RIA
Si dosa qualsiasi composto che sia però disponibile anche in forma marcata
Elevata sensibilità (pg/ml)
Elevata specificità
Elevata precisione
Procedura automatizzata, quindi analisi di elevato numero di campioni
Svantaggi del RIA
Costo elevato di apparecchiature e reagenti
Durata dei reagenti
Pericoli radiologici legati all’uso del radioattivo
Tempi di risposta lunghi
Metodi immunoenzimatici (EIA, Enzyme immunoassay)
Gli antigeni sono marcati non con radionuclidi ma con enzimi. Il dosaggio avviene con
tecniche spettroscopiche.
L'ELISA (Enzyme Linked Immunosorbent Assay) è una tecnica molto utilizzata, basata sulla
coniugazione chimica di enzimi (quali ad es. la fosfatasi alcalina o la perossidasi) con
anticorpi o antigeni. L’attività di questi enzimi è facilmente monitorabile e consente di
quantificare la concentrazione di complesso coniugato (‘marcato’) con facilità e precisione.
Metodi immunoenzimatici (EIA, Enzyme immunoassay)
A seconda del particolare metodo utilizzato, l’ELISA può servire per il dosaggio di antigeni o
anticorpi. L’antigene o anticorpo è riconosciuto da un anticorpo secondario (detection ab)
marcato con un enzima (Enzyme linked), capace di dare una reazione il cui prodotto sia
colorato.
Diagramma di processo del dosaggio ELISA
Diagramma di processo del dosaggio ELISA
Diagramma di processo del dosaggio ELISA
Diagramma di processo del dosaggio ELISA
Dosaggio ELISA
Gli enzimi più comunemente usati sono la perossidasi di rafano (HRP) o la fosfatasi
alcalina (AP).
I substrati enzimatici dovrebbero essere idealmente stabili, non tossici e poco costosi:
substrati non colorati sono convertiti in prodotti colorati (es. OPD,arancio e TMB, blu).
Dosaggio ELISA
Tipi di ELISA
DIRETTO (Anticorpo primario marcato)
INDIRETTO (Anticorpo secondario marcato)
COMPETITIVO DIRETTO
SANDWICH ELISA DIRETTO
SANDWICH ELISA INDIRETTO
METODO ELISA DIRETTO
In questo metodo, che consente di titolare un antigene, è un anticorpo primario che deve
essere coniugato con un enzima indicatore. Si fa reagire una soluzione di un anticorpo
specifico marcato con un enzima con un antigene ancorato ad una fase solida.
Substrato
Ab primario
coniugato
Ag
Dopo aver lavato, si aggiunge il substrato dell'enzima. In questa tecnica, l'attività
enzimatica misurata sarà direttamente proporzionale alla quantità di antigene presente.
METODO ELISA INDIRETTO
Serve per titolare un anticorpo, anziché un antigene. E’ l’anticorpo secondario ad essere
coniugato all’enzima. Il materiale da dosare (ad es. un siero umano contenente IgG) viene
fatto reagire con l’apposito antigene legato ad una fase solida. Dopo reazione del siero con
l’antigene immobilizzato, il materiale che non si è legato viene rimosso mediante lavaggio.
Si aggiunge poi un anticorpo anti-IgG umane coniugato con un enzima. Si lava di nuovo e si
aggiunge substrato dell’enzima: l’attività misurata sarà direttamente proporzionale alla
quantità di anticorpo specifico presente nel siero originale.
METODO SANDWICH ELISA DIRETTO
Questa metodica può essere utilizzata esclusivamente quando l’analita possiede almeno
due epitopi. Un eccesso di anticorpo verso il primo sito antigenico viene immobilizzato sulla
fase solida e incubato con diluizioni successive di antigene presente nel campione
incognito.
Dopo il lavaggio, il complesso AgAb immobilizzato viene incubato con una concentrazione
fissa di anticorpo marcato che andrà a legarsi al secondo sito antigenico
dell’immunocomplesso. La misura del prodotto della reazione enzimatica risulterà
direttamente proporzionale alla concentrazione dell’antigene da stimare.
METODO SANDWICH ELISA INDIRETTO
Si fa reagire una soluzione ignota di antigene con un anticorpo specifico legato ad una fase
solida, si lava e si aggiunge un secondo anticorpo (che dovrà essere policlonale oppure
dovrà essere un anticorpo monoclonale diverso da quello immobilizzato, capace di
riconoscere un diverso epitopo dell'antigene).
Substrato
Ag
Dopo un secondo lavaggio si aggiunge un terzo anticorpo, capace di legarsi al secondo e
marcato con l’enzima; dopo opportuni lavaggi, viene aggiunto il substrato dell'enzima. In
questa tecnica, l'attività enzimatica misurata sarà direttamente proporzionale alla quantità
di antigene presente.
METODO ELISA COMPETITIVO DIRETTO
Una quantità fissa di antigene marcato (blu) e diluizioni decrescenti di antigene libero
(come standard o nel campione, rosso) vengono messe a reagire insieme nei confronti di un
anticorpo in difetto. In questo modo, l’antigene marcato e quello libero si troveranno a
competere per un numero limitato di siti anticorpali.
Dopo aver lavato il complesso, si aggiunge il substrato per l’enzima e si misura l’attività
enzimatica. La concentrazione del prodotto enzimatico misurata risulterà inversamente
proporzionale alla concentrazione dell’analita (antigene non marcato).
DIPSTICK ELISA
Il saggio ELISA può essere semplificato mediante l’utilizzo di strip su cui sono immobilizzati
gli Ab o gli Ag.
Applicazioni ELISA in chimica clinica
Ricerca di proteine nel plasma a basse concentrazioni, dosaggio del ferro nel siero, ricerca
di anticorpi (anti-HIV), ricerca di ormoni come insulina, estrogeni, gonadotropina corionica
umana, antigeni di superficie delle epatiti, etc.