SEZIONE SCIENTIFICA - Patologia in pillole
PATOLOGIA IN PILLOLE
Nr. 61
A. Genini, M. Motta, L. Leoncini
Storia clinica
Uomo di 44 anni con esiti di trapianto
allogenico di cellule staminali ematopoietiche per leucemia mieloide acuta
avvenuto 13 mesi prima dell’attuale
problematica. Durante un recente soggiorno in Brasile comparsa di diarrea
acquosa per la quale viene iniziato un
trattamento con antibiotici senza aver
effettuato coprocolture. A fronte di un
ulteriore peggioramento della sintomatologia il paziente rientra immediatamente in Svizzera dove vengono eseguite coprocolture e, in seguito, colonscopia; quest’ultima mostra una pancolite con lesioni ulcerative superficiali.
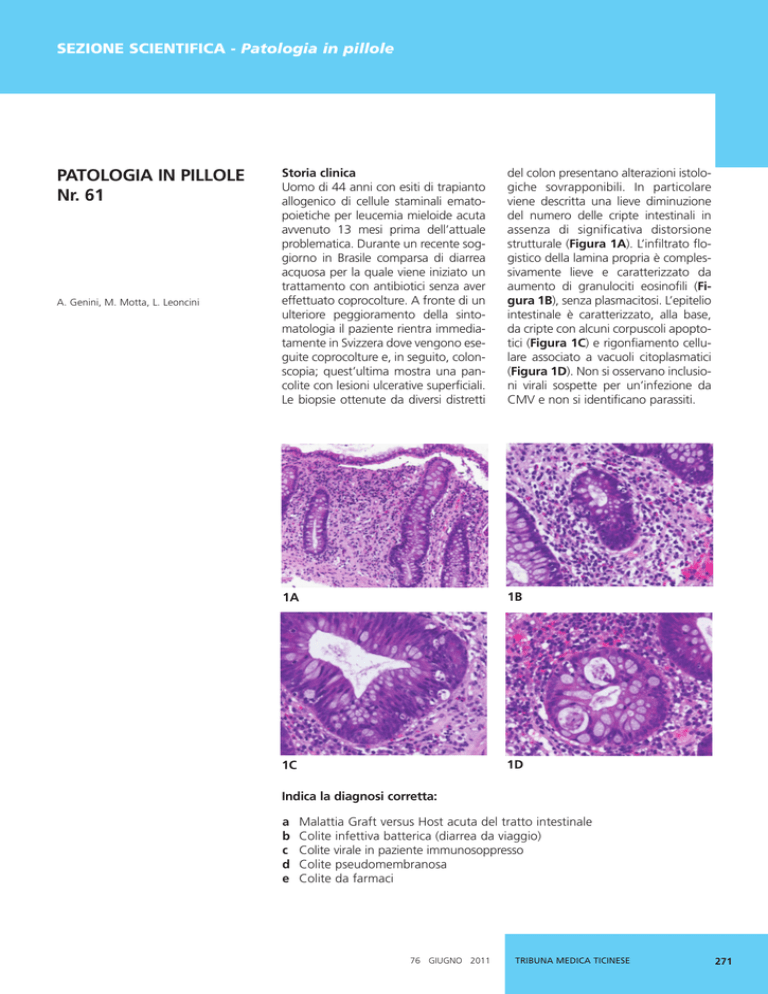
Le biopsie ottenute da diversi distretti
del colon presentano alterazioni istologiche sovrapponibili. In particolare
viene descritta una lieve diminuzione
del numero delle cripte intestinali in
assenza di significativa distorsione
strutturale (Figura 1A). L’infiltrato flogistico della lamina propria è complessivamente lieve e caratterizzato da
aumento di granulociti eosinofili (Figura 1B), senza plasmacitosi. L’epitelio
intestinale è caratterizzato, alla base,
da cripte con alcuni corpuscoli apoptotici (Figura 1C) e rigonfiamento cellulare associato a vacuoli citoplasmatici
(Figura 1D). Non si osservano inclusioni virali sospette per un’infezione da
CMV e non si identificano parassiti.
1A
1B
1C
1D
Indica la diagnosi corretta:
a
b
c
d
e
Malattia Graft versus Host acuta del tratto intestinale
Colite infettiva batterica (diarrea da viaggio)
Colite virale in paziente immunosoppresso
Colite pseudomembranosa
Colite da farmaci
76 GIUGNO 2011
TRIBUNA MEDICA TICINESE
271
SEZIONE SCIENTIFICA - Patologia in pillole
Diagnosi
Malattia Graft versus Host acuta
del tratto intestinale
Commento
La malattia “Graft versus Host” (Graft
versus Host Disease, GvHD) è tra le più
frequenti complicanze del trapianto di
cellule staminali ematopoietiche
(Hematopoietic stem cell transplantation, HSCT). Nel corso dell’ultimo
decennio, la prognosi di pazienti sottoposti a HSCT è molto migliorata, non
da ultimo grazie alla migliore tipizzazione genetica del donatore e del ricevente nonché all’ottimizzazione della
profilassi delle malattie infettive e delle
strategie immuno-soppressive posttrapianto. Se da un lato i buoni risultati hanno addirittura permesso di allargare le indicazioni per un HSCT, d’altro
lato, il GvHD, anche con conseguenze
letali, continua a limitarne l’uso.
Attualmente, malgrado un profilo
genetico identico, una percentuale di
pazienti compresa fra il 20 e il 50%
che si sottopone a HSCT e addirittura
fino a 10% dei pazienti dopo trapianto autologo manifesta una forma più o
meno grave di GvHD.
Aspetti clinici
Clinicamente, gli organi maggiormente
colpiti dal GvHD sono la cute e le
mucose, che di regola sono anche il
primo luogo in cui si manifesta la forma
acuta. Seguono il tratto gastrointestinale e il fegato. Di rado sono coinvolti
anche i polmoni. Nella cute si sviluppa
un esantema maculo-papuloso pruriginoso al torace, alle braccia oppure al
palmo delle mani o alla pianta dei piedi
che può progredire fino a causare eritrodermia generalizzata con vescicole e
necrosi. Alterazioni simili possono
anche manifestarsi nelle mucose. Il
coinvolgimento del tratto gastrointestinale è caratterizzato da nausea, vomito, dolori addominali, diarrea di tipo
secretorio (fino a 2000 ml al giorno) e
ileo paralitico. La comparsa di diarrea
sanguinolenta è associata a cattiva pro-
272
TRIBUNA MEDICA TICINESE
gnosi e alla comparsa di estese ulcere
intestinali con conseguente rischio di
setticemia. A livello epatico la diagnosi
di GvHD acuto è spesso difficile in
quanto si devono escludere altre cause
di epatopatie in pazienti con trapianto
allogenico del midollo, quali ad esempio malattia veno-occlusiva, epatite da
farmaci oppure epatite virale. Sintomi
caratteristici sono colestasi e iperbilirubinemia secondari a danno e distruzione dei dotti biliari.
Storicamente la forma acuta di GvHD
era definita dalla comparsa di malattia
nei primi 100 giorni post-trapianto
mentre la forma cronica dalla comparsa di sintomi dopo questo intervallo.
Esistono tuttavia forme acute di GvHD
che possono manifestrasi tardivamente e forme miste tra GvHD acuto e cronico. I sintomi clinici del GvHD cronico
sono molteplici e riassunti nella
Tabella 1.
Aspetti fisiopatologici
Il GvHD inizia quando i linfociti T del
donatore riconoscono come “estra-
nei” antigeni del ricevente e quindi
innescano una reazione flogistica.
L’antigene del ricevente responsabile di
questo processo è l’Human Leukocyte
Antigen (HLA). Si tratta di una proteina
di membrana che è posta su tutte le
cellule nucleate, nel caso dell’HLA di
classe I, e solo sulle cellule presentanti
antigeni (antigene presenting cells,
APC) per quanto riguarda la classe II,
ossia linfociti B, cellule dendritiche e
monociti. L’HLA non determina solamente l’istocompatibilità, ma ha un
ruolo fondamentale in tutto il processo
di riconoscimento e regolazione delle
cellule T. Il gene codificante l’HLA,
detto MHC (Major Histocompatibility
Complex), si trova sul braccio corto del
cromosoma 6 e ha al suo interno diversi loci altamente polimorfi. Per la tipizzazione, di regola, se ne considerano
da 6 o 10 (tra gli altri: DQB1, DRB1,
HLA-B, HLA-C, ecc.). L’incidenza della
GvHD è direttamente proporzionale al
grado di discrepanza tra l’HLA del
donatore e del ricevente. La GvHD
varia, infatti, da un’incidenza del 35-
Cute
Disturbi della pigmentazione, alopecia, poichiloderma, sclerosi, eruzioni lichen planus simili
Unghie
Distrofia e perdita
Cavo orale
Xerostomia, ulcere, aspetti lichen-simili, sclerosi
Occhi
Xeroftalmia, congiuntivite cicatriziale
Muscoli, fascie e
articolazioni
Fascite, miosite, rigidità articolare su contratture
Genitali femminili
Sclerosi vaginale, ulcere
Tratto gastrointestinale
Anoressia, calo ponderale, stritture esofagee
Fegato
Ittero, aumento delle transaminasi
Polmoni
Disturbi restrittivi o ostruttivi ai test funzionali,
bronchiolite obliterante, versamneto pleurico
Reni
Sindrome nefrotica (rara)
Cuore
Pericardite
Tab. 1: Sintomi della malattia GvHD cronica (ref. 3)
76 GIUGNO 2011
SEZIONE SCIENTIFICA - Patologia in pillole
45% quando gli HLA sono completamente concordanti (“10/10 matches”)
a un’incidenza del 60-80% nei riceventi che hanno una discordanza negli
HLA (“9/10 matches”).
Oltre all’HLA ci sono ulteriori fattori
che inducono la GvHD e che possono
spiegare la comparsa di questo fenomeno anche tra HLA identici, come ad
esempio nel caso di trapianto autologo. Il più importante antigene HLAindipendente è il mHA (minor
Histocompatibility Antigen), peptide
derivato da proteine intracellulari e
presentato da specifiche molecole
dell’HLA. In letteratura scientifica sono
stati descritti anche altri polimorfismi
genetici, che sono associati alla comparsa della GvHD. Quest’ultimi si trovano soprattutto all’interno del loci
genetici codificanti le citochine e nei
geni NOD2/ CARD15, responsabili per
la sintesi di proteine coinvolte nella
risposta immunitaria innata nell’ambito d’infezioni batteriche.
La fisiopatologia di GvHD è caratterizzata da tre fasi. Nella fase afferente
avvengono l’attivazione delle cellule
APC dell’ospite con conseguente
sovraespressione di proteine HLA e
l’incremento della sintesi di citochine
pro-infiammatorie, tra cui IL-1, TNFalfa, IL-6 e IFN-gamma. L’evento scatenante principale è il danno tissutale
dovuto al regime chemioterapico di
condizionamento che precede il tra-
pianto, coadiuvato da possibili comorbidità o aspetti specifici della malattia
ematologia di base. Si suppone che le
manifestazioni cliniche quasi esclusive
nella cute e nel tratto gastrointestinale siano dovute anche al fatto che in
questi organi il danno tissutale facilita
la penetrazione nell’organismo di
endotossine batteriche come i liposaccaridi che costituiscono un notevole
stimolo pro-infiammatorio. Nella
seconda fase, detta d’induzione ed
espansione, si assiste a attivazione e
proliferazione delle cellule T del donatore in risposta alle cellule APC dell’ospite e a tutto il substrato pro-flogistico creatosi nella fase precedente. A
potenziare questo fenomeno, i linfociti T attivati, a loro volta, sintetizzano
ulteriori citochine, soprattutto IL-2,
INF-gamma e TNF-alfa. Nella terza
fase subentrano i caratteristici sintomi
clinici dovuti al danno tissutale mediato da linfociti citotossici. La fisiopatologia di GvHD cronico, al contrario, è
ancora poco compresa. Si suppone
che processi di tipo autoimmune
abbiano un ruolo importante.
Graft-versus-Leukemia (GvL)
Si parla di questo fenomeno immunologico quando i linfociti T del donatore riconoscono come estranee le cellule tumorali del ricevente. Quest’ultime
diventano quindi il tessuto bersaglio
dell’effetto citotossico descritto nella
Grado
Aspetti istologici
I
Rare corpuscoli apoptotici senza perdita di cripte
II
Perdita di cripte
III
Perdita sostanziale di cripte (almeno due cripte
adiacenti)
IV
Cripte scarse o totalmente assenti. Estese ulcere
Tab. 2: grado istologico del GvHD acuto gastrointestinale
76 GIUGNO 2011
terza fase della patofisiologia esposta
sopra. Questo “aspetto terapeutico”
della GvHD, ben conosciuto in clinica,
favorisce la remissione completa e guarigione di diverse neoplasie ematologiche, permettendo tra l’altro la riduzione del regime di condizionamento. Il
fenomeno GvL rappresenta pertanto
un evento favorevole per il paziente,
tanto che minimizzarne gli effetti, per
esempio inattivando i linfociti T del
donatore, potrebbe risultare controproducente in quanto si diminuisce
anche l’effetto curativo dell’allotrapianto.
Caratteristiche istologiche
L’aspetto caratteristico della GvHD
acuto nel tratto gastrointestinale è la
presenza di apoptosi dell’epitelio,
accentuata nelle regioni a carattere
rigenerativo quali ad esempio il fondo
delle cripte intestinali. Con il termine
“exploding crypt cell” si intendono le
cellule epiteliali che, essendo in fase
florida di apoptosi, contengono vistosi
vacuoli intracitoplasmatici carichi di
frammenti nucleari derivanti da carioressi. Si propone come significativa per
la diagnosi di GvHD la presenza di
almeno un corpo apoptotico per biopsia. Con l’aggravarsi della malattia si
aggiungono empiemi criptici, necrosi,
perdita di cripte e ulcere. In diagnosi
differenziale, soprattutto nei primi 20
giorni dopo il trapianto, bisogna considerare alterazioni dovute all’effetto
sulla mucosa normale dei chemioterapici utilizzati nella fase d’induzione.
Coliti virali, in particolare da CMV in
pazienti immunosoppressi, possono
anche stimolare processi apoptotici e
quindi simulare una GvHD acuto. Infine
e bene ricordare che anche gli inibitori
della pompa protonica possono causare alterazioni della mucosa gastrica
caratterizzate dalla presenza di apoptosi cellulare. L’utilizzo di un grado istologico, al fine di determinare la severità
della GvHD nel tratto gastrointestinale,
è controverso. La classificazione proposta (Tabella 2) riflette il tempo di guari-
TRIBUNA MEDICA TICINESE
273
SEZIONE SCIENTIFICA - Patologia in pillole
gione del paziente e facilita l’assunzione di decisioni terapeutiche prima che
si verifichino lesioni permanenti.
Purtroppo però non c’è buona correlazione tra grading istologico e clinica.
In conclusione abbiamo presentato il
caso di un paziente coinvolto da una
GvHD acuta tardiva del tratto gastrointestinale ed in particolare del colon,
al quale sono stati somministrati steroidi (Prednisone 100 mg/die a scalare) che hanno condotto a risoluzione
completa dei sintomi.
Alessandro Genini, cand med,
Istituto cantonale di patologia
M. Motta e L. Leoncini
Servizio di Ematologia
Ospedale San Giovanni, Bellinzona
Bibliografia
1 Washington K, Jagasia M. pathology of graftversus-host disease in the gastrointestnal
tract. Hum Pathol 2009, 40:909-917
2 Ball LM et al. Acute GvHD: pathogenesis and
classification. Bone Marrow Transplantation
2008, 41, S58-S64
3 Ferrara JLM et al. Graft-versus-Host Disease.
Lancet 2009, 373:1550-1561
4 Socié G, Blazar BR. Acute graft-versus-host
disease: from the bench to the bedside.
Blood 2009, 114:4327-4336
274
TRIBUNA MEDICA TICINESE
76 GIUGNO 2011












