Cellule staminali mesenchimali da cordone ombelicale, i possibili utilizzi
La popolazione di cellule staminali del cordone ombelicale consta di diversi sottotipi cellulari: (i)
cellule staminali cordonali simil-embrionali, capaci di differenziare verso tessuti endodermici (ad
esempio polmone), mesodermici (come il cuore) ed ectodermici (ad esempio il sistema nervoso);
(ii) cellule staminali cordonali mesenchimali, in grado di originare tessuto cartilagineo, adiposo,
osseo, cellule nervose e mesoderma viscerale; (iii) cellule staminali cordonali ematopoietiche,
capaci di specializzarsi in cellule del midollo osseo e del sangue; (iv) cellule staminali cordonali
endoteliali, in grado di formare vasi sanguigni (1). Le cellule staminali mesenchimali (CB-MSCs)
sono cellule multipotenti a struttura fibroblastoide dotate di una elevata capacità di autorinnovarsi
con un alto potenziale di proliferazione e di differenziazione. In vitro possono essere sottoposte a
numerosi cicli replicativi e sono in grado sia di originare colonie CFU-F sia di aderire alle superfici
plastiche (2). La caratterizzazione dell’immunofenotipo delle CB-MSCs ha permesso di
identificarne (i) la positività verso markers superficiali quali: CD105, CD73, CD106, CD54, CD44,
CD90, CD29, STRO-1e (ii) la negatività per i markers CD14, CD34, CD45. In aggiunta le CBMSCs esprimono importanti molecole e fattori di trascrizione quali SMA vimentin, nestin, desmin,
Ki-67, Oct-4, NANOG, SSEA-4 (3). In modelli preclinici, è stata valutata la capacità delle CBMSCs di dare origine a cellule producenti insulina (IPCs). Uno studio condotto da Gao et al., ha
dimostrato che CB-MSCs, quando coltivate in un medium contenente alte concentrazioni di
glucosio, nicotinamide, acido retinoico, exendina-4 e fattore di crescita epidermico, differenziano
verso IPCs in grado sia di esprimere markers tipicamente pancreatici (come PDX-1, Pax- 4, Glut-2
and Ngn-3), sia di produrre de novo insulina (4). IPCs derivanti da CB-MSCs trapiantate sotto la
capsula renale in un modello murino, hanno dato luogo ad un aumento dei livelli serici di insulina,
senza tuttavia migliorare il controllo glicometabolico (5). La capacità delle CB-MSCs di
differenziare in tessuto osseo è stata indagata in un studi sperimentali al fine di sviluppare nuovi
protocolli terapeutici in ambito ortopedico. Infine l’attività immunomodulatoria esercitata dalle CBMSCs rappresenta un potenziale strumento nel controllo della “malattia del trapianto contro
l’ospite” (GVHD) (6). Per questo motivo la capacità delle CB-MSCs di prevenire e trattare la
GVHD è stata studiata in topi NOD/SCID i quali, dopo essere stati sottoposti ad infusione di cellule
mononucleate umane da sangue periferico, hanno esibito segni di GVHD, come ad esempio una
massiccia presenza di linfociti T umani nei linfonodi, nel fegato e nei polmoni (7). La
somministrazione multipla e sistemica di CB-MSCs nei topi NOD/SCID ha ridotto
significativamente la proliferazione delle cellule T umane ed il danno ai tessuti, migliorando, di
conseguenza, il tasso di sopravvivenza degli animali trattati. Al contrario, nessun effetto terapeutico
è stato rilevato a seguito di infusione di CB-MSCs alla comparsa di GVHD. Ne consegue quindi
che l’utilizzo clinico di CB-MSCS rappresenta quindi un trattamento profilattico nella prevenzione
della GVHD (7).
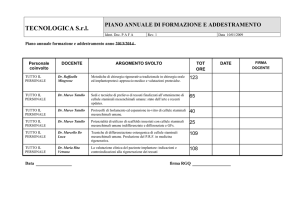
Per quanto riguarda le applicazioni cliniche delle CB-MSCs, attualmente sono in corso diversi trials
nei quali tali cellule vengono proposte come possibile strumento di cura nell’ambito di patologie di
diversa origine. Tali trials sono riassunti nella seguente tabella (Tabella 1).
Patologie
Cardiache
Cardiomiopatia dilatativa
Pneumologiche
Displasia broncopolmonare
Ematologiche
Clinicaltrials.gov Identifier
Nct01219452
Nct01297205
http://www.conservazionecellulestaminali.it/
Forme leucemiche
Sindromi mielodisplastiche
Anemia aplastica severa
Neurologiche
Morbo di Alzheimer
Dermatologiche
Epidermolisi bollosa
Ossee
Osteoartriti
Immunomediate
Diabete di tipo 1
Gvhd
Vascolari
Piede diabetico/ischemia critica agli arti inferiori
Nct00498316
Nct00498316
Nct01182662
NCT01297218
Nct01033552
Nct01041001
Nct01219465
Nct00823316
Nct01216865
Tabella 1. Attuali applicazioni cliniche delle CB-MSCs.
Infine è importante menzionare che attualmente sono in corso diversi trials clinici in cui viene
proposto l’utilizzo di Prochymal®, (una formulazione commerciale, prodotta da Osiris, composta
da cellule mesenchimali midollari raccolte da donatori volontari sani), nella cura del morbo di
Chron, patologie polmonari (ad esempio bronchite cronica) ed infarto miocardico. In virtù della
similarità nella capacità differenziativa che intercorre tra staminali mesenchimali midollari e
midollari, ma anche delle migliori capacità immunomodulatorie ed immunosoppressive (6)
(affiancate dalla concomitante presenza nel sangue cordonale di cellule T regolatorie) delle CBMSCs, risulta essere plausibile l’applicazione delle CB-MSCs stesse laddove è stato utilizzato
Prochymal®.
Bibliografia
1. Francese R, Fiorina P: Immunological and regenerative properties of cord blood stem cells.
Clinical Immunology In Press, Corrected Proof, 2010
2. Francese R, Fiorina P: Immunological and regenerative properties of cord blood stem cells. Clin
Immunol 136:309-322, 2010
3. Jurga M, Lipkowski AW, Lukomska B, Buzanska L, Kurzepa K, Sobanski T, Habich A, Coecke
S, Gajkowska B, Domanska-Janik K: Generation of Functional Neural Artificial Tissue from
Human Umbilical Cord Blood Stem Cells. Tissue Eng Part A, 2009
4. Gao F, Wu DQ, Hu YH, Jin GX, Li GD, Sun TW, Li FJ: In vitro cultivation of islet-like cell
clusters from human umbilical cord blood-derived mesenchymal stem cells. Transl Res 151:293302, 2008
5. Hu YH, Wu DQ, Gao F, Li GD, Yao L, Zhang XC: A secretory function of human insulinproducing cells in vivo. Hepatobiliary Pancreat Dis Int 8:255-260, 2009
6. Kim YJ, Broxmeyer HE: Immune regulatory cells in umbilical cord blood and their potential
roles in transplantation tolerance. Crit Rev Oncol Hematol
7. Tisato V, Naresh K, Girdlestone J, Navarrete C, Dazzi F: Mesenchymal stem cells of cord blood
origin are effective at preventing but not treating graft-versus-host disease. Leukemia 21:1992-1999,
http://www.conservazionecellulestaminali.it/
2007
http://www.conservazionecellulestaminali.it/