
A.D.M.O. - Associazione Donatori Midollo Osseo - Donare per far vivere.....
Profilassi della GVHD
La GVHD è un fenomeno molto complesso che consiste essenzialmente in una aggressione di uno o più tessuti del
paziente sottoposto a trapianto allogenico di midollo osseo (o di CSE da altra fonte) da parte delle cellule
immunocompetenti contenute nella sospensione cellulare che si trapianta.
Diversi fattori riguardanti il paziente e il donatore possono influire, interagendo tra loro, sull’insorgenza e la
gravità della GVHD. I fattori principali sono:
a) Il grado di soppressione del sistema immunitario del paziente. Una immuno-soppressione pre-trapianto insufficiente
impedisce la GVHD e favorisce il rigetto;
b) Il grado di immunocompetenza della sospensione cellulare trapiantata. La presenza in questa di linfociti T maturi del
tipo CD4+ CD25- e CD8+ CD25- e di cellule APC (Cellule dendritiche o DC, macrofagi e linfociti B), deputate alla
presentazione degli antigeni estranei ai propri linfociti T, il loro numero e la loro capacità di essere attivati, è essenziale
per la comparsa di GVHD. Una T deplezione parziale del midollo osseo, prima di un trapianto allogenico, riduce il rischio
di GVHD. Una T deplezione profonda lo annulla, ma crea un rischio elevato di rigetto. Il trapianto di SCO ha un rischio
minore di GVHD in rapporto al minore grado di maturazione dei linfociti T e delle cellule APC.
c) Il grado di compatibilità HLA tra donatore e ricevente. In un trapianto allogenico, con profonda immunosoppressione del
paziente e senza T deplezione della sospensione di midollo osseo, la frequenza e la gravità della GVHD sono
significativamente maggiori se il donatore è HLA incompatibile, specialmente quando l’incompatibilità riguarda le
molecole HLA-DR e DQ.
Tuttavia, in assenza di un’adeguata profilassi, la GVHD è molto frequente anche nei trapianti allogenici HLA
identici. Questo è spesso dovuto a incompatibilità per antigeni differenti da HLA, denominati antigeni minori di
istocompatibilità o mHA. guarda l'immagine nelle sue dimensioni reali guarda l'immagine nelle sue dimensioni reali
Esistono due forme diverse di GVHD, una acuta e una cronica. La prima compare entro i primi 100 giorni dal trapianto
(mediamente dopo 18-20 giorni) ed ha un’incidenza molto variabile, a seconda dei fattori in gioco, che viene
complessivamente stimata tra il 30% e l’80%. Nei casi di importante disparità HLA tra donatore e ricevente o se
non viene instaurata alcuna terapia immunosoppressiva, la GVHD può svilupparsi pochi giorni dopo l’infusione del
midollo, è quasi costante e spesso molto grave. Si parla in questi casi di GVHD iperacuta. I sintomi più caratteristici della
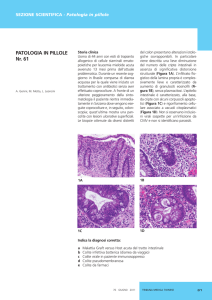
GVHD acuta sono rappresentati dalla triade rash cutaneo, diarrea e ittero da stasi. (vedi tabelle 9a e 9b). La seconda
compare di solito dopo i primi 100 giorni dal trapianto (mediamente dopo 110-120 giorni). Può far seguito alla GVHD acuta
o insorgere ex novo. Può interessare le stesse sedi della GVHD acuta, ma in genere la sua estensione è maggiore,
coinvolge molti organi ed apparati (cute, mucosa orale o esofagea, congiuntive, fegato e polmoni), e può assumere i
caratteri della sclerodermia, della cirrosi biliare o della bronchiolite obliterante (vedi Tab. 10).
Può essere limitata (cute +/- fegato) o estesa (cute generalizzata +/- compromissione multipla di organi). La sua frequenza
globale è stimata al 30-40%. Entrambe le forme di GVHD sono spesso di grado lieve o moderato, ma talvolta grave e
mortale. Aumentano molto la suscettibilità del paziente a complicanze infettive. E’ ‘indispensabile attuare
precocemente e per un lungo periodo dopo il trapianto (fino a 9-12 mesi) un’efficace profilassi della GVHD,
utilizzando farmaci immunosoppressivi come Metotrexate, Corti- costeroidi e soprattutto la Ciclosporina A. Altri più
potenti agenti immunosoppressivi, come il Tacrolimus, il Mycofenolato Mofetil e la Rapamicina sono impiegati nella
profilassi della GVHD, ma soprattutto nel trattamento della GVHD sia acuta che cronica.
Una procedura che può ridurre significativamente il rischio di GVHD è rappresentata dalla T-deplezione della sospensione
di CSE da trapiantare. Questa può essere realizzata con vari metodi, sia fisici (sedimentazione dei linfociti T dopo
fissazione su emazia di pecora, o rosettazione; fissazione su microsfere magnetiche ricoperte da anticorpi monoclonali
anti-T specifici); che farmacologici (incubazione con farmaci citotossici), o biologici (incubazione con anticorpi
monoclonali anti-CD52, come CAMPATH-1H).
Naturalmente, bisogna tener presente che con la T-deplezione aumenta il rischio di rigetto e, nel caso delle malattie
oncoematologiche, aumenta il rischio di recidiva.
Altre procedure di prevenzione della GVHD consistono nella somministrazione di ATG (Globulina anti-T) nei 2-3 giorni
che precedono il trapianto e/o subito dopo il trapianto. Risultati positivi sono stati ottenuti negli ultimi anni con
l’infusione di quantità molto elevate di CSE nel trapianto, e, del tutto recentemente, con l’aggiunta alla
sospensione di CSE di piccole quantità di CSM o di cellule T regolatorie (TCD4+ CD25+) dello stesso donatore.guarda
l'immagine nelle sue dimensioni reali
http://www.admosardegna.it
Realizzata con Joomla!
Generata: 10 June, 2017, 16:27



![Recensendo [cd]: "Calibrated thickness" di Uri Caine](http://s1.studylibit.com/store/data/003842205_1-7e3c5e4d085992dd2d8b768378f0a85c-300x300.png)


![Recensendo [cd]: "Mattoni" di Andrea](http://s1.studylibit.com/store/data/007525618_1-1525635c43b9484bf53d73b8a7da6ea3-300x300.png)




