Il Trapianto di Midollo Osseo
nell’Anemia di Fanconi
AORN SANTOBONO PAUSILIPON
SSD TRAPIANTO MIDOLLO OSSEO
Dott. Mimmo Ripaldi
L’Anemia di Fanconi è una rara malattia
genetica non legata al sesso che si esprime
nel corso della vita con alterazioni
strutturali (malformazioni) e con una
insufficienza midollare a volte grave che
può portare a morte il paziente. E’
presente una predisposizione a sviluppare
leucemie e tumori a cellule squamose
Il trapianto di cellule staminali è in grado di
curare le alterazioni ematologiche
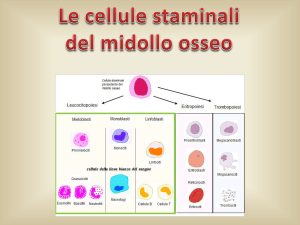
Cellule staminali
Cosa sono le cellule staminali?
Sono cellule capaci di dare origine a tutti i tipi di
cellule
Le cellule staminali si dividono in
in :
Totipotenti: possono generare tutti i tessuti di un
individuo e gli annessi embrionali. Sono considerati
tali solo gli stadi precoci dell'embrione.
Pluripotenti: cellule in grado di dare luogo a
tutti i tessuti di un individuo ma non agli annessi
embrionali. Sono pluripotenti le cellule della
massa interna della blastocisti, rivestita dal
trofoblasto, dette anche cellule staminali
embrionali.
Multipotenti: cellule
maggiormente
differenziate rispetto
alle precedenti, sono
in grado di dare luogo
a tutti i tipi cellulari del
tessuto
di
appartenenza.
Vengono considerate
multipotenti le cellule
staminali dell’adulto,
come
le
cellule
ematopoietiche e le
mesenchimali.
Cellule staminali ematopoietiche
Sangue cordonale e placentare
Sono cellule staminali adulte, multipotenti di
due tipi: ematopoietiche e mesenchimali.
Vengono prelevate dal cordone ombelicale
dopo il parto.
Si conservano in banche anche per decenni a
disposizione dei pazienti ematologici che ne
necessitano il trapianto.
HLA classe I
Espresso su tutte le cellule nucleate e
sulle piastrine
1 catena alfa
3 loci (A, B, C)
Elevato polimorfismo (in tutto centinaia di
alleli)
Espressione di 2 molecole (origine
materna e paterna) per ogni locus
6 molecole diverse di classe I su ciascuna
cellula
HLA classe II
Espresso sulle cellule presentanti
l’antigene (monociti, macrofagi,cellule
dendritiche, linfociti B, linfociti T attivati)
1 catena alfa e una catena beta
3 famiglie (DR, DQ, DP)
3 geni principali per DR (1 alfa 2 beta);
2 geni per DQ ( 1 alfa 1 beta);
2 geni per DP (1 alfa 1 beta).
A livello di eterodimero, tenendo conto
delle 2 copie (materna e paterna) di geni,
si possono avere fino a:
8 combinazioni per DR
4 combinazioni per DQ
4 combinazioni per DP
(di fatto le combinazioni sono meno della
metà. Raro l’appaiamento in trans)
Il trapianto
• Dal midollo osseo e dal sangue le staminali possono
essere selezionate ed estratte. Successivamente le
cellule selezionate possono essere trasfuse direttamente
ai pazienti per rigenerare il midollo osseo
• Le cellule staminali possono essere estratte anche dal
sangue cordonale
• Quando le cellule staminali provengono da un donatore,
il trapianto si definisce allogenico.
Trapianto di cellule staminali
emopoietiche
Sorgente di cellule
Sangue periferico:
Midollo osseo:
Vantaggi/svantaggi
rapida e duratura ricostituzione emopoietica
alto rischio di GVHd cronica
alta esperienza
alta % attecchimento
alta restrizione HLA
alto rischio di GVHD e CMV
Sangue di cordone
bassa restrizione HLA
ombelicale:
minore GVHD e CMV
rapidamente disponibile
minore n° cellule disponibili
minore % attecchimento
no disponibilità donatore
Fasi del trapianto
(1)
-
Condizionamento (=> immunosoppressione; tossicità farmaci)
Eliminare le cellule malate
Produrre immunosoppressione sufficiente a consentire attecchimento
Creare spazio fisico per consentire la colonizzazione midollare da aprte delle
nuove staminali
(2) Infusione delle cellule staminali (=> anafilassi; rigetto; GVHD)
Eventualmente preceduta da manipolazione in vitro.
(3) Fase neutropenica (=> infezioni)
2-4 setimane immunodeficienza assoluta!
(4) Attecchimento (=> terapie per controllare GVHD)
Settimane – mesi
(5) Fase post-attecchimento
- Mesi - anni
COMPLICAZIONI E MORTALITA’ LEGATA AL TRAPIANTO
- Non attecchimento
- Graft Versus Host Disease
- Ricorrenza della malignità
- infezioni gravi legate all’immunosoppressione
- CMV
- EBV e linfoma EBV
- Aspergillosi invasiva
Compatibilità del trapianto
Maggiore - Maggior attecchimento
- Minore GVHD
Minore
- Minore attecchimento
(o attecchimento a spese di maggiore
immunosoppressione e maggior rischio infettivo)
- Maggiore Graft Versus Leukemia (GVL)
GVH Acuta
> + 4 < 100 gg
Dermatite – enterite - epatite
febbre, rash maculopapulare (confluente, pruriginoso, doloroso, componente
infiammatoria spiccata),
Diarrea acquosa (nell GVH cronica è enteropatia con wasting)
Eosinofilia e linfocitosi
Epatosplenomegalia
Dermatite esfoliativa
Enteropatia con perdita di proteine
Aplasia midollare
Aumentata suscettibilità a infezioni
Decesso
Biopsia cutanea: degenerazione basale vacuolare, necrosi, eosinofili, infiltrato
perivascolare del derma
Conditioning regimen
CY-based
CY alone 6 (9%)
CY + irradiation ± other 22 (34%)
CY + thiotepa 2 (3%)
Fludarabine based
Fludarabine +CY 25 (40%)
Other regimens 9 (14%)
Serotherapy (ATG) 40 (62%)
• Matched sibling donor
Irradiatiation
No Irradiation
• Matched Unrelated donor
The FLU „ERA“
Irradiation
No Irradiation
ESPERIENZA ITALIANA NELL’ANEMIA DI FANCONI
Number of patients 64 (100%)
Males 39 (61%)
Females 25 (39%)
•Median age at diagnosis and range (years) 6 (1–13)
•Median age at HSCT and range (years) 9 (2–20)
Type of donor employed
•Matched family donor 31 (48%)
•Matched unrelated donor 26 (41%)
•HLA-partially matched family donor 7 (11%)
Number of cells infused
•Bone marrow recipients (nucleated cells×108/kg) 4.5 (0.9–13.7)
•Cord blood recipients (nucleated cells×107/kg) 3.1 (2.5–9.1)
•Peripheral blood recipients (CD34+ cells×106/kg ) 15.1 (9-30)
Il sangue da cordone ombelicale è
stato utilizzato per la prima volta in un
caso di anemia di Fanconi, a Parigi
(Gluckman e altri – 1989), utilizzando
un cordone prelevato a New York dal
fratello del paziente.
Unrelated CBT in Children-Non Malignant Disease
3-year Overall Survival for patients with Fanconi Anemia by cell dose (n=93)
HLA-haploidentical stem cell transplantation after removal of αβ+ T
and B-cells in children with non-malignant disorders.
Bertaina A A1, Merli P2, Rutella S3, Pagliara D2, Bernardo ME2, Masetti
R4, Pende D5, Falco M6, Handgretinger R7, Moretta F2, Lucarelli B2, Brescia
LP2, Li Pira G2, Testi M8, Cancrini C9, Kabbara N10, Carsetti R2, Finocchi
A9, Moretta A11, Moretta L6, Locatelli F2.
Blood Journal 2014
Caratteristiche dei pazienti
23 bambini
15 maschi
4 Anemia di Fanconi
8 SCID
4 SAA
7 Altre malattie genetiche
8 femmine
Condizionamento utilizzato
Busulfano Tiotepa Fludara
Treosulfan Tiotepa Fludara
Fludra ciclofosfamide singola dose TBI
Cellule infuse
CD 34x10.6/kg
15.8 (10.2-40.0)
RISULTATI
Ripresa dei neutrofili 13 giorni (10-20)
Ripresa delle piastrine 10 giorni (7-40)
Mancato attecchimento 20%
SPAGNA-Ricercatori del Centro de Investigaciones Energéticas,
Medioambientales y Tecnológicas (CIEMAT) e del Centro de
Investigación Biomédica en Red de Enfermedades Raras
(CIBERER) hanno sviluppato un nuovo trattamento per malati di
anemia di Fanconi di tipo A.
Il nuovo trattamento e’ indirizzato a quei malati che non hanno un
donatore compatibile, per cui hanno scarse alternative terapeutiche.
In concreto si corregge il difetto genetico nelle cellule staminali
ematopoietiche del paziente in modo analogo a come si procede con altri
pazienti
con
altre
malattie
monogenetiche,
come
alcune
immunodeficienze primarie. Il vettore sviluppato appartiene alla famiglia
dei lentivirus, con maggiore efficacia e sicurezza rispetto ai vettori usati
nei primi protocolli di terapia genetica.
Una volta corretto il difetto genetico delle cellule staminali
ematopoietiche, le stesse saranno immesse nel paziente si da riscattare
e/o prevenire il difetto del midollo osseo.
Il lavoro e’ stato coordinato dal dr Juan Berner.
GRAZIE PER L’ATTENZIONE
E…………….
PER LA PAZIENZA !!!!!!!
GRAZIE AIRFA !!!!!!!!!!!!!!!