La Struttura degli atomi
ChimicaGenerale_lezione5
1
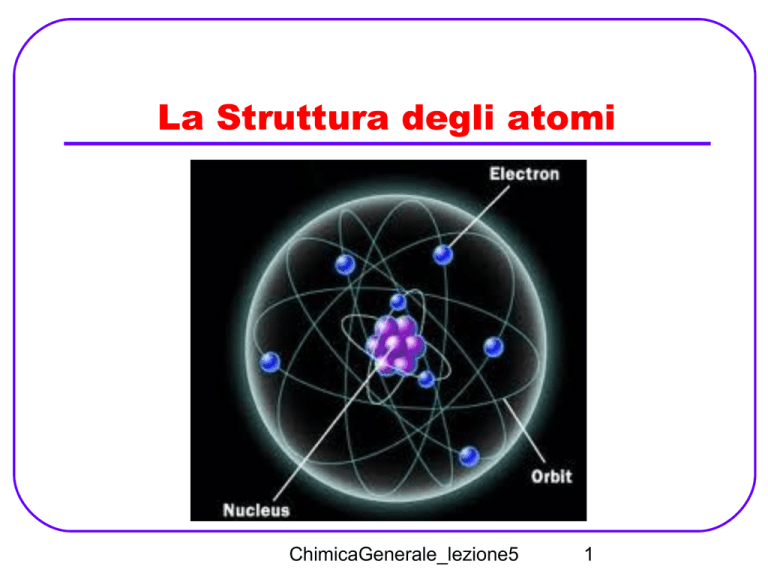
Modello atomico
di Thomson
Massa e carica dell'atomo sono distribuiti
in modo uniforme nell'atomo
La repulsione reciproca tiene gli elettroni
lontani, separati, in modo uniforme
ChimicaGenerale_lezione5
2
Ernest Rutherford
Nobel per la chimica 1908
Nel 1910 Rutherford propone un modello
di atomo in cui quasi tutta la massa
dell'atomo è concentrata in una porzione
molto piccola (il nucleo, estremamente
denso e carico positivamente) circondato
da cariche negative (gli elettroni).
ChimicaGenerale_lezione5
3
Esperimento di Rutherford
Esperimento di diffrazione di particelle alfa
da parte di sottili fogli d'oro
Ci si aspettava, da modello Thomson, una piccola
deflessione, considerando carica e massa distribuite
in modo uniforme. Invece si osservano particelle alfa
diffratte ad elevati angoli, alcune “tornano indietro”!
Perchè?
ChimicaGenerale_lezione5
4
Una particella alfa
che urti frontalmente
un nucleo, rimbalza indietro
come una palla quando
colpisce un sasso.
La particella, ad una certa distanza dal nucleo si ferma e
inverte la direzione del moto.
Un’altra particella si avvicina al nucleo e viene respinta
lungo una traiettoria con un certo angolo di deviazione
dalla sua traiettoria iniziale.
ChimicaGenerale_lezione5
5
modello
Per spiegare il fatto che
Comunque la maggior parte
delle particelle passava indisturbata,
si suppose che la maggior parte dell’atomo fosse
sostanzialmente vuota.
Inoltre, per spiegare i grandi angoli di deviazione soltanto
con l’intervento della forza di Coulomb, ipotizzò l’atomo
come costituito da un nucleo centrale carico
positivamente e da uno o più elettroni che gli ruotano
intorno, come pianeti intorno al sole.
ChimicaGenerale_lezione5
6
ChimicaGenerale_lezione5
7
Atomi stabili ma
impossibili
Il modello di Rutherford fu verificato da vari esperimenti,
ma non poteva essere spiegato dalla fisica classica
Cosa mantiene lontane cariche + e -?
Se gli elettroni sono stazionari l'attrazione li avrebbe fatti
collassare sul nucleo
Se gli elettroni sono in movimento intorno al nucleo dovrebbe
comportarsi come un dipolo oscillante e dissipare energia:
l'elettrone, nel suo moto intorno al nucleo positivo, è
sottoposto a un'accelerazione, e irraggia energia
elettromagnetica della stessa frequenza del suo moto di
rivoluzione, finendo per cadere sul nucleo con moto a spirale
ChimicaGenerale_lezione5
8
Problemi della fisica classica
agli inizi del 1900
Modello rutherford
La catastrofe dell'ultravioletto
L'effetto fotoelettrico
ChimicaGenerale_lezione5
9
La catastrofe dell'ultravioletto
Si tenta di spiegare la relazione tra intensità (I)
e lunghezza d'onda (λ) della radiazione emessa
da un corpo incandescente(radiazione del
corpo nero)
Le teorie classiche prevedevano che I
aumentasse al diminuire di λ, invece
sperimetalmente si osservava per I un massimo
e poi una diminuzione al diminuire di λ:
CATASTROFE DELL'ULTRAVIOLETTO
ChimicaGenerale_lezione5
10
λ∝1/ν
ChimicaGenerale_lezione5
11
Planck
gli atomi (oscillatori) dell'oggetto incandescente
originano, vibrando, la radiazione elettromagnetica
emessa
Ciascun oscillatore ha una frequenza fondamentale
di oscillazione
La radiazione emessa può avere solo valori discreti
di energia
E=nhν
[E]=[js][1/s]
dove n è intero positivo e h= 6,6260693 x 10 -34js
ChimicaGenerale_lezione5
12
QUANTIZZAZIONE DELL'ENERGIA!
Se un oscillatore passa da un energia alta
a una più bassa si ha emissione di una
radiazione elettromagnetica e la differenza
di energia tra i 2 stati energetici è
∆E = Emagg n- Emin n= ∆n hν
ChimicaGenerale_lezione5
13
Soluzione della catastrofe
in un corpo c'è una distribuzione di vibrazioni di
atomi
pochi atomi con vibrazioni ad alta o bassa
frequenza sono responsabili di una piccola parte
della luce, mentre la maggior parte è dovuta a quelli
che hanno frequenza di vibrazione intermedia
Perciò abbiamo un massimo di
intensità ad una certa λ!
ChimicaGenerale_lezione5
14
Effetto fotoelettrico
L'effetto fotoelettrico rappresenta
l'emissione di elettroni da una
superficie, solitamente metallica,
quando questa viene colpita da una
radiazione elettromagnetica ad alta
frequenza.
ChimicaGenerale_lezione5
15
Se la frequenza è:
troppo bassa non si ha emissione di
elettroni
è uguale o superiore ad un minimo
(frequenza critica) gli elettroni emessi
aumentano all'aumentare dell'intensità
luminosa
ChimicaGenerale_lezione5
16
ChimicaGenerale_lezione5
17
Einstain
Parte dall'idea di Planck di energia
quantizzata e la coniuga alla nuova idea
di proprietà corpuscolare della luce
Nasce l'idea di FOTONE!
Fotone: particella elementare, quanto della radiazione
elettromagnetica e mediatore dell'interazione
elettromagnetica; ha massa a riposo nulla e permette l'azione
dell'interazione elettromagnetica a grande distanza.
ChimicaGenerale_lezione5
18
Ε=hν=hc/λ
Qual'è l'energia di 1 mole di fotoni di luce rossa?
Convertiamo la lunghezza d'onda della luce in
frequenza
Luce rossa: λ=685nm ν=4.38x 1014 1/s
Moltiplico la frequenza per h e ottengo l'energia di
1 fotone
Fotone luce rossa: E=2.90 x 10-19 j/fotone
Se moltiplico per n°Avocadro ottengo l'energia di 1
mole
1 mole fot. luce rossa: E=1.75 x 105 j/mol
ChimicaGenerale_lezione5
19
Niels H. D. Bohr
Nobel per la fisica 1922
In base alle teorie di Rutherford, Bohr pubblicò il suo
modello della struttura atomica, introducendo la teoria
degli elettroni che viaggiano in orbite ben definite, che
corrispondono ai diversi stadi di energia intorno al nucleo
dell'atomo.
Inoltre introdusse l'idea che un elettrone può cadere da
un'orbita di alta energia a una con energia più bassa,
emettendo un fotone di energia definita.
Questa teoria fu la base della teoria dei quanti.
ChimicaGenerale_lezione5
20
Spettro di emissione a righe
Gli atomi di un elemento, in fase
gassosa e a bassa pressione, se
sottoposti a un intenso campo elettrico,
assorbono energia (sono eccitati)
Gli atomi eccitati perdono energia
emettendo luce nel visibile, ma solo di
poche e specifiche λ
Questo èlo spettro di emissione a righe
ChimicaGenerale_lezione5
21
ChimicaGenerale_lezione5
22
Perchè gli atomi emettono luce
solo a certe frequenze?
L'approccio dei fisici fu di correlare i dati
sperimentali con un'equazione matematica
L'equazione di Rydberg consentì di calcolare la
λ delle righe rossa verde azzurra e blu dello
spettro di emissione nel visibile per H
(1/λ) = R [(1/22)-(1/n2)] per n>2
Dove n è un numero intero e
R= 1.0974 x 107 m-1 costante di Rydberg
ChimicaGenerale_lezione5
23
Serie di Balmer
Dall'equazione di Rydberg,
Per n=3 ottengo λ della
riga rossa (656.3 nm)
Per n=4 ottengo λ della
riga verde
Per n=5 ottengo λ della
riga azzurra
Per n=6 ottengo λ della
riga blu
ChimicaGenerale_lezione5
24
Modello di Bohr
applica all'atomo di Rutherford la
quantizzazione dell'energia introdotta
da Planck
Bohr risolve le difficoltà teoriche del
modello di Rutherford sfruttando
tre postulati
ChimicaGenerale_lezione5
25
I e II Postulato di Bohr
I) un elettrone può muoversi soltanto su alcune
determinate orbite non-radiative, dette stati stazionari.
II)L'atomo irraggia energia solamente quando, per un
qualche motivo, un elettrone effettua una transizione da
uno stato stazionario ad un altro. La frequenza della
radiazione è legata all'energia del livello di partenza e di
quello di arrivo dalla relazione:
ν=(Ei-Ef)/h
dove h è la costante di Planck, mentre Ei ed Ef sono le
energie dell'orbita iniziale e finale
ChimicaGenerale_lezione5
26
III postulato d Bohr
III) I raggi delle orbite stabili dovevano essere
proporzionali ai quadrati di numeri interi
(quantizza il momento della quantità di moto
della particella).
ChimicaGenerale_lezione5
27
Energia potenziale dell'eletrone
all'n-esimo livello
En= - Rhc/n
2
Il numero quantico principale n definisce
l'energia degli orbitali permessi per H
L'elettrone ha energia negativa (ovvero energia
di attrazione elettr-nucleo)
Atomo con elettroni negli statii energetici più
bassi si trova nello stato fondamentale
ChimicaGenerale_lezione5
28
Raggio dell'orbita
n è numero quantico principale
ħ:è la costante di Planck
razionalizzata, cioè divisa per 2π
m: massa
K costante di Coulomb
Z carica nucleo
ecarica elettrone
è il raggio di Bohr del livello
fondamentale dell'atomo H.
ChimicaGenerale_lezione5
29
Bohr dimostra che:
2
R∝ n
All'aumentare di n la distanza
dell'elettrone dal nucleo aumenta
E ∝ -1/n2
All'aumentare di n l'energia aumenta
(diventa meno negativa, gli elettroni
sono meno “legati” al nucleo)
ChimicaGenerale_lezione5
30
Ancora sulle righe degli spettri
di emissione di H
La teoria di Bohr afferma che gli elettroni solo
su specifiche orbite con una determinata
energia
Se un elettrone si sposta da uno stato
energetico iniziale ad un'altro stato finale
deve essere emessa (se Ei>Ef) o assorbita
(se Ei<Ef)
∆E= Estato finale-Estato iniziale= (-NARhc) (1/n2f-1/n2i)
ChimicaGenerale_lezione5
31
Ancora sulle righe degli spettri
di emissione di H
Viene somministrata energia agli atomi gassosi
(scarica elettrica o riscaldamento)
A seconda dell'energia somministrata alcuni elettroni
passano dallo stato energetico fondamentale (n=1) a
un livello eccitato(n= 2,3,4,5)
Quando gli elettroni tornano allo stato fondamentale
rilasciano energia come fotoni di radiazioni
elettromagnetiche di specifiche λ
Da qui le righe per lo spettro di emissione e non solo
nella zona del visibile (dipende da energia fornita)
ChimicaGenerale_lezione5
32
Emissione nell' IR
Emissione in UV
ChimicaGenerale_lezione5
33
ChimicaGenerale_lezione5
34
Limiti del modello di Bohr
Spiega spettro di idrogeno
Spiega solo spettro di sistemi ad 1
solo elettrone (He+)
ChimicaGenerale_lezione5
35
Preludio alla meccanica
quantistica
De Broglie propone che l'elettrone abbia una
doppia natura, corpuscolare e ondulatoria
Associa ad un elettrone di massa m che si
muove con velocità v una lunghezza d'onda
λ= h/mv
In realtà ad ogni particella in movimento è
possibile associare una λ, ma perchè sia
misurabile mv deve avere un valore molto
piccolo (ovvero massa piccola)
ChimicaGenerale_lezione5
36
Heisenberg
Principio di indeterminazione (1927)
“La misura simultanea di due variabili coniugate,
come posizione e quantità di moto oppure
energia e tempo, non può essere compiuta
senza un'incertezza ineliminabile.”
In altre parole per un oggetto estremamnte
piccolo, come l'elettrone, è impossibile
determinare con accuratezza, nello stesso
tempo, sia l'energia che la posizione.
ChimicaGenerale_lezione5
37
Max Born
“se si decide di conoscere l'energia di un
atomo con una piccola incertezza, allora si
deve accettare un'incertezza elevata circa la
sua posizione nello spazio”
Formulò nel 1920 l'interpretazione oggigiorno
standard della densità di probabilità per ψ2
nell'Equazione di Schrödinger della
meccanica quantistica, per la quale si
aggiudicò il Premio Nobel per la fisica, circa
tre decenni dopo (1954).
ChimicaGenerale_lezione5
38
E. Schrödinger
(premio Nobel 1934)
Partendo dall'ipotesi di de Broglie
Schrodinger sviluppa un
modello(meccanica ondulatoria) che si
basa sull'uso di equazioni matematiche
in grado di descrivere onde
Si ottengono una seri di equazioni
d'onda o funzioni d'onda indicate con ψ
ChimicaGenerale_lezione5
39
Equazione di Schrödinger
Ψ è la funzione d'onda, che è l'ampiezza di probabilità per
differenti configurazioni del sistema.
ħ è la costante di Planck razionalizzata, cioè divisa per 2π,
che può essere posta uguale a 1.
Ĥ è l'operatore hamiltoniano
ChimicaGenerale_lezione5
40
Riguardo le funzioni d'onda:
Descriviamo un elettrone in un atomo come un onda stazionaria
Per le onde stazionarie le vibrazioni sono quantizzate e l'intero
n viene detto numero quantico
Ogni funzione d'onda è associata ad un certo valore di energia
Il valore della funzione d'onda in un certo punto dello spazio è
dato dall'ampiezza dell'onda(altezza)
La funzione d'onda possiede un segno (+ -) e un modulo
Il quadrato della funzione d'onda ψ2 è correlato con la
probabilità di trovare l'elettrone in una data zona dello spazio
(densità di probabilità)
ChimicaGenerale_lezione5
41
Orbitale
L'eq.di Schrodinger definisce con precisione
l'energia di un elettrone
per il principio di indeterminazione abbiamo una
incertezza sulla posizione
Per questo è possibile indicare solo una probabilità
che l'elettrone si trovi in una data regione dello
spazio quando è in un dato stato energetico
La regione dello spazio in cui si ha massima
probabilità di trovare l'elettrone con una certa energia è
detta orbitale
ChimicaGenerale_lezione5
42
ChimicaGenerale_lezione5
43
I numeri quantici
I numeri quantici identificano gli stati
energetici e gli orbitali accessibili ad
un dato elettrone
ChimicaGenerale_lezione5
44












