DANNO
CELLULARE
Reversibile
Irreversibile
Morte
Necrosi
Apoptosi
L’apoptosi viene definita
“morte cellulare
programmata “
o
“ suicido cellulare”
Perché la cellula si “suicida”?
Ci sono due ragioni principali:
Durante lo sviluppo embrionale la morte cellulare è
necessaria quanto la mitosi
• Riassorbimento della coda durante la
metamorfosi del girino in rana
• La formazione delle dita delle mani e dei
piedi
• La
formazione
delle
appropriate
connessioni tra i neuroni durante lo sviluppo
embrionale.
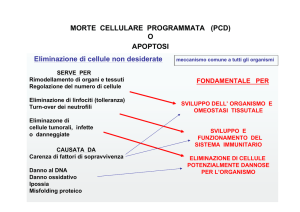
La morte cellulare programmata è necessaria per
distruggere quelle cellule che rappresentano un pericolo
per l’integrità dell’organismo
Per esempio l’eliminazione di:
o Cellule infettate con virus
o Cellule del sistema immunitario
o Cellule con danni al DNA (mutate)
o Cellule tumorali
Cosa spinge le cellule a morire ?
Il bilancio tra:
• Il rilascio di segnali positivi, necessari per la
sopravvivenza (fattori di crescita)
• ricevere segnali negativi quali:
i livelli di ossidanti intracellulari
il danno al DNA da ossidanti o altri agenti
i raggi UV, X, ionizzanti
i chemioterapici
specifiche molecole che si legano a recettori che
trasmettono messaggi di morte (Fas e TNF)
APOPTOSI
embriogenesi
sviluppo fetale
omeostasi tissutale
malattie degenerative
tumori
APOPTOSI
Caratterizzazione
morfologica delle
alterazioni che
accompagnano la
sofferenza cellulare
1800s
Kerr,
Wyllie
e
Currie
definiscono la modalità di
morte alternativa alla necrosi,
definita “apoptosi”, deputata
al controllo dell’omeostasi
tissutale degli organismi
1964-66
1971
Saunders e Lockshin
suggeriscono l’esistenza di
una “morte cellulare
programmata” durante la
metamorfosi degli insetti
Identificati alcuni
geni coinvolti nel
processo apoptotico,
bcl-2, fas e p-53
1980-82
Si osserva la DNA
fragmentation e viene
identificata la caspasi3
1989-91
L’APOPTOSI E’ UNA FORMA DI MORTE CELLULARE CHE
HA LO SCOPO DI ELIMINARE CELLULE NON
DESIDERATE ATTRAVERSO L’ATTIVAZIONE DI UNA
SERIE DI EVENTI COORDINATI E INTERNAMENTE
PROGRAMMATI PORTATI AVANTI DA UN INSIEME
SPECIFICO DI PRODOTTI GENICI.
Modificazioni morfologiche associate al processo apoptotico
Diminuzione delle dimensioni
cellulari con addensamento degli
organelli e mantenimento della
loro integrità
Condensazione della cromatina
e
successiva
degradazione
internucleosomale del DNA in
frammenti multipli di 180 paia di
basi
Formazione di estroflessioni
della membrana citoplasmatica
(blebs) che si distaccano da questa
formando i caratteristici corpi
apoptotici
Processo di fagocitosi dei corpi
apoptotici da parte di macrofagi
A) Apoptosi nel fegato nel corso di epatite; B) nella cute nel corso
di un eritema
A
B
Cellula leucemica vitale (A) e cellula apoptotica (B)
Caratteristiche biochimiche dell’apoptosi
Si tratta di un processo , che richiede espressione di geni
specifici, finemente controllato dalla cellula (oncogeni e
onco-soppressori)
Taglio delle proteine;
Formazione di legami crociati fra le proteine;
Rottura del DNA (a livello internucleosomiale ad opera
di endonucleasi);
Ricognizione fagocitaria (fosfatidilserina).
BASI AZOTATE
adenina
guanina
Basi azotate + pentoso = nucleosidi
Basi azotate + pentoso + fosfato = nucleotidi
I nucleosomi sono le unità ripetitive della cromatina, ciascuna contenente
200 bp di DNA e due molecole di ciascun istone H2A, H2B, H3 e H4
Taglio ad opera di endonucleasi
specifiche
A) Controllo B) DNA laddering apoptosis C) necrosi
Perché la definiamo morte
cellulare programmata?
Caenorabditis elegans
• 1090 cellule somatiche
• 131 vanno in apoptosi
Studi condotti su C. elegans
permisero di suddividere il processo
apoptotico in 3 fasi:
induzione;
esecuzione;
riconoscimento;
fagocitosi.
Studi condotti sul C. elegans hanno permesso di identificare un
gran numero di geni dell’apoptosi, tali geni sono in grado di
dare risposte stereotipate a stimoli diversi, e attualmente sono
così raggruppati:
Recettori di membrana (Fas /APO1/CD95, TNF, TRIAL)
Adattatori (FAAD, APAF1, ced-4)
effettori (caspasi, ced-3, endonucleasi)
Modulatori (Anti-apoptotici come Bcl-2 e ced-9, proapototici
come il Bax)
inibitori (Crma, survivina)
Induttori (p53, c-myc)
Fagocitosi
Come avviene l’apoptosi?
Vie principali del processo apoptotico
CD95L
via estrinseca
mediata dai
recettori di morte
CD95
FADD
Procaspase-8
Danno al DNA
c-FLIP
Bid
P-53
Bcl-xL
Bax
Bcl-2
Caspase-8
via intrinseca
mediata dai
mitocondri
Truncated bid
Procaspase-3
Cytochrome-c
AIF
Apoptosome
Caspase-3
Apaf-1
Procaspase-9
Apoptotic substrates
IAPs
Smac/DIABLO
Vie principali del processo apoptotico
CD95L
CD95
via estrinseca
mediata dai
recettori di morte
FADD
Procaspase-8
Danno al DNA
c-FLIP
Bid
P-53
Bcl-xL
Bax
Bcl-2
Caspase-8
via intrinseca
mediata dai
mitocondri
Truncated bid
Procaspase-3
Cytochrome-c
AIF
Apoptosome
Caspase-3
Apaf-1
Procaspase-9
Apoptotic substrates
IAPs
Smac/DIABLO
Caspasi
Cysteinyl aspartate proteinases
cistein-proteasi che possiedono un sito attivo cisteinico e
operano il taglio proteolitico dei loro substrati specifici a livello
di residui di acido aspartico
sono presenti in tutte le cellule animali in forma inattiva,
come zimogeni inerti, composti da tre domini: un prodominio
N-terminale e due domini p10 e p20
in relazione alla loro funzione e ai tempi di attivazione le
caspasi vengono distinte in due gruppi principali:
Caspasi iniziatrici
Caspasi esecutrici
CASPASI INIZIATRICI
caspasi 8, 9
caspasi esecutrici
CASPASI ESECUTRICI
caspasi 3, 6, 7
• proteine
coinvolte
nella
degradazione del citoscheletro
• endoribonuleasi
responsabili
della frammentazione del DNA
• proteine
deputate
alla
trascrizione,
duplicazione
e
riparazione del DNA
Le caspasi esecutrici, come la caspasi-3,
sono in grado di indurre l’attivazione di
tutti quegli enzimi che sono responsabili
delle modificazioni morfologiche a carico
delle cellule
Durante il processo apoptotico l’azione delle
caspasi è strettamente regolata da due
famiglie di proteine
Inhibitor Apoptosis
Proteins (IAPs)
Proteine della
famiglia del Bcl-2
IAPs
CD95L
Le IAPs svolgono un’azione di tipo
inibitorio sulle caspasi
CD95
Queste vengono indicate come
HIAP1, HIAP2, XIAP, NIAP,
Survivin e Livin.
Tra queste, la XIAP, legandosi alla
caspasi-3, inibisce entrambe le vie
apoptotiche, intrinseca ed estrinseca.
L’azione della proteina XIAP può
essere inibita mediante legame con
la proteina mitocondriale
Smac/DIABLO
FADD
Procaspase-8
Danno al DNA
c-FLIP
Bid
P-53
Bcl-xL
Bax
Bcl-2
Caspase-8
Truncated bid
Procaspase-3
Cytochrome-c
AIF
Apoptosome
Caspase-3
Apaf-1
Procaspase-9
Apoptotic substrates
IAPs
Smac/DIABLO
La famiglia delle proteine del Bcl-2
Le proteine del Bcl-2 si dividono in tre gruppi in base a criteri di omologia di
sequenza e di funzione:
1°gruppo: proteine antiapoptotiche (Bcl-2, Bcl-xL), presentano 4 brevi domini
(BH1, BH2, BH3, BH4) e un dominio c-terminale idrofobico che costituisce il
sito di ancoraggio al mitocondrio
2°gruppo: proteine proapoptotiche (Bax, Bad, Bcl-xs), mancano del dominio
BH4
3°gruppo: proteine con attività proapoptotica (Bid, Bik), conservano inalterata
una sequenza di 12-16 aa del dominio BH3
PROTEINE BCL-2
CD95L
CD95
FADD
Procaspase-8
le proteine Bcl-2 formano
eterodimeri o omodimeri
questi dimeri svolgeranno
un’azione anti o pro-apoptotica,
a seconda che prevalgano le
proteine anti o pro-apoptotiche
Danno al DNA
c-FLIP
Bid
Bcl-xL
P-53
Bax
Bcl-2
Caspase-8
Truncated bid
Procaspase-3
Cytochrome-c
AIF
Apoptosome
Caspase-3
Apaf-1
Procaspase-9
Apoptotic substrates
IAPs
Smac/DIABLO
L’azione delle proteine Bcl-2 è strettamente
correlata all’attività di proteine regolatrici
del ciclo cellulare quali la p53
p53
CD95L
l’attivazione della p53
avviene in seguito alla sua
fosforilazione
in
corrispondenza di un residuo
di serina
la p53 attivata blocca la
progressione
del
ciclo
cellulare nella fase G1
CD95
FADD
Procaspase-8
Danno al DNA
c-FLIP
-
Bid
P-53
Bcl-xL
Bax
Bcl-2
Caspase-8
Truncated bid
c
Procaspase-3
Cytochrome-c
la p53 attivata determina
l’up-regulation di proteine
pro-apoptotiche quali il Bax.
AIF
Apoptosome
Caspase-3
Apaf-1
Procaspase-9
Apoptotic substrates
IAPs
Smac/DIABLO
INDUZIONE DI APOPTOSI
DA PARTE DI MOLECOLE
CHE SI LEGANO A
RECETTORI DI
MEMBRANA
TNF
FasL
Fas
TNFR1
DD
FADD
TRADD
Attivazione sequenziale delle caspasi
APOPTOSI
INDUZIONE DI
APOPTOSI DA PARTE DI
SEGNALI PROVENIENTI
DAI MITOCONDRI
Bcl-2, proteina
codificata
dall’omonimo gene
che appartiene alla
famiglia di geni ANTIAPOPTOTICI
Apaf = fattore attivante le proteasi
dell’apoptosi (=caspasi)
Citocromo C
+
Apaf-1
+ ATP
Pro-caspasi 9
caspasi 9
Stimolo
stressogeno
p53
Variazione del
potenziale di
transizione di
permeabilità
APOPTOSI
___
Proteina codificata
Bax dall’omonimo gene che
appartiene alla famiglia di
geni PRO-APOPTOTICI
IAP = Proteine
Inibenti l’Apoptosi
VIA ESTRINSECA
LIGANDO
VIA INTRINSECA
DANNO
Attivazione recettore di
morte
Attivazione p-53
Legame con proteine
adattatrici
Trascrizione geni proapoptotici
Rilascio citocromo-c
Attivazione procaspasi 8
Attivazione procaspasi 9
Attivazione procaspasi 3
APOPTOSI
Attivazione procaspasi 3
APOPTOSI