SEZIONE SCIENTIFICA - Patologia in pillole
PATOLOGIA IN PILLOLE
Nr. 22
L. Mazzucchelli, E. Zucca
Storia clinica
Un uomo di 72 anni consulta il proprio
medico per tosse secca persistente da
due mesi, lieve calo ponderale e febbre
serotina. All’esame clinico si rileva una
linfadenopatia cervicale che viene
indagata attraverso un aspirato con
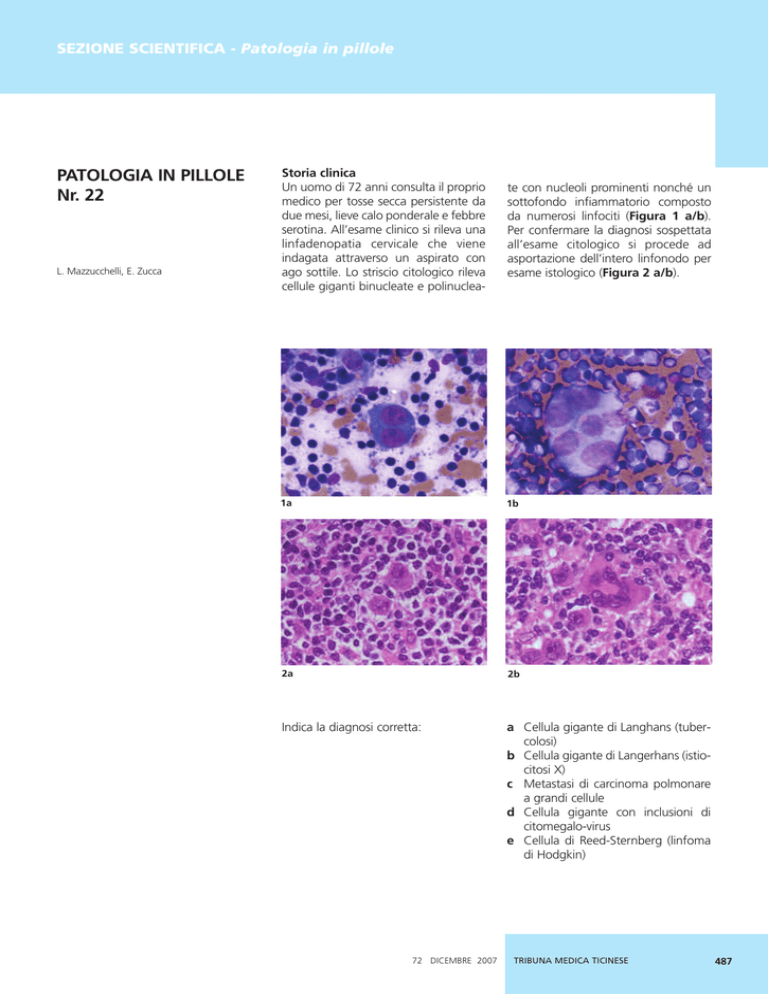
ago sottile. Lo striscio citologico rileva
cellule giganti binucleate e polinuclea-
te con nucleoli prominenti nonché un
sottofondo infiammatorio composto
da numerosi linfociti (Figura 1 a/b).
Per confermare la diagnosi sospettata
all’esame citologico si procede ad
asportazione dell’intero linfonodo per
esame istologico (Figura 2 a/b).
1a
1b
2a
2b
Indica la diagnosi corretta:
a Cellula gigante di Langhans (tubercolosi)
b Cellula gigante di Langerhans (istiocitosi X)
c Metastasi di carcinoma polmonare
a grandi cellule
d Cellula gigante con inclusioni di
citomegalo-virus
e Cellula di Reed-Sternberg (linfoma
di Hodgkin)
72 DICEMBRE 2007
TRIBUNA MEDICA TICINESE
487
SEZIONE SCIENTIFICA - Patologia in pillole
Diagnosi
Cellula di Reed-Sternberg (linfoma
di Hodgkin)
Commento
Il linfoma di Hodgkin rappresenta circa
l’1% delle neoplasie maligne che vengono diagnosticate in tutto il mondo.
In Ticino si contano ogni anno circa
10-12 nuovi pazienti con linfoma di
Hodgkin. L’incidenza da quando il
Registro Tumori del Canton Ticino ha
iniziato la sua attività nel 1996 è comparabile a quella di altri paesi industrializzati.
La prima descrizione scientifica1 di
questa malattia avvenne nel 1832 per
opera di Sir Thomas Hodgkin (17981866) del Guy’s Hospital di Londra
(Figura 3). Da allora sono state proposte diverse classificazioni del linfoma di
Hodgkin di cui la più recente, pubblicata nel 2001 dall’Organizzazione
Mondiale della Sanità (OMS)2, riconosce una forma classica e una non classica sulla base di caratteristiche morfologiche, immunofenotipiche e moleco-
Fig. 3:
488
Sir Thomas Hodgkin
TRIBUNA MEDICA TICINESE
Linfoma di Hodgkin non classico
Linfoma di Hodgkin a predominanza linfocitica (paragranuloma)
Linfoma di Hodgkin classico
Linfoma di Hodgkin, sottotipo sclerosi nodulare
Linfoma di Hodgkin, sottotipo a cellularità mista
Linfoma di Hodgkin, sottotipo a deplezione linfocitaria
Linfoma di Hodgkin, sottotipo ricco in linfociti
Tab. 1: Classificazione del linfoma di Hodgkin (OMS 2001)
lari (Tabella 1). Il linfoma di Hodgkin
classico è una neoplasia molto peculiare in cui le cellule neoplastiche,
dette cellule di Reed-Sternberg, costituiscono meno del 2% della massa
tumorale e sono sparse in un infiltrato infiammatorio che sovverte la
struttura linfonodale ed è composto
soprattutto da linfociti reattivi della
linea T, plasmacellule, macrofagi e
granulociti eosinofili. Le cellule di
Reed-Sternberg sono state descritte
per la prima volta nel 1898 da Carl
Sternberg un allora giovanissimo
anatomo-patologo di Vienna ed in
seguito riportate indipendentemente
nella letteratura anglosassone nel
1902 da Dorothy Reed del Johns
Hopkins Hospital di Baltimora, una
delle prime donne specializzate in
anatomia-patologica degli Stati Uniti.
Trattasi di cellule di grandezza variabile tra i 20 ed i 60 µm con abbondante citoplasma eosinofilo e almeno
due grandi nuclei con nucleoli prominenti. La popolazione di cellule neoplastiche comprende anche un
numero variabile di elementi mononucleati, le cellule di Hodgkin, che
mostrano caratteristiche morfologiche e immunofenotipiche simili alle
cellule di Reed-Sternberg ma sono
meno specifiche in un contesto diagnostico. Infatti elementi mononucleati del tutto simili a cellule di
Hodgkin possono essere osservati in
vari tipi di linfoma, in particolare della
linea T, come pure in linfadeniti di origine batterica o virale. In questo contesto è interessante notare che in 4
su 7 pazienti inclusi nello studio ori-
72 DICEMBRE 2007
ginale di T. Hodgkin di cui è stato
possibile verificare retrospettivamente la diagnosi su materiale d’archivio,
quest’ultima è stata confermata in
solo due pazienti mentre due altri
casi sono risultati essere un linfoma a
cellule T ed una tubercolosi.
La patogenesi del linfoma di Hodgkin
e di conseguenza l’origine della cellula di Reed-Sternberg sono stati
oggetto di intense ricerche fin dalla
loro prima descrizione. L’immunofenotipo non è dirimente per una particolare linea cellulare. Inoltre, il
numero limitato di cellule neoplastiche reperibili in un linfonodo hanno a
lungo precluso analisi di biologia
molecolare. Tuttavia verso la metà
degli anni ’90 alcuni ricercatori tedeschi riuscirono ad isolare con tecniche
di microdissezione le cellule di ReedSternberg (Figura 4) e a dimostrare,
tramite analisi di riarrangiamento
delle catene pesanti dell’immunoglobuline, che esse derivano da cellule B
dei centri germinativi3-4. Una rara origine da cellule T è pure stata postulata in meno del 2% dei casi.
Per meglio comprendere l’origine
della cellula di Reed-Sternberg è
necessario ricapitolare brevemente il
normale processo di maturazione di
un linfocita B. Dopo l’incontro con un
antigene il linfocita B “naive” migra
nel centro germinativo di un follicolo
linfatico dove attraverso mutazioni
somatiche della regione variabile
delle immunoglobuline viene incrementata l’affinità di legame con l’antigene stesso. Linfociti B nei quali le
SEZIONE SCIENTIFICA - Patologia in pillole
Fig. 4:
Microdissezione di cellule di ReedSternberg evidenziate in rosso con tecniche di immunoistochimica e sospinte
in una micropipetta (da referenza 2).
mutazioni somatiche indeboliscono il
legame con l’antigene vengono selezionati negativamente ed eliminati
tramite morte cellulare programmata
(apoptosi). Per contro linfociti B nei
quali intervengono mutazioni somatiche che aumentano l’affinità con
l’antigene vengono trattenuti dalle
cellule dendritiche follicolari e possono procedere ad ulteriori tappe di
maturazione che portano infine alla
differenziazione in linfociti B della
memoria oppure plasmacellule. Nel
lnfoma di Hodgkin le cellule neoplastiche sono portatrici di mutazioni
somatiche aberranti. In circostanze
normali queste cellule verrebbero eliminate mentre nel contesto neoplastico esse sopravvivono e proliferano
perdendo tuttavia le caratteristiche
immunofenotipiche della linea B. In
sintesi, le cellule di Reed-Sternberg
derivano da cellule B preapoptotiche
dei centri germinativi che sfuggono
ai normali processi di selezione negativa e quindi all’eliminazione tramite
apoptosi.
Il ruolo potenziale del virus EbsteinBarr (EBV) nella patogenesi del linfoma di Hodgkin è stato oggetto di
numerosissimi studi fin da quando,
agli inizi degli anni settanta, è stato
identificato un titolo elevato di anticorpi anti-EBV in pazienti con questo
tipo di linfoma5. Nel 1987 venne
identificato per la prima volta DNA di
EBV in tessuto con linfoma di
Hodgkin6 e negli anni seguenti il
DNA virale poté essere evidenziato
tramite tecniche di biologia molecolare direttamente nelle cellule di
Reed-Sternberg7. EBV è più comunemente associato con il linfoma di
Hodgkin classico, in particolare del
sottotipo a cellularità mista ed è solo
raramente evidenziabile nella forma
di linfoma non classico a predominanza linfocitica. Nei paesi in via di
sviluppo l’incidenza di linfoma di
Hodgkin EBV-positivo è maggiore
rispetto a quella dei paesi industrializzati, fattore questo che è verosimilmente imputabile all’esistenza di uno
stato soggiacente di immunosoppressione. Per lo stesso motivo un’associazione con EBV è particolarmente
frequente in individui con immunocompetenza diminuta o non del tutto
sviluppata quali soggetti con infezione da HIV oppure pazienti in età
pediatrica ed anziani. L’espressione di
geni di EBV nelle cellule di ReedSternberg suggerisce un ruolo del
DNA virale nel salvataggio di queste
cellule dall’eliminazione per apoptosi. Infatti diverse proteine virali hanno
la capacità di mimare e sostituire normali sistemi di salvataggio cellulare
che fisiologicamente sono mediati da
molecole quali CD40 oppure il recettore delle cellule B. Inoltre, una proteina virale con un forte potenziale di
trasformazione neoplastica è la proteina di membrana LMP-1 la quale ha
la facoltà di inibire fenomeni di apoptosi attraverso l’attivazione di numerosi geni cellulari quali ad esempio
bcl2 e NF-KB.
Alla fine degli anni ‘90 e negli anni
72 DICEMBRE 2007
seguenti numerosi gruppi di ricerca
hanno meglio caratterizzato la relazione che intercorre tra cellule di
Hodgkin e di Reed-Sternberg e l’infiltrato reattivo che costituisce più del
98% della massa tumorale dimostrando da una parte la presenza di
diversi recettori delle citochine nelle
cellule neoplastiche e dall’altra l’esistenza di sistemi di regolazione autocrini e paracrini della produzione di
citochine e chemiochine nell’infiltrato
reattivo8. La produzione di quest’ultime molecole determina le caratteristiche dell’infiltrato flogistico, causa i
sintomi infiammatori tipici che
accompagnano un linfoma di Hodgkin
e, non da ultimo, condiziona la crescita e la capacità di evadere il sistema di
immunosorveglianza delle cellule
neoplastiche.
In conclusione, è ormai accertato e
comprovato da numerosi studi che la
cellula di Reed-Sternberg deriva da
linfociti della linea B nella stragrande
maggioranza dei casi. Per questo
motivo il termine generico di malattia
di Hodgkin è stato sostituto già nella
classificazione OMS del 2001 con il
termine di linfoma di Hodgkin. In
questo senso è anche interessante
sottolineare che, in base al tipo di
espressione genica rilevato con microchips capaci di analizzare simultaneamente migliaia di geni è recentemente stato possibile dimostrare che una
forma particolare di linfoma diffuso a
grandi cellule B quale il linfoma
mediastinico sclerosante, presenta
caratteristiche simili al linfoma di
Hodgkin9 rappresentando pertanto il
possibile “link” tra il gruppo dei linfomi di Hodgkin ed il gruppo dei linfomi non-Hodgkin10.
L. Mazzucchelli, Istituto cantonale di patologia
Locarno
E. Zucca, Istituto oncologico della Svizzera italiana (IOSI), Bellinzona
TRIBUNA MEDICA TICINESE
489
SEZIONE SCIENTIFICA - Patologia in pillole
Bibliografia
1 Hodgkin T. On some morbid appearances of
the absorbent glands and spleen. Med
Chirurg Trans 1832, 17:69-97
2 Jaffe ES, Harris NL et al., editors. World
Health Organistaion classification of tumors.
Pathology and genetics of tumors of hematopoietic and lymphoid tissues. Lyon: IARC
Press; 2001
3 Hmmel M, Ziemann K et al. Hodgkin’s disease with monoclonal and polyclonal population of Reed-Sternberg cells. N Engl J Med
1995, 333:901-906
4 Kanzler H, Kuppers R et al. Hodgkin and
Reed-Sternberg cells in Hodgkin’s disease
represent the outgrowth of a dominant
tumor clone derived from (crippled) germinal
center B cells. J Exp Med 1996, 184:14951505
5 Levine P, Ablashi D et al. Elavated antibody
titers to Epstein-Barr virus in Hodgkin’s disease. Cancer 1971, 27:416-421
6 Weiss LM, Strickler JG et al. Epstein-Barr viral
DNA in tissues of Hodgkin’s disease. Am J
Pathol 1987, 129:86-91
7 Weiss LM, Movahed LA et al. Detection of
Epstein-Barr viral genomes in Reed-Sternberg
cells of Hodgkin’s disease. N Engl J Med
1989, 320:502-506
8 Skinnider BF, Mak TW. The role of cytokines
in classical Hodgkin lymphoma. Blood 2002,
99:4283-4297
9 Savage KJ, Monti S et al. The molecular
signature of mediastinal large B-cell lymphoma differs from that of other diffuse large Bcell lymphomas and shares features with classical Hodgkin lymphoma. Blood 2003,
102:3871-3879
10 Traverse-Glehen A, Pittaluga S et al.
Mediastinal gray zone lymphoma: the missing link between classic Hodgkin’s lymphoma and mediastinal large B-cell lymphoma.
Am J Surg Pathol 2005, 29:1411-1421
490
TRIBUNA MEDICA TICINESE
72 DICEMBRE 2007












