CHIMICA ORGANICA
La chimica organica è la chimica dei composti del CARBONIO
La teoria base della chimica organica è la teoria strutturale:
1) Gli atomi dei composti organici possono formare
un numero definito di legami. (Valenza)
C
O
2) L’atomo di carbonio si può legare mediante una
o più valenze ad altri atomi di carbonio
C C C C C C C
ISOMERI: composti differenti che hanno la stessa formula molecolare
ISOMERIA
Isomeri di struttura: sono quei composti che hanno la stessa formula
molecolare, ma differiscono nell’ordine con cui gli atomi sono legati.
CH3CH2OH
CH3OCH3
I legami chimici possono essere:
Si forma a seguito del trasferimento di uno o
ionico o elettrovalente
più elettroni da un atomo all’altro
Si forma quando due atomi accoppiano i loro
covalente
elettroni dispari.
Principio dell’Aufbau: gli orbitali sono riempiti con gli elettroni secondo un ordine
crescente di energia
Principio di esclusione di Pauli: ogni orbitale può contenere fino ad un massimo
di due elettroni, purchè i loro spin siano di segno opposto.
Regola di Hund: gli elettroni si dispongono sugli orbitali degeneri in modo da
raggiungere il maggior numero possibile di elettroni dispari
Orbitali σΠ
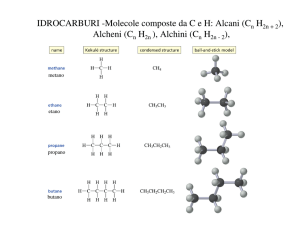
Alcani
Alcani: CnH2n+2
Formula generale:
Cicloalcani: CnH2n
Nomenclatura degli alcani
•La posizione dei sostituenti è specificata numerando la catena più
lunga in modo essi abbiano il numero più piccolo
1
CH3
6
2
CH2
5
3
CH2 4
2
1
Numerazione corretta
6
Numerazione non corretta
CH3 CH2 CH3 CH2 CH3
4
5
3-etilesano
•Quando sono presenti diversi sostituenti vanno elencati in ordine
alfabetico usando i prefissi di-, tri-, etc. per indicare la presenza di
sostituenti uguali
CH3-
CH3CH2-
metile
CH3CH2CH2CH2-
CH3CH2CH2- propile
Carbonio
secondario
Gruppo isopropilico
H3C C CH
H2
sec-butile
CH3
H3C C
CH3
terz-butile
CH3
H3 C CH
CH3CH2CH2CH3
Isomeri di struttura
butile
Carbonio
terziario
CH3
CH3
H3C CH
etile
CH3
Alcani: isomeri di struttura
Per n>3 esistono più isomeri di struttura. Le diverse strutture di
queste molecole portano a differenti proprietà chimiche e
fisiche
Modello ball and sticks
n-butano
isobutano
CH3 CH2 CH2
Modello space filling
CH3
CH3 CH CH3
CH3
Gli alcani a catena lineare sono chiamati normali (n-). Gli altri sono detti
ramificati
Cicloalcani: nomenclatura
La nomenclatura segue le stesse regole adottate per gli alcani.
Si premette il prefisso ciclo- e l’anello viene numerato in modo
da avere i numeri più bassi per i sostituenti.
CH2 CH3
6
5
1
4
2
3
CH3
1-etil-3-metilcicloesano
Cicloalcani
Oltre a formare catene, gli atomi di C possono formare degli anelli. I cicloalcani
sono anelli formati esclusivamente da gruppi CH2
Formula generale dei cicloalcani:
CnH2n
Il più semplice è il ciclopropano C3H6 in cui gli atomi di C
formano un triangolo equilatero con angoli di 60°; gli orbitali
ibridi sp3 non si sovrappongono estesamente e ciò provoca un
legame C-C debole ed in tensione e la molecola è molto più
reattiva del propano. Analogamente si comporta il ciclobutano
(angoli di 90°). Al contrario il cicloepentano e il cicloesano
sono abbastanza stabili perché i loro anelli hanno angoli di
legame più vicini all’angolo del tetraedro.
C
C
(n > 3)
C
Cicloesano: Stereochimica
Cicloesano: Stereochimica
Cicloesano: Stereochimica
Cicloesano: Stereochimica
Alcani: Sintesi
Il petrolio rappresenta la fonte principale di idrocarburi saturi, i quali
servono fondamentalmente per la produzione di energia mediante la
combustione
H H
C C
+
2 R-X + Zn + 2H+
R-X + R’-X
H2
Pt, Ni
Solvente
C C
2R-H + ZnX2
R-R’
Omolisi
A. + B.
A:- + B+
A:B
Eterolisi
A+
+
:B-
Radicale carbonio
C: Z
C.
+
Z.
C+
+
:Z -
Carbocatione
C: Z
C: - + Z +
Carbanione
Alcani: reazioni
H
H C
H
Cl + NaOH
H C
H
OH
+
NaCl
H
C H
Cl2
calore
2Cl.
+ Cl2
C Cl
+ HCl
Stadio di inizio
luce
CH4 + Cl.
HCl + CH3.
CH3. + Cl2
CH3Cl + Cl.
Stadi di propagazione
Stadi di terminazione
H
H
H C
+ .C
H
H
H H
H
H C C H
H H
H
H
H C
+
Cl
H C Cl
H
H
Cl + Cl
Cl Cl
Definizione di isomero
Si definiscono isomeri due o più molecole aventi stessa formula
molecolare ma differente formula di struttura. Esistono vari
tipi di isomeria:
Strutturale: gli atomi di carbonio sono legati tra di loro in maniera differente (per
esempio isobutano e normalbutano).
Stereoisomeria: gli stereoisomeri presentano gli stessi legami ma differiscono per il
modo in cui gli atomi sono orientati nello spazio. Per trasformare uno stereoisomero
nell’altro è necessario rompere e riformare almeno un legame. Si chiamano
diastereoisomeri gli stereoisomeri che non sono uno l’immagine speculare dell’altro.
Si chiamano isomeri geometrici i diastereoisomeri che debbono la loro
esistenza alla mancanza di libera rotazione intorno ai doppi legami (isomeria
cis/trans nel 2-butene).
Si chiamano isomeri ottici gli isomeri che non sono sovrapponibili alla loro
immagine speculare.
Si chiamano isomeri conformazionali gli isomeri che possono trasformarsi l’uno
nell’altro senza la rottura di legami (per esempio le diverse conformazioni anti e
gauche del n-butano).
La sistemazione degli atomi che caratterizza un dato stereoisomero si
chiama la sua configurazione
Attività ottica
La luce polarizzata è una luce le cui vibrazioni avvengono soltanto in uno
degli infiniti piani possibili
Una sostanza otticamente attiva ruota il piano della luce polarizzata.
Gli enantiomeri hanno punti di fusione, ebollizione ed indici di
rifrazione assolutamente identici.
Gli enantiomeri differiscono solo nelle interazioni con sostanze
chirali o con fenomeni fisici di natura chirale.
I diastereoisomeri hanno proprietà chimiche simili, ma proprietà
fisiche differenti
Racemo: miscela in parte uguali di due enantiomeri
Una molecola chirale è una molecola non sovrapponibile alla propria
immagine speculare.
Si chiama centro chirale un atomo di carbonio al quale sono legati
quattro gruppi diversi.
Un composto meso è un composto le cui molecole sono sovrapponibili
alla loro immagine speculare sebbene contengano dei centri chirali
Reazioni di Sostituzione Nucleofila
Nu:-
+
nucleofilo
OH-
R--X
R Nu
substrato
prodotto
+
H3C Cl
+
H3C OH
δ+
δ-
C
X
Xgruppo uscente
+
Cl
Sostituzione nucleofila SN2
E’ una reazione bimolecolare
V = k [Nu:-] [R-X]
Avviene con substrati primari o secondari
Avviene in un unico step con inversione di configurazione
Sostituzione nucleofila SN1
E’ una reazione unimolecolare
V = k [R-X]
Avviene con substrati terziari
Avviene in due step con inversione di configurazione più parziale racemizzazione
Carbocatione
Un sistema elettricamente carico è tanto più stabilizzato quanto più la
carica è dispersa o delocalizzata.
R
R
+
R C
R
H
+
+
H
+
> R C > R C > H C
H
H
H
CONFRONTO FRA:
SN2
SN1
Cinetica del secondo ordine
Cinetica del primo ordine
Completa inversione stereochimica
Racemizzazione
Assenza di trasposizioni
Trasposizioni
V = k [Sub] [Nu:-]
La reazione SN2 è favorita da solventi che stabilizzano meno il nucleofilo
anionico: solventi aprotici o solventi a bassa polarità.
V = k [Sub]
La reazione SN1 è favorita da solventi a elevato potere ionizzante, cioè da
solventi polari protici, che facilitano l’espulsione del gruppo uscente.
Reazioni di eliminazione
Le reazioni di eliminazione sono caratterizzate dalla
rimozione in una molecola di due gruppi, che possono
essere situati:
a. sullo stesso atomo di carbonio (α-eliminazione)
b. su atomi di carbonio adiacenti (β-eliminazione o eliminazione 1,2)
con formazione di un legame multiplo
CH3CH CH3
Br
C2H5ONa
C2H5OH
H2C CH CH3
+
NaBr
+
C2H5OH
deidroalogenzioni
CH3
CH3C Br
CH3
C2H5ONa
C2 H5 OH
H2C C CH3
CH3
+
NaBr
+
C2 H5 OH
Reazione di eliminazione E2
E’ una reazione bimolecolare
V = k [R-X] [:B-]
Avviene in un unico step
Avviene con substrati primari o secondari
Reazione di eliminazione E1
E’ una reazione unimolecolare
V = k [R-X]
Avviene con substrati terziari
Mostrano lo stesso effetto della struttura sulla reattività osservato nelle
reazioni SN1
Danno luogo a trasposizioni
Nella deidroalogenazione il prodotto preferito è alchene che ha il maggior
numero di gruppi alchilici legati agli atomi di carbonio impegnati nel doppio
legame (Saytzeff)
L’eliminazione secondo E1 mostra un forte orientamento secondo
Saytzeff, cioè quando si può formare più di un alchene, il prodotto preferito
è l’alchene più ramificato.
Competizione tra sostituzione ed eliminazione
SN2 verso E2:
Quando la sostituzione e l’eliminazione bimolecolari sono reazioni
competitive, la quantità del prodotto di eliminazione aumenta passando
da un alogenuro alchilico primario, al secondario e poi al terziario
SN2
E2
Un solvente meno polare e una temperatura più elevata favoriscono l’E2.
CH3
L’uso di una base stericamente impedita CH3C O favorisce l’E2
CH3
Competizione tra sostituzione ed eliminazione
SN1 verso E1:
L’eliminazione E1 e la sotituzione SN1 procedono con formazione
dello stesso intermedio: l’eterolisi per formare il carbocatione
Nucleofili deboli e l’uso di solventi polari favoriscono l’E1.
Nonostante sia difficile influenzare la distribuzione relativa dei
prodotti SN1 e E1 si riscontra che le reazioni SN1 sono favorite da
una bassa temperatura.
In generale le reazioni di sostituzione degli alogenuri terziari non
hanno un grande interesse preparativo, in quanto danno troppo
facilmente l’eliminazione
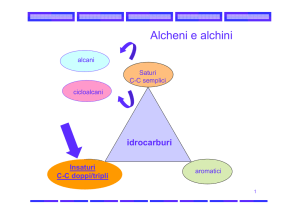
Alcheni
Formula Generale: CnH2n
Gli alcheni rappresentano una classe di idrocarburi insaturi.
Il doppio legame rappresenta il gruppo funzionale caratteristico degli alcheni
Alcheni: nomenclatura
H2C CH CH2CH3
CH3C CH CH2CH2CH3
H
1-butene
2-esene
La catena è numerata a partire dall’estremità che è più vicina al doppio legame
1
2
3,5 dimetil cicloesene
CH3
CH3
Nel caso di cicloalcheni sostituiti, gli atomi di carbonio dell’anello sono
numerati in modo che i carboni del doppio legame portino i numeri 1 e 2.
H2C CH
H2C CH CH2
Gruppo vinile
Gruppo allile
I gruppi vinilico e allilico sono due sostituenti alchenilici e possono determinare
il nome di alcune olefine
Alcheni: isomeria cis/trans
Attorno agli atomi di C uniti mediante il doppio legame la rotazione è impedita.
Ciò comporta il manifestarsi dell’isomeria geometrica. Ad esempio il 2-butene
esiste in due isomeri geometrici.
Cis 2-butene
H
H
C=C
C=C
CH3
CH3
H
CH3
CH3
H
Trans 2-butene
Alcheni: stereochimica
C C
+
H H
Pt
C C
ΔH = 30 Kcal/mole
H H
L’idrogenazione di un alchene è una reazione esotermica e la maggior parte
degli alcheni hanno calore di idrogenazione di circa 30 kcal/mole.
Nella coppia cis-trans di due alcheni stereoisomeri, l’isomero trans è sempre
L’isomero cis è il meno stabile a causa delle maggiori tensioni steriche
più stabile dell’isomero cis.
Idrocarburi insaturi: alcheni
Orbitali molecolari dell’etilene
Negli alcheni i carboni dei doppi legami presentano ibridazione sp2. Il legame C-C
è formato per accoppiamento di due elettroni presenti negli orbitali sp2 e il legame
per accoppiamento di elettroni p.
I due orbitali p sui due atomi di carbonio dell’etilene devono essere allineati
(paralleli) per poter formare legami . Questo impedisce la rotazione dei due gruppi
CH2 l’uno rispetto all’altro a temperatura ordinaria, contrariamente agli alcani per i
quali è possibile la libera rotazione.
Alcheni: preparazione
Il metodo più generale per la preparazione degli alcheni si basa sulle
reazioni di eliminazione
+
H
calore
C C
C C
H OH
La facilità con cui gli alcooli eliminano acqua in ambiente acido diminuisce
nel seguente ordine:
R
R
R C OH
R
>
R C OH
H
H
>
R C OH
H
La deitrazione degli alcooli segue la regola di Saytsev: i prodotti principali
sono gli alcheni più stabili.
Alcheni: preparazione
La deidratazione degli alcooli è una reazione E1 a carico dell’alcool
Alcuni alcooli primari e secondari subiscono una modificazione del loro
protonato.
scheletro di atomi di carbonio (trasposizioni)
CH3
CH3
H
+
CH3CH3CCHCCHO3 H
+
H O
H3 C OHCH3
H
H3 C H
+
H3 C C O H
CH3
CH3CH3 H3C H
CH3CH3
+
C C +
O HHC +
CH3C C H3CH
C H
CH
2 OCH3
3
2
CH3
80%
20%
CH3
+
H3 C C
H
+
O H
CH3
H
H C H
+
H3 C C
CH3
H
+
O H
CH2
H3 C C
CH3
H
+
+
H O H
Alcheni: reazioni
Per il fatto di possedere un doppio legame carbonio-carbonio, gli alcheni
sono molto reattivi e danno reazioni tipiche di addizione, che portano alla
formazione di composti saturi.
La reazione tipica degli alcheni è l'addizione elettrofila, l'addizione cioè di
reagenti acidi. La reazione di addizione al doppio legame è un esempio di
reazione che procede con rottura eterolitica del legame.
Le reazioni di addizione tipiche degli alcheni sono:
Addizione di alogeni
Addizione di acidi alogenidrici
Addizione di acqua o idratazione
Alcheni: reazioni
Meccanismo dell’addizione elettrofila
Gli alcheni reagiscono immediatamente
con il bromo a temperatura ambiente
ed in assenza di luce.
L'atomo di alogeno reso parzialmente positivo diviene un reattivo
elettrofilo (un acido di Lewis) ed è fortemente attratto dal doppio legame.
Si formano uno ione bromonio ciclico intermedio e un alogenione negativo.
L'esistenza di un effettivo catione intermedio parrebbe confermata dal fatto
che questa reazione dà sempre l'addizione trans (è cioè stereospecifica).
L’apertura dell’anello a tre termini è una reazione SN2
Alcheni: reazioni
Nel caso dell'addizione ad un termine superiore all'etene, contenente quindi
almeno un radicale alchilico, l'alchene possiede già una polarizzazione, dovuta
all'effetto induttivo, elettrondonatore (elettron-respingente), del radicale
alchilico:
Così, dalla reazione:
Nell'addizione di un acido ad un doppio legame carbonio-carbonio, l'idrogeno si
lega al carbonio che ha già il maggior numero di idrogeni legati a sé. (Regola di
Markovnikov)
La regola di Markovnikov può essere così generalizzata: "L'addizione elettrofila
ad un doppio legame carbonio-carbonio implica la formazione intermedia del
carbocatione più stabile e cioè dell'ordine maggiore possibile."
Alcheni: stereochimica
I termini cis e trans per distinguere due alcheni diastereoisomeri si
applicano senza ambiguità solamente agli alcheni con due sostituenti
Nel caso di alcheni con quattro sostituenti diversi legati ai carboni insaturi si ha:
Cl
F
C
C
C
H
Z
H
C C
Cl
C
Br
Cl
F
Cl
Br
(E)-1-Bromo-1,2-dicloroetene
H
Br
E
Cl
C C
Br
H
Cl
(Z)-1-Bromo-1,2-dicloroetene
Alchini
Formula Generale: CnH2n-2
Desinenza finale: …..ino
Alchini: reazioni
La chimica degli alchini è la chimica del triplo legame; gli alchini danno
reazione di addizione elettrofila come gli alcheni.
C C
HCl
H
HCl
C C
Cl
H Cl
C C
H Cl
Cloroalchene
Dicloruro geminale
Gli idrogeni dell’acetilene sono notevolmente più acidi sia di quelli dell’etilene
che dell’etano
H
H C C H
Ka ~
H
C C
H
10-25
H H
H C C H
H
H H
Ka ~ 10-44
Ka ~ 10-50
L’acetiluro di sodio e gli altri alchilacetiluri possono essere preparati
trattando gli alchini terminali con sodioammide in ammoniaca liquida.
H C C H
+
NaNH2
H C C Na
+
+
NH3
Dieni
I dieni sono semplicemente alcheni che contengono due doppi legami.
I dieni possono essere classificati in:
Coniugati, quando i doppi legami
sono separati da un solo legame
semplice.
Isolati, quando i doppi legami sono
separati da più di un legame
semplice.
Cumulati (o alleni), quando i doppi
legami non sono separati l'uno dall'altro.
Dieni coniugati
Il primo termine di questa serie è l'1,3-butadiene ed è il diene più importante;
viene usato industrialmente per fabbricare la gomma sintetica.
Dieni coniugati
Il sistema di doppi legami dei dieni coniugati è termodinamicamente più
stabile sia del doppio legame degli alcheni sia del sistema di doppi legami
dei dieni isolati.
Concludiamo perciò che i due doppi legami coniugati dell’1,3 butadiene
sono più stabili di due doppi legami dell’1-butene.
Dieni coniugati: risonanza
Secondo la teoria della risonanza, una molecola può essere rappresentata da tutte le
possibili strutture che differiscano esclusivamente per la disposizione degli
elettroni. Di queste strutture (strutture canoniche di risonanza), nessuna
rappresenta realmente la molecola che è piuttosto un ibrido di risonanza di tutte
le strutture possibili.
Per il butadiene si possono scrivere le seguenti formule risonanti, a cariche
separate:
Dieni coniugati: risonanza
È quindi possibile immaginare una delocalizzazione degli elettroni
coinvolga l'intero gruppo funzionale del diene coniugato.
che
ed equivale alla risonanza
che contribuirebbe a stabilizzare la molecola del diene coniugato.
Dieni coniugati: reattività
I dieni coniugati non solo mostrano una stabilità termodinamica maggiore di
quella prevedibile teoricamente, ma mostrano anche un comportamento
particolare nelle loro reazioni con reagenti elettrofili.
È evidente che un anione, o una qualsiasi base, potrà attaccarsi o in posizione
2 o in posizione 4: la "direzione" dell' attacco può essere controllata scegliendo
adeguatamente le condizioni di reazione.
Le quantità relative dei prodotti di addizioni 1,2 e 1,4 non sono costanti ma
dipendono dalla temperatura a cui si effettua la reazione.
Dieni coniugati
Un importante diene coniugato è l'isoprene (2-metil-1,3-butadiene) che è il
termine successivo della serie.
La gomma naturale (cis-poliisoprene) è un polimero di questa molecola.
I terpeni (componenti degli oli essenziali di molte piante), ad esempio,
contengono un determinato numero di unità isopreniche unite fra loro in
modo regolare, secondo il sistema testa-coda (regola isoprenica).
CH2
C
CH3
CH3
CH2 C
CH2
C
H
H
C
CH2
C
CH2
CH3
C
CH2
H
Idrocarburi aromatici: benzene
Il benzene è il capostipite di una vasta classe di composti organici, i composti aromatici.
H
H
H
H
H
H
H
H
H
H
H
H
Struttura di Kekulè del benzene
Idrocarburi aromatici: benzene
Tutti i legami carbonio - carbonio nel benzene sono equivalenti ed hanno una
lunghezza (ed una energia) intermedia tra quella di un legame semplice e
quella di un legame doppio (~1.39 Å).
Ogni atomo di carbonio ha ibridazione sp2 e quindi una struttura planare
triangolare con angoli di legame di 120°.
La molecola può essere rappresentata con una nuvola elettronica estesa sopra
e sotto al piano individuato dagli atomi di carbonio.
Benzene: aromaticità
Basandosi su calcoli applicati alla meccanica quantistica, Erich Hückel
dimostrò che per essere aromatico un composto deve avere nuvole elettroniche
cicliche contenenti 4n+2 elettroni delocalizzati (regola di Hückel).
La delocalizzazione non è quindi condizione sufficiente per l'aromaticità, ma
occorre un determinato numero (2, 6, 10, 14, etc.) di elettroni .
base
forte
H H
Cicloottatetraene
H
Naftalene
Annuleni: composti monociclici caratterizzati da un’alternanza di legami
semplici e doppi.
Benzene: reazioni
L’anello del benzene, nelle sue reazioni più tipiche, si comporta come una fonte di
elettroni, cioè come una base
Le reazioni tipiche dell’anello benzenico sono le reazioni di sotituzione elettrofila.
H
E
1. Il sostituente elettrofilo si avvicina all'anello lateralmente rispetto al piano della molecola.
H sugli elettroni del benzene
H
H
H e uno dei legami
2. Si ha una azione
di richiamo
si polarizza in
+
modo da consentire
+ E+
+ H
3. l'attacco del H
sostituente, H
che sfrutta una coppia di elettroni
H per legarsi.
H
4 - 6. Si forma un intermedio
instabile, detto complesso , al quale
H
H contribuiscono tre differenti
forme risonanti (4,5,6). L'atomo che ha subito l'attacco ha cambiato il suo stato di ibridazione da
sp2 a sp3, per cui esso è escluso dalla "coniugazione" col resto del sistema. Anche se si può
ancora parlare di risonanza , non si può più parlare di aromaticità.
7. L'energia di risonanza di questo catione non è elevata come quella del benzene; l'espulsione di
un protone può tuttavia riportare il complesso s alle condizioni di aromaticità.
8. Si ottiene così il prodotto sostituito finale.
Benzene: sostituenti
Quando un elettrofilo attacca l'anello aromatico, è il gruppo già legato che
assume il controllo cinetico della reazione e stabilisce il punto d'attacco del
nuovo sostituente.
I gruppi sostituenti si possono classificare in:
rendono il derivato più Attivanti:
reattivo del benzene: sono capaci
di "rifornire" di elettroni l'anello (elettrondonatori).
rendono il compostoDisattivanti:
meno reattivo del benzene:
impoveriscono di elettroni l'anello (elettronattrattori).
Per quanto riguarda invece l'orientamento di un secondo sostituente, i gruppi si
CH
possono distinguere in orto-para orientanti
e meta orientanti.
3
orto
orto
CH3
Toluene
NH2
meta
Anilina
para
OH
Fenolo
COOH
Cl
metaClorobenzene
Acido benzoico
Benzene: sostituenti: attivanti e disattivanti
Per stabilire se un gruppo sia attivante o disattivante, occorre considerare due diversi
effetti che esso può produrre sull'anello:
L' Effetto induttivo
L' Effetto mesomero o di risonanza
Effetto induttivo
Dipende dalla differenza di elettronegatività fra il carbonio e l'elemento ad esso
legato. Esso spiega perché gli alogeni siano dei disattivanti: essendo molto
elettronegativi, sono elettronattrattori e quindi impoveriscono di elettroni
l'anello.Spiega anche perché i gruppi NO2, -CN, -SO3-, -COOH siano ugualmente
disattivanti
Effetto elettronattrattore del gruppo nitrile sull'anello benzenico
Benzene: sostituenti: attivanti e disattivanti
Effetto mesomero
Alcuni sostituenti (-NH2, -OH, ecc.) sono attivanti, pur contenendo atomi
elettronegativi (e quindi con un effetto induttivo elettronattrattore). Ciò significa che
questi gruppi "devono" rifornire di elettroni l'anello a causa di un effetto diverso da
quello induttivo: questo effetto è dovuto al fenomeno della risonanza.
Strutture risonanti dell'anilina: le posizioni orto e para sono arricchite di elettroni
Nel caso di sostituenti come -NO2, -CN, ecc., l'effetto mesomero ha una "direzione"
opposta. All'effetto induttivo elettronattrattore si aggiunge l'effetto mesomero
ugualmente elettronattrattore. Per questo motivo i gruppi -NO2 e -CN sono forti
disattivanti.
Benzene: sostituenti: attivanti e disattivanti
Nel caso degli alogeni la situazione è analoga a quella di un gruppo come -NH2 o -OH,
cioè l'effetto mesomero è elettrondonatore, come si può vedere dalle strutture risonanti
del clorobenzene. Ma poiché in questo caso l'effetto induttivo è preponderante, un
alogeno è un disattivante dell'anello, ma è orto-para orientante.
Strutture risonanti del clorobenzene: caso analogo all'anilina
Un gruppo alchenilico ha un effetto elettrondonatore e quindi attivante dell'anello. In
questo caso tuttavia non è coinvolto il fenomeno dell'iperconiugazione, ma l'effetto
mesomero del doppio legame stesso:
Benzene: sostituenti: conclusioni
Tutti i gruppi sostituenti (attivanti o disattivanti) esercitano la loro influenza
massimamente sulle posizioni orto e para.
Un gruppo attivante attiva tutte le posizioni, ma attiva le orto e para molto più
della meta; un gruppo disattivante disattiva tutte le posizioni, ma disattiva le orto e
le para molto più delle meta.
Inoltre: un gruppo può respingere o attirare elettroni per effetto induttivo, per
effetto mesomero, o per entrambi.
Questi effetti hanno direzione opposta solo per i gruppi -NH2, -OH, ecc. e per gli
alogeni. Per i primi è preponderante l'effetto mesomero, per gli alogeni quello
induttivo. Per questo motivo gli alogeni hanno un comportamento "anomalo",
essendo disattivanti, ma orto-para orientanti.
Composti aromatici eterociclici
N
Pyridine
N
O
H
Furan
S
Thiophene
Pyrrole
+
N
N
N-
O
+
O
-
+
O
+
N-
+ N
-
+
O
-
+
O
Alcooli
Alcooli: proprietà fisiche
C C
C C
C C
C C
H
H OH2+
H OH
+
Ossido-Riduzione in chimica organica
In chimica organica si dice che la riduzione corrisponde ad un aumento del
contenuto di idrogeno di una molecola, oppure ad una diminuizione del suo
contenuto in ossigeno.
O
R C OH
rid
O
Il contenuto
R C Hdi ossigeno diminuisce
O
Il contenuto
di idrogeno aumenta
RCH OH
R C H
2
L’ossidazione di una molecola è una reazione che avviene con cessione di
elettroni e quindi con aumento dello stato di ossidazione di un atomo. Essa
corrisponde ad un aumento del contenuto di ossigeno della molecola oppure ad
una diminuizione del contenuto di idrogeno.
O
RCH3
RCH2 OH
R
C H
O
R C OH
Alcooli: ossidazione e riduzione
O
O
RCH2OH
R C OH
R
C H
O
O
R
RCH2OH
RCH2OH
C OR'
C R'
R
R CH R'
OH
O
RCH2OH
R
C H
O
R C OH
O
R CH R'
R
C R'
R
OH
R'
C OH
R''
Eteri
+
R O Na
+
R'
L
R O R'
+
+ Na L-
Fenoli
I composti che contengono l’ossidrile legato direttamente ad un anello aromatico
non sono alcooli, ma fenoli
Il fenolo è un composto industrialmente molto importante in quanto è il
OH di numerosi prodotti commerciali che
prodotto di partenza per la sintesi
vanno dall’aspirina ad alcuni tipi di materie plastiche.
ONa
Cl
+
+
2 NaOH
ONa
NaCl
+
H2O
+
H2 O
OH
HCl
+
SO3Na
NaCl
ONa
+
2 NaOH
HCl
+
Na2SO3
Fenoli
L’acidità dei fenoli è nettamente superiore rispetto a quella degli alcooli.
OH
OH
Ka ~ 10-18
Ka = 1,3 x 10-10
HO
OH
O
2
+
I fenoli che hanno
gruppi
ad
attrazione
elettronica
(-Cl
oppure
2) legati
OH + NaOH
O
Na
O
+ H–NO
2
all’anello benzenico sono più acidi del fenolo. A loro volta i fenoli con
gruppi a
H2 O
+ H3O+sostituito.
rilascio elettronico (ad es.+–CH
3) sono meno acidi del fenolo non
OH
OH
+
OH
OH
NaOH
O Na
+
H2 O
O
OH
Ka = 1,3 x 10-10
+
Cl
H2 O
Cl
Ka = 6,3 x 10-10
Ka = 1,6 x+10-9H3 O+
+
H2 O
Aldeidi e chetoni
Aldeidi e chetoni sono caratterizzati dal gruppo funzionale carbonilico e sono
pertanto raggruppati sotto il nome di composti carbonilici.
Gli elettroni del doppio legame C=O, unendo due atomi di elettronegatività
molto diversa, sono addensati sull'atomo più elettronegativo, l'ossigeno; il
gruppo carbonilico è fortemente polarizzato
Inoltre, la geometria trigonale-planare, correlata all'ibridazione sp2 dell'atomo
di carbonio, fa sì che il gruppo carbonilico offra ampi spazi d'accesso per un
reagente.
Aldeidi e chetoni: preparazione
Il metodo classico per la preparazione di aldeidi e chetoni è l'ossidazione degli
alcoli primari e secondari
L'ossidazione viene quindi condotta in soluzione acquosa, ad una temperatura
vicina a quella di ebollizione dell'aldeide: non appena l'aldeide si forma, questa
distilla e lascia l'ambiente di reazione.
Aldeidi e chetoni si possono preparare per ozonolisi degli alcheni
R''
R
C C
R'
H
O3
Zn, H2 O
R''
R
C O
R'
+
O C
H
Aldeidi e chetoni: addizione nucleofila
Si noti che la reazione di addizione nucleofila al gruppo carbonilico è
generalmente reversibile.
Ovviamente l'addizione al gruppo carbonilico potrebbe essere iniziata
altrettanto bene da un attacco elettrofilo sull'ossigeno. In effetti, ciò è quanto si
può osservare nell'addizione nucleofila catalizzata da acidi.
La catalisi acida tuttavia assume una certa importanza solo quando l'acido
(l'elettrofilo) è H+ (o un acido di Lewis) e il nucleofilo non è molto forte
Aldeidi e chetoni: reazioni
I composti carbonilici possiedono una strutturale tendenza ad essere attaccati
dai reagenti nucleofili. A questa proprietà ne possiamo aggiungere un’altra di
carattere generale, la quale riguarda l’insolita acidità degli atomi di idrogeno
legati ai carboni adiacenti al gruppo carbonilico. (idrogeno α)
O H
R C CHR'
O
O
B
R C CHR'
R C CHR'
Quando un protone reagisce con questo anione stabilizzato per risonanza, esso
può interagire con due differenti centri basici.
O
R C C R
H
O
R C C R
H2
Tautomeria cheto-enolica
OH
R C C R
H
Acidi carbossilici
Struttura generale
Gruppo funzionale
Derivati degli acidi
carbossilici
Dove Z potrebbe essere molte cose
Derivati carbossilici
Cloruro acilico
Estere
Amide
Anidride
Gruppo Acilico
Nomenclatura degli acidi
Trovare la catena più lunga di atomi di carbonio
che contiene il gruppo COOH
Sostituire la desinenza –o del nome
dell’idrocarburo con la desinenza –oico ed
anteporre al nome la parola acido
Numerare e nominare le catene lineari o gli altri
sostituenti
Numerare con il numero 1 il carbonio
carbonilico
Nominare e numerare gli altri sostituenti
Cloruri acilici
Il gruppo –OH dell’acido è sostituito con il -Cl
Secondo la nomenclatura si dovrebbe anteporre la parola acido
ma si usa la desinenza –oile anteponendo al composto cloruro
Cloruro butanoile
Cloruro benzoile
Esteri
Propilbutanoato
propile
Da
Anidride dell’acido
Formato dalla combinazione di due acidi
e la perdita di una molecola di acqua
H+ , temperatura
Acido 2-etanoico
Anidride etanoica
Ammidi
O
O
O
C NH2
CH3CH2CH2C NH2
CH3C NH2
Acetammide o
Butanammide
benzammide
etanammide
Se gli idrogeni dell’atomo di azoto ammidico sono sostituiti con gruppi
alchilici, si antepongono al nome dell’ammide di base le lettere N-, o N,Nseguite dal nome dei radicali alchilici
O
CH3C N
CH3
CH3
N,N-Dimetilacetammide
O
CH3C NHC2H5
N-Etilacetammide
Proprietà
Acidi
- Molto polari con punti di ebollizione elevati
- Presenta il legame idrogeno
- Può avere forma dissociata
Proprietà
Derivati
- Cloruri di acidi : nocivi, irritanti, debolmente polari,
reagiscono violentemente con acqua
- Esteri : debolmente polari, gradevole odore, le specie a
basso peso molecolare sono solubili in acqua
- Anidridi di acidi : non sono nè troppo polari nè troppo
acide, si possono decomporre in acqua
-Ammidi : sono in grado di formare forti legami ad
idrogeno, perciò hanno punti di ebollizione e di fusione
elevati.
Fonti degli acidi carbossilici
Fonti naturali
Acido formico – formiche
Acidi a basso peso molecolare – frutti aspri ed agrumi
Acidi grassi – nei grassi, latte e piante oleifere
Acido citrico
Acido lattico
Fonti artificiali
Aldeidi
Agente ossidante
Alcooli primari
Alcool primario
Aldeide
Acido carbossilico
Reazioni di acidi carbossilici
Sono tutti acidi deboli
Dissociazione in acqua
Ione carbossilato
Le Ammine ed i Sali di Ammonio
Ibridizzazione sp3
N
H
H
N
H
H
H
CH 3
H3C
CH 3
H3C
H3C
N
CH 3
Trimetilammina
(un' ammina terziaria)
H3C
H3C
CH 3
Dimetilammina
(un' ammina secondaria)
Metilammina
(un' ammina primaria)
Ammoniaca
N
H
Cl
N +
_
CH 3
Cloruro di Tetrametilammonio
(un sale di ammonio quaternario)
Nomenclatura delle Ammine
CH3
H3C
C
NH2
CH3
terz.Butilammina
NH2
H2NCH2CH2CH2CH2NH2
Cicloesilammina
1,4-Butandiammina
O
NH2
COOH
CH3CH2CHCOOH
4
3
2
NH2
1
H2NCH2CH2CCH3
4
3
21
4-Ammino-2-butanone
Acido 2-Amminobutanoico
NH2
Acido 2,4-Diamminobenzoico
Nomenclatura delle Ammine
H
N
H3CH2C
N
CH2CH3
CH2CH3
Difenilammina
Trietilammina
CH2CH3
H3C
N
H3C
N
CH2CH2CH3
H3C
N,N-Dimetilpropilammina
N-Etil-N-metilcicloesilammina
Nomi Comuni di Alcune Ammine Eterocicliche
N
N
N
N
H
Piridina
Pirrolo
N
H
Imidazolo
N
Pirimidina
N
N
N
Purina
N
H
N
H
N
Chinolina
Indolo
Proprietà delle Ammine
Punti di ebollizione
Composto
CH3CH3
CH3OH
CH3NH2
CH3CH2CH3
CH3CH2OH
CH3CH2NH2
Peso Molecolare
30
32
31
44
46
45
Punto di ebollizione, C
-88.6
65
-6.0
-42
78.5
16.6
La Basicità delle Ammine
RNH2
Keq.=
RNH3+ + OH-
+ H2O
[RNH 3+] [OH-]
[RNH 2] [H2O]
Kb=
pKb = -log Kb
[RNH 3+] [OH-]
[RNH 2]
pKb + pKa = 14
Ammina
Struttura
pKb
pKa (acido coniugato)
Dietilammina
(CH3CH2)2NH
3.06
10.94
Trietilammina
(CH3CH2)3N
3.21
10.79
Etilammina
(CH3CH2)NH2
3.25
10.75
Dimetilammina
(CH3)2NH
3.27
10.73
Trimetilammina
(CH3)3N
3.36
10.64
Metilammina
CH3NH2
4.21
9.79
Ammoniaca
NH3
4.74
9.26
Anilina
PhNH2
9.37
4.63
p-NO2-Anilina
p-NO2-PhNH2
13.0
1.0
Base più Forte
Base meno Forte
Le Reazioni delle Ammine
Formazione dei sali di arendiazonio:
+
N N
NH2
+ HNO2 + H2SO4
Anilina
Acido nitroso
HSO4 - + 2H2O
Bisolfato di benzendiazonio
Le Reazioni dei Sali di Arendiazonio
Sostituzione
+
N N
+
_
Nu
Nu
+ N2
Le Reazioni dei Sali di Arendiazonio
Sostituzione
I
OH
H2O
NaI
+
N
H
N
H3PO2
CuBr
Benzendiazonio
KCN
HCl
CuCN
CN
Br
HBr
CuCl
Cl
Le Reazioni dei Sali di Arendiazonio
La reazione di copulazione:
CH3
+
N
CH3
N
CH3
N CH3
+
Benzendiazonio
N
N
N
N,N-Dimetilanilina
p-(Dimetilammino)azobenzene