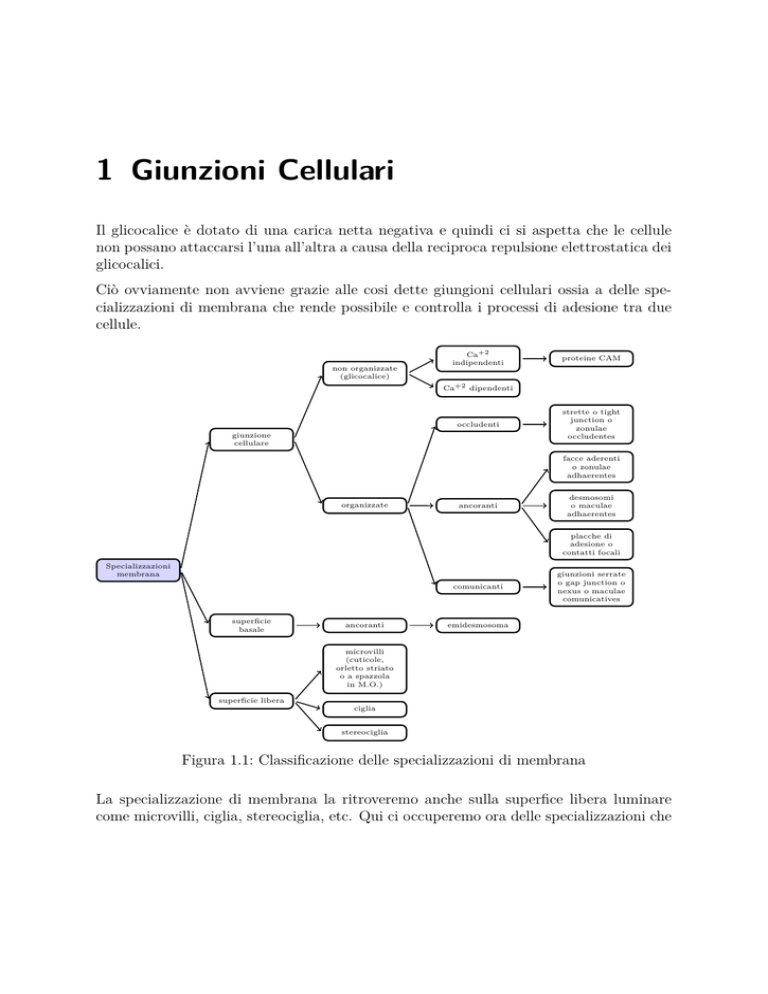
1 Giunzioni Cellulari
Il glicocalice è dotato di una carica netta negativa e quindi ci si aspetta che le cellule
non possano attaccarsi l’una all’altra a causa della reciproca repulsione elettrostatica dei
glicocalici.
Ciò ovviamente non avviene grazie alle cosi dette giungioni cellulari ossia a delle specializzazioni di membrana che rende possibile e controlla i processi di adesione tra due
cellule.
non organizzate
(glicocalice)
Ca+2
indipendenti
proteine CAM
Ca+2 dipendenti
occludenti
giunzione
cellulare
strette o tight
junction o
zonulae
occludentes
facce aderenti
o zonulae
adhaerentes
organizzate
ancoranti
desmosomi
o maculae
adhaerentes
placche di
adesione o
contatti focali
Specializzazioni
membrana
comunicanti
superficie
basale
ancoranti
giunzioni serrate
o gap junction o
nexus o maculae
comunicatives
emidesmosoma
microvilli
(cuticole,
orletto striato
o a spazzola
in M.O.)
superficie libera
ciglia
stereociglia
Figura 1.1: Classificazione delle specializzazioni di membrana
La specializzazione di membrana la ritroveremo anche sulla superfice libera luminare
come microvilli, ciglia, stereociglia, etc. Qui ci occuperemo ora delle specializzazioni che
1.1. CLASSIFICAZIONE DELLE CLASSI DI ADESIONE
2
rendono possibile l’adesione cellulare e quelle che legano la cellula alla membrana basale
e alla matrice extracellulare.
La figura 1.1 riassume le classificazioni delle varie specializzazioni di membrana.
1.1 Classificazione delle classi di adesione
Esistono due classi di contatti adesivi tra le cellule. Quelle non organizzate e quelle
organizzate
1.1.1 Adesione tramite strutture non organizzate o non giunzionale
Una prima classe composta da strutture non organizzate distribuite sulla superficie
cellulare e sul glicocalice. Si suppone che l’adesione cellulare non giunzionale sia un
prerequisito per la formazione dei sistemi giunzionali classici.
Fanno parte dei sistemi di adesione non giunzionale quelli calcio dipendenti e calcio
indipendenti.
Adesione calcio indipendente
Le molecole di adesione calcio-indipendenti sono chiamate proteine CAM (cell adhesion
molecoles) e sono formate da proteine transmembrana che esterne ad essa o addirittura
estrinseche, ne esistono di tipi diversi in tessuti diversi e inoltre possono essere in grado
di legare anche le integrine.
Esse hanno usualmente un imponente dominio extracellulare, un α–elice inclusa nella
membrana e un corto o mancante dominio citoplasmatico.
Rappresentano delle struttue simili alle gammaglobuline.
Adesione calcio dipendente
Le calcio-dipendenti, invece, fanno uso di tre tipologie di proteine: caderine, integrine,
selectine.
Le caderine, riscontrabili anche in giunzioni di tipo specializzato, sono una classe di
proteine transmenbrana altamente glicosilate, formano legami intercellulari forti intrecciandosi con le protrusioni di caderine provenienti da altre cellule, mentre a livello della
loro membrana plasmatica, dalla quale traggono origine, si ancorano al citoscheletro
cellulare, in particolare a filamenti di actina e a filamenti intermedi, per mezzo di una
proteina: la catenina.
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
1.1. CLASSIFICAZIONE DELLE CLASSI DI ADESIONE
3
Le selectine sono presenti nelle cellule dotate di movimento e negli endoteli vascolari
poiché esse sono in grado di creare legami in grado di scorrere l’uno rispetto all’altro,
spesso sono coadiuvate dalle integrine; per esempio, i leucociti che legano per l’appunto
gli endoteli vascolari.
Le integrine infine mediano i legami soprattutto del tipo cellula-matrice; di quest’ultime,
oltre che di calcio-dipendenti, ne esistono di magnesio-dipendenti.
Una delle proteine ponte tra superficie cellulare e matrice extracellulare è la fibronectina
che non appartiene al glicocalice e dalla funzione molto complessa.
La fibronectina è una glicoproteina ad alto peso molecolare costituita da due catene
identiche di circa 220 kD unite tra loro da ponti disolfuro.
Ha una estremità che presenta un’alta affinità per le glicoproteine integrali di membrana
dette anche recettori per la fibronectina mentre la restante parte della molecola, ricca di
catene laterali oligosaccaridiche, ha affinità per il GAG extracellulari e per il collagene.
I recettori per la fibronectina oltre a quelli per altri componenti della matrice extracellulare sono, nel complesso, indicate sotto il nome di integrine.
1.1.2 Adesione tramite strutture organizzate o giunzione classica
La seconda classe, invece, è composta da complessi di adesione specializzati, in cui è possibile riconoscere strutture organizzate a livello funzionale. Nei vertebrati si distinguono
in tre tipi:
• Giunzioni occludenti (in latino zonulae occludentes, in inglese tight junctions)
• Giunzioni comunicanti (gap junctions)
• Giunzioni aderenti o di ancoraggio (zonulae adhaerentes, anchoring junctions; nel
caso particolare dei desmosomi si dicono maculae adhaerentes)
A seconda, invece, dell’estensione sulla membrana si distinguono tra:
• A fascia o ’zonulae’: una zonula è una giunzione perimetrale che coinvolge una
banda che circonda la cellula e consente l’adesione completa di tutta la superficie
in cui è presente
• Circoscritte o ’maculae’: le maculae sono dei dispositivi funzionali di forma rotonda
o ovale che occupano una porzione circoscritta della superficie del plasmalemma.
Analizzeremo ora, nel dettaglio questi tipi di giunzioni
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
1.2. GIUNZIONI OCCLUDENTI
4
Figura 1.2: Giunzioni cellulari principali
1.2 Giunzioni occludenti
Le giunzioni occludenti (giunzioni strette o tight o zonulae occludentes) impediscono il
passaggio dei fluidi tra le cellule andando a formare attorno al perimetro cellulare una
cintura continua detta zonula. Sono particolarmente presenti negli epiteli di rivestimento
(es.pelle) e negli epiteli intestinali per far sı̀ che non filtrino sostanze tra i vari ambienti.
Nelle giunzioni occludenti gli spazi interstiziali sono annullati in corrispondenza dei punti
nodali (strands); punti in cui i lembi di membrana che si affrontano sono saldamente
coesi. La totalità delle membrane adiacenti è percorsa da ripetute serie di tali punti,
sicché i lembi di membrana appaiono anastomizzati tra loro.
Due sono le principali proteine integrali di membrana coinvolte: Claudina e Occludina,
che sporgono sulla faccia esterna delle membrane e sono tra loro unite da legami non
covalenti. Queste due proteine formano una cintura intorno alla cellula che nemmeno le
proteine di membrana possono attraversare, dividendola quindi in due o più domini.
Al microscopio elettronico quindi la zonula occludens appare come una struttura a tre
binari elettrondensi: i due più esterni sono rappresentati dagli strati fosfolipidici più
interni delle due cellule coinvolte nella giunzione, quello più interno è dato dalla fusione
dei due strati fosfolipidici esterni delle due cellule.
Di conseguenza la membrana cellulare nel suo insieme, a livello della giunzione occludente, assume un aspetto pentalaminare in quanto le tre bande elettrondense sono
intercalate a bande elettron–trasparenti.
A seconda del momento o del tipo di epitelio vi possono essere 1-2 punti nodali o fino a
8-10 bande. Nel primo caso la giunzione è detta leakly ed è parzialmente permeabile o
lassa, nel secondo tight o chiusa.
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
1.3. GIUNZIONI ADERENTI
5
Figura 1.3: Schema di una giunzione occludente.
Le giunzioni occludenti svolgono una funzione sigillante, uniscono le due cellule adiacenti
senza lasciare interstizi, in modo che le molecole idrosolubili non filtrino facilmente
tra una cellula e l’altra. Sono localizzate generalmente all’apice di cellule polarizzate
come quelle dell’epitelio intestinale e impediscono alle molecole presenti, ad esempio,
nel lume dell’intestino di valicare la lamina cellulare; se una molecola deve passare dal
lume intestinale all’interno dell’organismo o passare da cellula a cellula deve sottostare
necessariamente all’azione di vaglio dei dispositivi della cellula.
Tight junctions si trovano anche nell’epitelio pavimentoso non cheratinizzato dell’esofago
umano.
Le tight junctions appaiono evidenti, insieme alle zonulae adaerentes durante le infiammazioni come tentativo dell’epitelio di aumentare le proprie difese contro le sostanze
tossiche presenti nel lume dell’organo che riveste.
1.3 Giunzioni aderenti
Le giunzioni aderenti (ancoranti, di ancoraggio) interessando sia punti di ancoraggio
intercellulari che tra cellula e matrice extracellulare, forniscono un supporto strutturale
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
1.3. GIUNZIONI ADERENTI
6
ai tessuti, come ad esempio i muscoli e le cellule dell’epidermide, andando a costituire
nel tessuto un dispositivo tramite cui le forze applicate si scompongono secondo tante
direttrici. In tale tipo di giunzione, le membrane non sono adese come nella occludente
ma separate da uno spazio di 15 – 20 nm.
Figura 1.4: Schema di una giunzione aderente.
Essa sfrutta i filamenti actinici, differenziandosi in due tipi: le fasce di adesione (fascia
adhaerens) e le zone di adesione (zonula adhaerens); le fasce d’adesione sono collegamenti che si stabiliscono tra una cellula e l’altra adiacente, grazie alle Caderine, proteine
strutturali che sporgono nello spazio interstiziale delle cellule e si uniscono intersecandosi fra loro, mentre dal lato delle membrane cellulari sono legati ai filamenti actinici del
citoscheletro tramite proteine transmembrana che fungono da ponte, quali le vincoline,
le alpha-actine e le catenine (alpha, beta, gamma).
Esse formano zona di adesione continua immediatamente sotto alle tight junctions. La
Fascia adherens è simile alla zonula adherens ma meno estesa. Nelle giunzioni aderenti
i due lembi di membrana che si affrontano corrono parallelamente tra loro e lo spazio
interstiziale ha uno spessore di 15-25 nm.
1.3.1 Desmosomi
Un desmosoma, o macula adhaerens è una giunzione di natura proteica tra cellule epiteliali adiacenti che salda i rispettivi citoscheletri (in particolare i filamenti intermedi)
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
1.3. GIUNZIONI ADERENTI
7
donando al tessuto di cui le cellule fanno parte resistenza alla trazione ed altri traumi
fisici.
Sono le giunzioni cellulari più conosciute perché al microscopio elettronico hanno una
configurazione caratteristica ed erano già visibile in microscopia ottica, specialmente nel
tratto spinoso dell’epidermide, descritti sotto il nome di noduli di Bizzozero.
Essi hanno infatti un notevole spessore di 0, 1 . . . 0, 2 µm e può occupare una zona di
membrana anche di 1 µm.
Figura 1.5: Schema di un desmosoma.
Immediatamente sotto la membrana plasmatica appare una zona marcatamente elettrondensa: essa è costituita da un addensamento di materiale proteico citoplasmatico
che viene definito placca di adesione (formata dalle desmoplachine e dalle placoglobulina) cui convergono i filamenti intermedi del citoscheletro (principalmente filamenti di
vimentina o cheratina negli epiteli, questi ultimi detti anche tonofilamenti), che si legano
lateralmente alla placca di adesione per poi ricurvare con un andamento che può essere
paragonato a quello di un arco a tutto sesto.
Nello spazio interstiziale, dello spessore di 20 . . . 30 nm, compare una linea mediana
elettrondensa determinata da proteine calcio-dipendenti (Caderine) quali desmocollina
e desmogleina che si legano alla placca di adesione e alle loro omologhe in modo analogo
rispetto a quanto descritto sopra per le giunzioni aderenti. Come le giunzioni aderenti, i desmosomi assolvono prevalentmente a funzioni meccaniche: grazie al decorso dei
filamenti intermedi, le forze conseguenti a insulti meccanici vengono ben scaricate nel
tessuto.
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
1.3. GIUNZIONI ADERENTI
8
Il desmosoma si lega ai filamenti intermedi, fatti di cheratina, tramite una placca citoplasmatica composta da tre proteine chiamate desmoplachina I, II e placoglobina, che
legano anche le proteine integrali di membrana desmocollina e desmogleina, alle quali spetta il compito di legarsi a proteine analoghe su di un desmosoma della cellula
adiacente.
Le proteine costituenti il desmosoma si possono classificare in base alla loro localizzazione. Pertanto si distingue una componente proteica citoplasmatica, una trans–membrana
ed una extracellulare. I desmosomi si legano ai filamenti intermedi attraverso strutture
proteiche citoplasmatiche quali: desmoplachine, proteine che si legano direttamente ai
filamenti intermedi; placo globine, proteine che si legano direttamente a delle placofiline
ed entrambe sono strettamente collegate alla desmoplachina. Pertanto il legame con i
filamenti intermedi è mediato da queste tre proteine.
Il legame extracellulare e quindi con la cellula adiacente avviene ad opera di proteine
appartenenti alla famiglia delle caderine quali in particolare: desmogleina e desmocollina. Tali proteine sporgono dalla membrana plasmatica verso la matrice extracellulare
entrando in mutuo contatto con le strutture omologhe adiacenti.
I filamenti intermedi legati dalle desmoplachine possono variare in base al sito in cui ci
si trova: nelle cellule epiteliali i microfilamenti legati alle desmoplachine sono principalmente le tono fibrille di cheratina, se ci si sposta in un cardiomiocita allora si vedrà come
il filamento intermedio sia costituito da desmina, mentre nel caso del sistema linfatico
sarà la vimentina il componente principale del filamento intermedio.
Come per tutte le caderine, essendo queste calcio–dipendenti, esse possono essere inattivate da una drastica riduzione di calcio extracellulare.
Per la loro struttura i desmosomi sono permeabili ai liquidi.
Essi si trovano principalmente negli epiteli delle vie respiratorie, di quelle gastro–intestinali
e di quelle uro–genitali.
La loro funzione è confermata dal penfigo, una malattia cutanea caratterizzata da bolle a
causa della perdita di adesione tra le cellule epiteliali dovuta alla produzione di anticorpi
contro le desmogleine ed in cui, quindi, l’adesione trai cheratinociti è compromessa.
1.3.2 Emidesmosomi
Gli emidesmosomi, che visti al microscopio elettronico appaiono morfologicamente simili a mezzo desmosoma, sono in realtà molecolarmente, e funzionalmente, alquanto
diversi da essi. Negli emidesmosomi, come nei desmosomi, le desmoplachine si legano
principalmente ai filamenti intermedi, ma le proteine di membrana coinvolte non sono
caderine, bensı̀ integrine che, mediante altre molecole-adattatore, si legano con le fibre
della lamina basale ancorando e incollando il tessuto epiteliale alla lamina basale.
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
1.4. PLACCHE DI ADESIONE
9
1.4 Placche di adesione
Le placche di adesione sono regioni del plasmalemma specializzate nell’adesione alla
matrice extracellulare. Esse si trovano in aree membranose ristrette, da cui la denominazione alternativa di contatti focali, ove si attua la connessione tra l’actina, componente
principale dei microfilamenti del citoscheletro, e la matrice extracellulare.
Il collegamento è simile al caso delle giunzioni aderenti. Anche in questo caso i filamenti
di actina non interagiscono direttamente con la proteina trans–membrana, una integrina, ma, raccolti in fasci dall’α-actina, interagiscono con altre proteine che ne mediano
l’unione.
Da studi effettuati sull’affinità tra α-actina e le altre proteine interessate sembra che
essa si leghi alla tensina e all’HA1. Queste hanno poi affinità con la vincolina che sa
come legare la talina che infine lega l’integrina secondo lo schema
Figura 1.6: Schema interazioni tra proteine in giunzione comunicante.
Infine l’integrina, proteina trans–membrana, sporgendo all’esterno, riesce a legarsi e connettersi con le proteine fibrose della matrice extracellulare quali fibronectina, laminina
e collagene.
Strutture simili alle placche di adesione si trovano, ad esempio, nei podosomi presenti
negli osteoclasti che rappresentano le zone dove queste legano alla matrice ossea da
distruggere.
1.5 Giunzioni comunicanti
Le giunzioni comunicanti (o serrate o nexus o gap) possiedono canali proteici detti
connessoni, che si aprono in risposta a determinati segnali chimici quali modificazioni
del pH o della concentrazione degli ioni calcio, consentendo il passaggio di ioni o molecole
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
1.5. GIUNZIONI COMUNICANTI
10
di basso peso molecolare (fino a 1 kDa) tra due cellule. Quindi elevate concentrazioni di
calcio o pH bassi tendono a chiudere la giunzione.
Figura 1.7: Schema di una giunzione comunicante.
I connessoni sono presenti su entrambe le facce delle membrane cellulari formando un’unica struttura con poro centrale; essi sono composti da un anello di sei monomeri di
proteine integrali transmembrana, per faccia cellulare, dette connessine, di 7-8 nm di
lunghezza, che si aprono e chiudono con un meccanismo simile a quello del diaframma
di una macchina fotografica, in senso levogiro (antiorario).
Le unità esagonali sporgono all’esterno della membrana cellulare che, nel caso di una
gap junction, è dell’ordine di 2 . . . 4 nm.
Il lume del connessone, in condizioni normali, ha un diametro di 2 nm. In esso le due
porzioni del connessone aderiscono tra loro formando un canale che permette anche
l’accoppiamento elettrico tra due cellule. In una giunzione comunicante il numero di
connessoni varia da poche decine a qualche centinaio, con disposizione regolare.
La differente struttura delle connessioni in differenti strutture cellulari, da 24 a 46 kD
e il fatto che alcune cellule esprimono un’unica connessina mentre altre una miscela,
rende conto che la perfetta connessione delle gap junctions può avvenire solo tra cellule
accumunate da ruoli biologici sovrapponibili.
Quindi, oltre alla funzione di trasporto, di uniformità di concentrazioni ioniche, trasporto
del segnale, esse possono essere anche correlate al differenziamento dei tessuti.
Già infatti allo stato di morula, tutte le cellule sono collegate da ga junctions. Probabilmente queste giunzioni sono anche in relazione all’accrescimento cellulare tant’è che
cellule tumorali non hanno praticamente nessun gap junction con altre cellule.
Questo tipo di giunzioni sono presenti nel tessuto muscolare liscio e ne tessuto cardiaco
mentre sono assenti in quello scheletrico in quanto qui, il segnale nervoso, è diffuso
direttamente ad ogni cellula, da singole terminazioni nervose.
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
2 Sintesi proteica
2.1 I ribosomi
I ribosomi sono organuli citoplasmatici che, per il loro contenuto di RNA, sono responsabili della proprietà basofila del citoplasma.
In microscopia ottica sono appunto visibili solo quando sono presenti in gran numero
come nelle cellule nervose. La loro dimensione è infatti dell’ordine dei 15 . . . 30 nm.
Essi si trovano liberi nel citoplasma o adesi al reticolo endoplasmatico conferendogli il
carattere, in microscopia ottica, di rugosità.
Nell’uno o nell’altro caso, quando sono attivi, si associano in gruppi detti poliribosomi
o polisomi sotto forma di anelli di perle a rosetta, a spirale o a elica.
Tra i ribosomi del polisoma si osserva un sottile filamento di 1 · · · 2 nm interpretato come
mRNA visto che il filamento viene liso dalle ribonucleasi.
I ribosomi sono formati da due unità: una subunità maggiore e una minore e il filamento
di mRNA risulta incastrato tra le due subunità tantè che, utilizzando la ribonucleasi,
◦25 nucleotidi sono protetti dall’azione di questo enzima.
I ribosomi legati al RER vi si uniscono tramite la subunità maggiore e la giunzione è
parallela alla membrana del RER.
I ribosomi sono la sede della sintesi proteica.
I ribosomi liberi nel citoplasma sono la sede di produzione delle proteine strutturali ed
enzimatiche destinate a rimanere nella cellula come elementi citoplasmatici mentre quelli
adesi al RER sono deputati alla sintesi di proteine di secrezione, di membrana e liposomiali. Ecco perché le prime sono presenti principlamente nei linfociti, negli eritroblasti,
nei reticolociti, nelle fibre muscolari mentre i secondi sono presenti principalmente nelle
cellule ghiandolari a secrezione esterna, nelle plasmacellule e nelle cellule nervose.
I ribosomi isolati hanno una struttura, dimensione e composizione uniforme in tutti gli
elementi cellulari e sono formati da proteine e rRNA, sintetizzato nel nucleolo, con un
rapporto, in peso, di 1:1 negli eucariotici e di 2:1 a favore dell’RNA nei procariotici.
Nei ribosomi dei procariotici la costante di sedimentazione delle due subunità è di 50S
e 30S mentre la versione attivata ha costante di sedimentazione di 70S. Negli eucariotici
le costanti sono rispettivamente 60S, 40S e 80S.
2.2. TIPOLOGIE DI RNA
12
Nei 70S vi sono 3RNA, una subunità minore e due in quello maggiore mentre l’80S
ha quattro rRNA, una nella subunità minore e tre in quella maggiore. L’rRNA ha un
contenuto di basi G-C maggiore di basi A-U e, oltre alle quattro basi classiche, contiene
anche versioni metilate oltre a una pseudouridina e metilribosio.
Le proteine ribosomiali sono quasi tutte basiche. Il ribosoma 70S contiene circa 55
proteimne mentre l’80S ne contiene oltre 70.
Sia le cellule eucariotiche che quelle procariotiche contengono inoltre, nel ribosoma, un
piccolo RNA di 5S che si suppone abbia il compito di legare il tRNA.
La modalità di interazione tra rRNA e proteine ribosomiali è poco conosciuta ma esse
sono sicuramente intimamente connesse.
2.1.1 Morfologia del ribosoma
Il modello di ribosoma prevede un’unità minore formata da una testa globulare unita
ad un corpo da un collo stretto.
Lateralmente al corpo vi è una sporgenza detta piattaforma che crea una fessura (cleft)
dove, probabilmente, avviene l’interazione codone anticodone durante la sintesi proteica.
Quella maggiore ha una corma di corona con tre protuberanze, una centrale voluminosa
detta naso e due laterali, una più piccola e una più estesa detta stelo lunga circa 10nm
e di 4 nm di diametro.
Rimuovendo il substrato proteico la morfologia resta pressoché inalterata sintomo che
lo scheletro del ribosoma è formato principalmente dall’rRNA.
L’unione delle due subunità crea quattro zone o siti di legame, una per l’mRNA e 3
per il tRNA. La struttura del ribosom permette quindi di tenere lo stampo dell’mRNA
allineato con le molecole di amminoacil–tRNA e la catena polipeptidica in corso di
sintesi.
Le molecole di tRNA si attaccano ai siti di legame E,P e A presenti nella subunità
maggiore. Il sito P (polipetidico) è occupato da tRNA che porta l’intera catena polipeptidica coesa, il sito A (amminoacil) lega l’amminoacil–tRNA che porta l’amminoacido
successiva nella catena e il sito E (exit) è il sito di uscita del tRNA che ha lasciato
l’amminoacido sulla catena in sintesi.
L’mRNA passa in un solco formato dall’unione delle due subunità.
2.2 Tipologie di RNA
Esistono principalmente 3 tipi di RNA: mRNA, tRNA e rRNA.
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
2.3. IL CODICE GENETICO
13
L’RNA messaggero (mRNA) è un singolo filamento praticamente non avvolto che
porta l’informazione per la sintesi proteica dal nucleo dove l’ha trascritto dal DNA al
ribosoma dove verrà tradotto in proteina.
Gli RNA di trasferimento (tRNA), circa 45, consistono in un singolo filamento che,
a causa di isolati legami idrogeno tra basi complementari, si ripiega su se stesso fino ad
assumere, sul piano, una forma tipica a quadrifoglio. Ogni tRNA si lega ad un singolo e
specifico amminoacido e lo trasporta al ribosoma. É la molecola che traduce il linguaggio
dei codoni a tre lettere nel linguaggio degli amminoacidi.
Gli RNA ribosomiali (rRNA) hanno forma globulare e rappresentano porzioni importanti della struttura dei ribosomi con funzioni catalitiche essenziali per la sintesi
proteica.
Esistono poi altri RNA minori tra cui gli:
• scRNA (small cytoplasmic) tra cui l’scRNA 7S che assieme a 6 proteine, partecipa alla formazione dell’SRP (Signal Recognition Particel) responsabile del
riconoscimento tra ribosoma e RER,
• gli hnRNA (heterogeneous nuclear) precursori nucleari degli RNA citoplasmatici,
• RNA primer che viene usato come primo elemento nella duplicazione del DNA
per sopperire al fatto che la DNA polimerasi può aggiungere elementi solo dNTP
(deossiribonucleotidi) al gruppo 3’-OH
• snRNA (small nuclear) che partecipano alla maturazione degli RNA citoplasmatici
come la rimozione degli introni
• siRNA (small interference) che controlla l’espressione genica mediante soppressione
selettiva dei geni
• snoRNA (small nucleolar) che processa pre-mRNA nel nucleolo durante la produzione delle subunità ribosomiali
• miRNA (micro) che inibisce la produzione degli mRNA coinvolti nella sintesi degli
ormoni della crescita e dello sviluppo.
2.3 Il codice genetico
Nella metà degli anni 50 divenne evidente, dimostrando che alterazioni di un sito del
DNA comportava alterazioni in una determinata proteina, come il DNA rappresentava
il punto di partenza per la sintesi proteica.
Con la scoperta della struttura a doppia elica del DNA, negli stessi anni, divenne altrsi
evidente come il linguaggio della sintesi proteica fosse da ricercare nella combinazione
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
2.3. IL CODICE GENETICO
14
delle quattro lettere delle basi azotate che la compongono: le due purine, Adenina e
Guanina, e le due pirimidiniche, Citosina e Timina.
Essendo gli amminoacidi venti si suppose che ogni amminoacido fosse definito da una
combinazione di tre basi, dette codone.
L’evidenza sperimentale avvenne con la costruzione di mRNA con sequenze note che
portarono sempre alla formazione di un dato amminoacido.
Ad esempio, la sequenza
5’–UUU–3’
porta sempre alla formazione della fenilalanina.
Per convenzione le sequenze sono sempre relative alla sequenza di basi sull’mRNA che è
formato a partire dallo zuccero 5’ a quello in 3’. La sequenza sugli anticodoni del tRNA
o sul DNA sono quindi complementari.
Ad esempio
5’–AUG–3’ sul mRNA
3’–UAC–5’ sul tRNA
3’–TAC–5’ sul DNA
che genera la sintesi della metionina.
Essendo il numero di combinazioni di quattro lettere prese tra a tre pari a 64 ed essendo
il numero di amminoacidi pari a 20 appare subito evidente come diverse sequenze di
codoni codificano gli stessi amminoacidi. Usualmente si osserva che la differenza è spesso
nell’ultima base del codone che quindi tende a non avere significato per la codifica
dell’amminoacido e, ove per cui, mutazioni di tale elemento non compromette la corretta
sintesi della proteina.
Ad esempio UUU e UUC codifica sempre la fenilalanina ma occhio che invece UUA
e UUG codificano invece la luicina che è poi codificata anche dall’intera famiglia CU*,
quindi una regola generale non esiste anche se la tabella di codifica codone ⇔ è pressoché
universale.
Questa proprietà è detta degenerazione del codice genetico.
Questo porto all’ipotesi del vacillamento del tRNA ossia all’idea che questa degenerazione fosse l’aspetto, lato mRNA che il 3 nucleotide dell’anticodone del tRNA, quello
alla sua estremità 5’, potesse formare legami idrogeno con più di una base nella terza
posizione dell’mRNA.
Questo vacillamento fa si che vi siano varie forme accettabili di appaiamenti tra mRNA
e tRNA durante la sintesi.
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
2.4. I PROCESSI DELLA SINTESI PROTEICA
15
Un’altra cosa interessante che fu osservate è che tre sequenze, UAA, UAG e UGA, non
codificano alcun risultato e vennero correttamente interpretate come codoni di stop o
terminali della sintesi.
Risultò altresı̀ che ogni sintesi proteica iniziava sempre con la sequenza AUG che corrisponde alla metionina negli eucariotici e alla formilmetionina nei procariotici anche se
poi questo amminoacido, se la proteina non doveva iniziare con questo elemento, veniva
rimosso dall’enzima deformilasi.
2.4 I processi della sintesi proteica
La sintesi proteica è il risultato di alcuni processi chiave
1. trascrizione
2. maturazione
3. trasporto
4. attivazione degli amminoacidi
5. traduzione
6. modificazioni post–traduzionali
In breve, un gene del DNA viene convertito in pre–mRNA, un tipo di hnRNA che, una
volta maturato (splicing, capping e poliadenilazione) diviene mRNA attraversando la
membrana nucleare e legandosi ai ribosomi.
Parallelamente, nel citoplasma, gli amminoacidi si legano al tRNA che, avvicinandosi al
ribosoma, si lega con una reazione codone–anticodone sull’mRNA. L’amminoacido ad
esso legato si lega alla catena polipeptidica in via di formazione allungandola.
Entriamo ora nel dettaglio di ogni singolo passaggio.
2.5 Trascrizione
Il primo passaggio della sintesi proteica dal DNA, all’RNA fino al polipeptide è la
trascrizione di una sequenza di DNA contenente un gene in una sequenza di RNA.
La maggio parte degli RNA è sintetizzata grazie ad una della tre RNA–polimerasi.
La RNA–polimerasi I catalizza la sintesi di quasi tutti gli rRNA; la RNA–polimerasi
II catalizza la sintesi degli mRNA e la RNA—polimersi III catalizza la sintesi degli
tRNA e del 5S degli rRNA.
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
2.6. MATURAZIONE
16
La RNA–polimerasi, da uno stampo di DNA, localizza dei promotori sulle sequenze di
DNA lette dal filamento 3’−→5’. Riconosciuto il corretto promotore l’RNA–polimerasi,
utilizzando una RNA–elicasi, srotola il DNA ma non inizia subito la sua trascrizione.
Durante la lettura, circa 25 coppie di basi a monte del codone di start della sequenza genica, si trova una sequenza costituita da circa 8 basi A-T detta TATA BOX, circondata
da sequenze ricche di G-C.
Una proteina del gruppo dei fattori di trascrizione (ossia a quelle proteine capaci di
legarsi a brevi sequenze di DNA nelle regioni regolative dei promotori), la TFIID (fattore
di trascrizione della RNA–polimerasi II), si lega alla TATA BOX e attiva la trascrizione
della polimerasi. Questo rappresenta l’inizione della trascrizione dell’RNA messaggero.
Come si vede, al contrario della DNA–polimerasi, l’RNA–polimerasi non richiede un
primer RNA.
La trascrizione avviene inserendo il primo nucleotide che mantiene tutti e 3 i gruppi fosfati sul 5’ e aggiungendo gli altri sui gruppi ossidrili in 3’ utilizzando l’energia dell’idrolisi
di 2 gruppi fosfati del nucleotide che viene aggiunto.
La trascrizione prosegue quindi duplicando il codone di start e proseguendo fino al codone
di stop. Nei procariotici, raggiunto tale codone l’mRNA si stacca dalla RNA–polimerasi,
completanto la sequenza di trascrizione. Negli eucariotici, la trascrizione prosegue oltre
separandosi dalla polimerasi solo dopo circa 10 . . . 35 nucleotidi a valle di tale segnale.
In definitiva il pre-mRNA cosi prodotto ha una cosi detta sequenza leader iniziale che
contiene la codifica dei TATA BOX utili per l’allineamente e il legame con il ribosoma,
il codone di inizio AUG, i codoni degli amminoacidi del polipeptide da sintetizzare
mischiati agli introni (vedi splicing dopo), i codoni di stop UAA, UGA e/o UAG e una
sequenza di trailing fino al 3’.
2.6 Maturazione
Dopo la trascrizione e prima di poter abbandonare il nucleo, il pre-mRNA subisce la cosi
detta maturazione che consta di queste fasi
• capping
• splicing
• poliadenilazione
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
2.6. MATURAZIONE
17
2.6.1 Capping
Gia durante la trascrizione, quando l’mRNA è lungo solo una trentina di nucleotidi,
inizia un processo che porta l’aggiunta, all’estremità 5’, di un nucleotide insolito, la
7-metilguanosina che viene legato all’mRNA attraverso tre gruppi fosfato.
Probabilmente il 5’ cap protegge l’mRNA da una precode degradazione. Nei procariotici
che infatti non hanno tale processo, la vita media dell’mRNA nel citoplasma è di soli 2
minuti mentre nei mammiferi è di circa 10 ore.
Inoltre i ribosomi eucariotici non si legano a mRNA senza 5’ cap.
[aggiumngere immagine cercando 5’ cap structure su google images]
2.6.2 Poliadenilazione
Al termine della trascrizione, nei pressi dell’estremità 3’, si viene trovare un lungo
segmento di 20 . . . 250 nuclotidi adeninici. Tale coda è detta poliadenilata (poli-A).
Entro un minuto dal termine della trascrizione, uno specifico segmento AAUAAA viene
riconosciuto dall’enzima poliadenilato polimerasi che taglia il pre-mRNA circa 11 . . . 30
basi a valle di tale sequenza e la coda tranciata viene quindi unita alla molecola di poli-A.
A tale sequenza si associano poi, ogni 10 . . . 20 basi della coda poli-A, dei monomeri di
PABP (poliA–binding protein) creando cosi una catena di numerose unità proteiche il
cui ruolo è ......
Sembra che la poliadenilazione abbia il compito di facilitare l’uscita dell’mRNA dal
nucleo, proteggendo poi lo stesso dalla degradazione e favorendo il riconoscimento dell’mRNA da parte dei ribosomi.
2.6.3 Splicing
Un gene del DNA ha sequenze di basi che non codificano amminoacidi della proteina
finale. Tali regioni sono chiamate introni (sequenze interposte) al contrario dagli esoni
(sequenze espresse). Il pre-mRNA rispecchia dunque tale struttura.
Per diventare mRNA è necessario rimuovere le sequenze introniche e, dopo tali tagli, i
pezzi di mRNA devono essere riuniti insieme.
A tale processo si da il nome di splicing. Lo splicing avviene grazie ad un elemento
nucleare detto spliceosoma, delle dimensioni circa di un ribosoma, formato da 5 snRNA
dette U1, U2, U4, U5, U6.
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
2.7. TRASPORTO
18
U1 ha una sequenza complementare alla sequenza lato 5’ dell’inizio di ogni introne, U2 ha
la sequenza complementare per il termine dell’introne mentre U4, U5 e U6 provvedono
a riunire i due pezzi divisi.
Alcuni tipi di introni hanno una capacità di autosplicing senza interventi di spliceosomi
o enzimi.
2.7 Trasporto
In seguito alla maturazione del pre-mRNA in mRNA esso viene trasportato attraverso
il poro nucleale nel citosol per incontrare il ribosoma legandosi ad almeno 20 diverse
proteine e diventando cosi mRNP. Il trasporto dell’mRNP attraverso il poro nucleare avviene grazie al complesso esportatore dell’mRNA detto NXT1 che si collega alle
RanGTP che, legandosi al 5’ cap, aiuta l’uscita.
Esperimenti hanno effettivamente dimostrato che ad uscire dal poro è infatti prima la
testa 5’ cap e poi la coda poli-A.
2.8 Attivazione degli amminoacidi
Mentre l’mRNA si sta sviluppando nel nucleo, parallelamente e indipendentemente, un
altro importante processo si sta realizzando nel citoplasma. Gli amminoacidi ivi presenti
non hanno la più pallida idea di cosa sia un codone e quindi non avrebbero modo ne di
agganciarsi ne tantomeno di farlo in maniera controllata secondo la sequenza trascritta
nell’mRNA.
Affinché ciò possa avvenire made natura ha dovuto dotarsi di un interfaccia tra il linguaggio degli mRNA, i codoni, e i 20 amminoacidi. Tale interfaccia è una molecola di
tRNA.
Il tRNA ha forma, sul piano, di un quadrifoglio con una foglia mancante nel sito dove
inizia (3’) e finisce (5’) il tRNA.
Il ramo 3’ sopravvanza il 5’ di 3 amminoacidi nella sequenza 3’–ACC... ed è proprio
a questa estremità che si legherà un bene determinato amminoacido. proseguendo lungo la sequenza, troviamo una prima ansa (la foglia del quadrifoglio) denominata D
perchè contiene un diuracile, che legherà l’enzima che coadiuverà l’associazione tRNA
con l’amminoacido. L’ansa opposta a quella monca contiene l’anti–codone ossia la sequenza complementare di quella sull’mRNA di sintesi dell’amminoacido che l’ansa D ha
fatto legare in 3’. Infine un’ultima ansa detta T in quanto contiene ???timina che sarà
quella a legarsi al ribosoma.
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
2.8. ATTIVAZIONE DEGLI AMMINOACIDI
19
Ricordiamo qui che alcuni codoni sono riconosciuti da più tRNA e che questa è alla base
del vacillamento del codice genetico.
Come avviene quindi l’associazione tra un dato amminoacido e un dato tRNA che contiene appunto l’anti-codone complementare al codone che sull’mRNA richiede la sintesi
proprio di questo amminoacido?
Tramite il processo detto di attivazione a cui partecipano il tRNA, l’amminoacido, una
molecola di ATP e un enzima: l’amminoacil-RNA sintetasi.
Questo enzima ha tre siti principali. Il primo sito lega l’ansa D di un tRNA, un secondo
sito lega l’ATP e il terzo sito lega uno tra i 20 amminoacidi.
Nel sito 2 e nel sito 3 l’enzima lega un ATP e l’amminoacido che subito si lega all’ATP,
idrolizzando e liberando due gruppi fosfati (pirofosfato) e formando cosi un amminoacil–
adenilato. Nel sito 1 va a posizionarsi un adeguato tRNA che trova il gruppo iniziale
3’ che inizia proprio per l’adenina. Tale adenina interferisce con l’adenina dell’AMP
scacciando tale molecola e sostituendosi ad essa nel legame con l’amminoacido. A questo
punto l’amminoacil-tRNA neoformata è libera di lasciare l’enzima.
Affinché questo processo funzioni è quindi necessario che l’ansa D del tRNA debba essere
strutturalmente correlata con l’anticodone, devono esistere differenti amminoacil-RNA
sintetasi con diverse configurazioni per i siti 1 e 3 ma di modo che se in un si può
associare un determinato tRNA con un anticodone per un determinato amminoacido,
allora sul sito 3 deve potersi legare solo e soltanto quel particolare amminoacido.
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
3 Lezione del 23.04.2012
3.1 Il rene
Il rene è un organo di natura epiteliale in cui tutte le funzioni epiteliali si riassumono.
Il rene infatti contiene degli epiteli di rivestimento, degli epiteli ghiandolari esocrini ed
endocrini.
Quindi in una struttura che è tipica che non possiamo che dargli un nome che struttura
del rene.
Come si organizzano? Il rene è un organo che presuppone che voi sappiate la macroscopica per capire la microscopica. Al contrario di come accade normalmente in cui si
passa dal micro al macro.
Ad esempio, come per il polmone, anche il rene ha una vascolarizzazione di tipo funzionale. Quindi, non solo una vascolarizzazione di tipo nutritizia.
Normalmente, nella circolazione nutritizia, il sangue arterioso diventa venoso grazie agli
scambi nel letto capillare. Nel rene e nel polmone invece la loro funzione è nell’organizzazione di un letto capillare non solo di tipo nutritizio ma anche funzionale ossia arriva
l’arteriola, si sfiocca in tanti capillari e poi dopo torna ad essere arteriola e solo successivamente l’arteriola torna ad essere capillare e poi finalmente torna vena. Doppio letto
capillare di tipo arterioso.
Se ora si va a studiare la struttura del rene, con cellule cubiche di tipo mono-stratificato
tubulari. La funzione di rene è una funzione di filtro e quindi la struttura tipica del
rene legata alla filtrazione è il glomerulo renale. Com’è fatto. E’ tipico. E’ fatto da una
capsula esterna di tipo endoteliare appiattito monostratificato di tipo pavimentoso che
riveste una cavità detta capsula di Bowman e lo spazio di Bowman e poi c’è un groviglio
di piccoli capillari in cui si percepiscono cellule endoteliari ma anche cellule tondeggianti,
le cellule del sangue che ci passano dentro,
Questo groviglio di capillari di tipo arterioso. Questa struttura si forma sfioccandosi da
un’arteriola afferente e il sangue ritorna al di fuori di questo glomerulo in una arteriola
efferente. Il sangue resta arterioso e quindi non è di tipo nutritizio.
Come mai la natura ha scelto questa struttura per la filtrazione del sangue? Perché il
sangue all’interno delle arteriole gira ad una pressione sostenuta per cui la pressione è
sufficientemente alta per far si che il sangue possa filtrare tra i capillari fenestrati ossia
3.1. IL RENE
21
che hanno dei fori che lasciano uscire acqua grazie alla pressione. Tutto questo non
avverrebbe se al posto delle arteriore avessimo delle venule perché la pressione venosa
non sarebbe sufficiente a spremere l’acqua fuori dal capillare.
Ora, le macromolecole non escono dai capillare fenestrati mentre le micromolecole possono uscire. Ad esempio, l’albumina non può uscire ed essendo la più piccola proteina
nel sangue, se esce e si vede nell’esame delle urine allora è sintomo di problemi in questi
fori.
Quest’acqua che esce finché sulla superficie esterna delle cellule appiattite, i podociti,
che presentano dei prolungamenti detti pseudopodi e che possono occludere i fori del
capillare. La filtrazione è quindi, in un primo momento, controllato dai podociti.
L’acqua esce e si raccoglie nello spazio di Bowman. Il filtrato glomerulare si raccoglie
nello spazio di Bowman ad ogni battito cardiaco. Che fine fa questo liquido? Delle strutture successive dette tubuli (cavità e parete in struttura allungata) renali che costituisce
l’intero parenchima del rene. I glomeruli sono nella corticale mentre tutti il resto del
rene è fatto da una struttura tubulare che ha il compito di raccogliere questo liquido, di
rielaborarlo, riassorbire l’acqua in eccesso, concentrando la soluzione, secernere attivamente sostanze che non passano nella filtrazione come l’urea e veicolano verso l’esterno,
a livello dell’ilo renale, l’urina ormai formata viene condotto verso le vie urinarie.
Andiamo ora a vedere le strutture tubulari del rene. Essi si classificano in tubuli
prossimali e distali più una parte intermedia detta ansa di Henle.
Il tubulo prossimale ha un andamento contorto perché in questo modo viene rallentato
il passaggio del filtraggio glomerulare raccolto dallo spazio di Bowman permettendo
il riassorbimento dell’acqua in eccesso. L’epitelio di tale struttura (dovrebbe essere
cilindrico) ha microvilli e quindi orletto a spazzola in microscopia ottica.
Da questo tubulo prosegue lineare e discendente e, nella parte in cui forma un’ansa,
l’epitelio si assottiglia facilitando l’interazione con capillari ivi presenti. L’epitelio di
questa struttura è monostratificato pavimentoso.
Successivamente l’ansa ritorna su e riparte con un tubulo lineare ascendente che ha un
rivestimento cubico con funzione esocrina di secrezione attiva di sostanze che ritorna ad
essere contorto alla fine del percorso e diventa quindi tubulo contorto distale. Quest’ultima parte ha come funzione di gettarsi in un dotto collettore che raccoglie l’urina che
raccoglie da tanti nefroni e si dirige poi, in maniera lineare verso le vie urinarie ossia i
calici minori, i calici maggiori e poi la pelvi.
Macroscopicamente, nella zona midollare sono apprezzabili delle strutture a punta dette
piramidi. Il dotto collettore sbuca proprio all’apice della piramide, quindi ogni piramide
ha tanti forellini che sono i dotti collettori.
Ogni piramide è poi drenata dai calici minori che confluiscono nei calici maggiori e poi
nella pelvi e quindi in continuità con l’uretea e poi nella vescica.
Quindi l’unità funzionale del rene è il nefrone costituito
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
3.1. IL RENE
22
• glomerulo
• tubulo condotto prossimale
• ansa di Henle
• tubulo condotto distale
che va a drenare in un dotto collettore che attraversa la midollare ed esce all’apice delle
piramidi renali ossia dotti e tubuli paralleli che vanno verso i calici.
Si comincia quindi come vascolarizzazione, si prosegue come filtrazione e si conclude
con la produzione dell’urina. Tutte funzioni che, come sappiamo, sono appannaggio del
tessuto epiteliale nel parenchima renale.
Il rene è un organo pieno con una capsula connettivale circondata da tessuto adiposo.
Nelle forti anoressie tale tessuto tende a consumarsi e il rene diviene eptosico ossia tende
ad appendersi.
Spostandosi all’interno, corticale, troviamo una serie di glomeruli e tubuli che sono di
tipo contorto prossimali o distali dato che entrambi si trovano corticalmente vicino al
glomerulo renale.
Spostandosi sulla midollare si percepiscono tubuli che vanno nella stessa direzione, ad
andamento parallelo e, fra i tubuli lineari, troviamo i dotti collettori, che si dirigono
verso gli apici delle piramidi e notiamo anche i vasi che passano tra io dotti collettori e
i tubuli lineari per raccogliere il secreto dei dotti lineari.
Quindi nella corticale del rene troviamo glomeruli e tubuli contorti, nella midollare
troviamo tubuli paralleli circondati da vasi.
Secrezione attiva a dispendio di energia quindi esocrina con produzione di energia e
simil–endocrina perché vengono prodotte delle sostanze che vengono riversate sul sangue
e vanno poi ad agire a distanza.
La sede di produzione della renina, la sostanza tipica del rene, che agisce insieme all’insieme angiotensina e aldosterone che agisce sulla pressione arteriosa, è vicina al glomerulo
detto apparato iuxtaglomerulare dove vi è, a livello del tubulo contorto distale, dove le
cellule epiteliali da cubiche diventano cilindriche. In questa stessa sede vi è l’ingresso
delle arteriole afferenti e l’uscita di quelle efferenti.
Il glomerulo può essere descritto un po’ come l’epatocita, come una struttura che ha un
polo vascolare dove entra l’arteriola afferente e esce l’efferente e un polo urinario dove si
trovano i tubuli contorti.
L’apparato iuxtaglomerulare si trova localizzato nel polo vascolare in quanto quelle cellule sono sollecitate da variazioni di concentrazioni ioniche e di pressione e in risposta
sintetizzano la renina che si riversa nel sangue e regola, in circolo, la pressione arteriosa.
Questa struttura cosi delicata è quindi regolata da questo apparato per evitare l’aumento
della pressione arteriosa che porterebbe, come primo danno, alla fuoriuscita prima di
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
3.2. TESSUTO CONNETTIVO
23
proteina a causa dell’aumento della dimensione della fenestrazione capillare. Prima
l’albumina,poi le altre, poi le piastrine, globuli rossi, bianchi e cosi via.
Nei casi invece, ad esempio, di una infiammazione cronica, una produzione eccessiva di
connettivo e quindi una chiusura dei fori che causa una riduzione della produzione di
urina.
I vasi rettilinei che accompagnano i tubuli renali sono detti, appunto, vasa recta.
Riassumendo, il rene ha una doppia circolazione di tipo arterioso quindi i capillari diventano due volte arteriosi, una volta a formare il glomerulo e poi, la stessa struttura,
viene usata come elemento nutritizio del rene.
3.2 Tessuto connettivo
Cellule immerse in un’abbondante matrice extracellulare di forma differente (appiattita,
tondeggiante). La matrice extracellulare è formata da una sostanza amorfa e da una
componente fibrosa di tre tipi:
• collagene
• elastica
• reticolare
Ci sono le cellule proprie del connettivo, il fibroblasto, ossia quelle che lo producono.
che, nei momenti di quiescienza si trasforma in fibrocita e poi ci sono cellule che usano
il connettivo per il trasporto e per svolgere li le loro funzioni come i macrofagi che
sono derivati dai monociti circolanti che sono la prima linea di difesa contro gli antigeni
circostanti.
I connettivi si dividono in
• propriamente detti che hanno una funzione generica di sostegno, di nutrimento, di
difesa, di riserva
• specializzati con funzione di sostegno nutrimento
Il connettivo si divide anche in
• lasso in cui le fibre sono singole e predominano le fibre con poca sostanza amorfa
e poche cellule
• denso in cui le fibre sono accorpati e predominano i fasci e la sostanza amorfa e
abbondanti cellule
Nel connettivo denso, si divide in
• fasci paralleli, per resistere a sollecitazioni in una determinata direzione (tendine)
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
3.3. SANGUE
24
• fasci intrecciati, a fasci disordinati per resistere a sollecitazioni superficiali in tutte
le direzioni (derma)
• fasci incrociati (cornea dell’occhio), con fibre ad angoli di 90 gradi
La sostanza amorfa è la sede di scambi con il sangue quindi molta sostanza amorfa allora
funzione nutritiva, molta sostanza fibrosa allora funzione di sostegno.
3.3 Sangue
Cellule tondeggianti in fluido extracellulare si tratta di sangue. Una prima grossolana
distinzione è tra cellule senza il nucleo ossia globuli rossi e cellule con il nucleo ossia
globuli bianchi.
Chiaramente le piastrine si vedono con difficoltà, che tendono ad ammassarsi, a coagulare
in una parte del preparato.
I globuli rossi, negli strisci possono anche trovarsi impilati.
I globuli bianchi possono essere granulociti, linfociti, monociti. In particolare, i più frequenti, in uno striscio, si trovano cellule polilobate o polimorfo e sono polimorfonucleati
o granulociti neutrofili. I nuclei sembrano polinucleati ma, in realtà i vari lobi sono
comunque collegati l’uno all’altro.
Ci sono poi cellule di dimensione leggermente più grandi dei globuli rossi e sono i linfociti,
piccoli medi e grandi che hanno, come caratteristica, un filo sottile di citoplasma e tutto
il resto e nucleo, tondeggiante e unico.
Mentre i globuli rossi fanno la propria funzione nel sangue, i linfociti usano il circolo
sanguigno per spostarsi e raggiungere la sede dove svolgeranno la loro funzione.
Il tissuto linfoide primario è il midollo osseo e poi, utilizzando il circolo sanguigno,
vanno a formare gli organi linfoidi, il timo, le placche del prayer, le tonsille, etc. Nel
caso incontri un’antigene, esso si attiva per produrre anticorpi, diventando plasmacellula
e va a inserirsi nella matrice connettivale. Ecco perché tra la popolazione di cellule del
tessuto connettivale annoveriamo le plasmacellule, i linfociti T, i mastociti.
Le caratteristiche dei granuli. Se il granulo assomiglia a quella del nucleo allora il granulo
è acidofilo o eosinofilo mentre se il granulo ha colorazioni differente da quello del nucleo
allora è basofilo.
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
4 Apparato riproduttivo maschile
4.1 Testicoli
Il testicolo fa parte dell’apparato genitale maschile, in genere vien cosı̀ denominato negli
animali cordati dove rappresenta la gonade maschile.
I testicoli, o didimi, sono di forma ovale, misurano 3,5-5,5 centimetri di lunghezza, 3
centimetri circa di larghezza e 3 centimetri circa trasversalmente. Il peso dei testicoli
di un adulto è di circa 30 grammi l’uno, anche se uno dei testicoli può essere un po’
più pesante e più grande dell’altro, e in genere pende un po’ più in basso. La ragione
di questo fatto non è certa, ma potrebbe ragionevolmente essere quella di impedire ai
testicoli di urtare l’uno contro l’altro.
I testicoli hanno due funzioni: la produzione degli spermatozoi dal momento della pubertà sino alla morte, e la produzione degli ormoni sessuali maschili chiamati androgeni,
tra i quali il testosterone è il più importante. La produzione degli ormoni da parte dei
testicoli è evidente fin dalla nascita, ma aumenta enormemente intorno alla pubertà e
si mantiene ad alto livello per tutta l’età adulta fino a manifestare una diminuzione
durante gli ultimi anni di vita.
La produzione degli spermatozoi non comincia fino alla pubertà, anche se segue il modello della produzione di ormoni riducendosi in età avanzata. Gli spermatozoi vengono
prodotti in ogni testicolo in speciali strutture chiamate tubuli seminiferi in particolare
dalle cellule del Sertoli. Questi tubicini sono al centro di ogni testicolo e sono collegati
con una serie di condotti che convogliano lo sperma ad altri importanti organi e, alla
fine, fuori dal pene, se ciò è richiesto.
In ogni testicolo, vicino ai tubuli seminiferi, ci sono numerose cellule chiamate cellule interstiziali o cellule di Leydig. Esse sono responsabili della produzione dell’ormone
sessuale maschile (testosterone) che viene secreto direttamente nei vasi sanguigni circostanti. Al momento della pubertà, la maggior parte dei cambiamenti che avvengono nel
ragazzo è prodotta dalla maggior quantità di testosterone che scorre nel suo corpo. Durante l’eccitazione sessuale i testicoli aumentano di grandezza. Il sangue riempie i vasi
sanguigni che si trovano in essi causando il loro ingrandimento. Dopo l’eiaculazione essi
tornano alle loro normali dimensioni. Subito prima dell’eiaculazione i testicoli vengono
tratti molto vicini al corpo. Dopo l’eiaculazione essi ritornano alla loro posizione usuale
nello scroto.
4.1. TESTICOLI
26
Il medesimo avvicinamento dei testicoli al corpo avviene nei momenti di intensa paura,
collera o quando l’uomo ha freddo. In questo modo, naturalmente, il corpo protegge
questo meccanismo delicato e vulnerabile. I testicoli pendono fuori dal corpo per potere stare alla temperatura leggermente più bassa che è richiesta per la produzione dello
sperma. Quando la stagione è molto calda o durante un bagno tiepido essi pendono
più in basso del normale, lontano dal corpo e dal suo calore; al contrario, nella stagione
fredda, essi si avvicinano al tepore del corpo per mantenere una temperatura ottimale. Se vengono tenuti alla temperatura corporea, i testicoli non sono più in grado di
produrre spermatozoi e l’uomo diventa sterile. Quando i muscoli dell’uomo si tendono,
per esempio quando egli si prepara a una fuga o a un’aggressione oppure subito prima
dell’eiaculazione, un insieme di muscoli posto nello scroto spinge automaticamente i testicoli verso l’alto, questi sono la fascia cremasterica, la fascia spermatica interna e la
fascia spermatica esterna.
4.1.1 Anatomia microscopica del testicolo
Il testicolo è costituito dalla tunica albuginea e dalle sue dipendenze, da un parenchima
costituito dai tubuli seminiferi, e dallo stroma che circonda i tubuli seminiferi e contenente quest’ultimo le cellule di Leydig a funzione endocrina. La tonaca albuginea è la
tonaca più intima del testicolo, costituita da tessuto connettivo fibroso denso con fasci
di fibre di collagene ad andamento parallelo; è resistente e inestensibile, spessa tra lo 0,5
e 1 mm, e all’esterno continua con l’epiorchio. Negli strati più superficiali troviamo fibrocellule muscolari lisce mentre negli strati più profondi troviamo fibre elastiche. Dalla
faccia profonda dell’albuginea, detta tonaca vascolosa perché riccamente vascolarizzata, si dipartono dei setti convergenti verso il mediastino testicolare che si approfondano
all’interno del testicolo delimitando circa 300 logge. Ciascuna loggia ha forma piramidale, con la base volta verso la superficie del testicolo e l’apice in corrispondenza del
mediastino testicolare (dà passaggio alla rete testis).
Il parenchima, di colorito roseo giallastro, riempe le logge, all’interno delle quali si organizza in lobuli. Ciascun lobulo contiene tubuli seminiferi contorti, le cui estremità
si uniscono a formare i tubuli retti che sboccano nella rete testis, posta a livello del
mediastino testicolare, una serie di tubuli riccamente anastomizzati. Dalla rete testis
si dipartono circa 15-20 condottini efferenti che confluiscono a formare l’epididimo. I
tubuli seminiferi contorti sono lunghi da 30 cm a 70 cm e occupano il poco spazio a loro
disposizione grazie al loro andamento convoluto.
La parete dei tubuli seminiferi è costituita da epitelio pluriseriato detto epitelio germinativo che poggia su una lamina propria. L’epitelio germinativo comprende accanto alle
cellule germinali in diverso stato differenziativo le cellule del Sertoli, che sono cellule di
sostegno. Le cellule del Sertoli sono cellule di derivazione mesodermica non spermatogeniche che oltre a sostenere e a nutrire gli spermatozoi svolgono importanti funzioni
endocrine. Si estendono per tutto lo spessore dell’epitelio con la base che poggia sulla
membrana basale e l’apice verso il lume; l’apice presenta delle infossature entro cui sono
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
4.1. TESTICOLI
27
contenute le teste degli spermatidi in via di sviluppo. Sono riconoscibili per il nucleo
triangolare con nucleolo evidente e cromatina dispersa. Le cellule del Sertoli sono unite
da complessi giunzionali, tight junctions, che suddividono l’epitelio germinativo in due
compartimenti conosciuti come basale e come luminale. Le cellule del Sertoli mediano quindi gli scambi metabolici tra il compartimento luminale degli spermatidi quello
sistemico costituendo una barriera ematotesticolare che isola gli spermatidi dal resto
dell’organismo, proteggendoli dal sistema immunitario.
Il citoplasma è acidofilo, con gocciole lipidiche, scarso RER e abbondante REL. Sono
talora visibili aggregati proteici noti come corpi di charcot bottcher. Troviamo anche lisosomi primari e secondari. Le cellule del Sertoli mediano la spermatogenesi e la
spermiazione, riassorbono i corpi residui tramite fagocitosi. Svolgono anche funzione
endocrina: producono ABP (Androgen Binding Protein), sotto lo stimolo dell’FSH ipofisario che concentra il testosterone favorendo la spermatogenesi; secernono inibina che
agisce con feedback negativo a livello ipotalamo ipofisario.
Le cellule germinali sono cellule in vario stadio differenziativo. Quelle in stadio precoce
di sviluppo si trovano perifericamente mentre quelle negli stadi tardivi prospettano verso
il lume. Il processo attraverso il quale gli elementi cellulari passano dalla periferia al
lume prende il nome di spermatogenesi. Dura 74 giorni circa e comprende la spermatogoniogenesi (proliferazione per mitosi delle cellule germinali primitive, da cui originano
gli spermatociti primari), la spermatocitogenesi (divisione meiotica degli spermatociti
primari a formare spermatociti secondari e da questi gli spermatidi) e la spermiogenesi (differenziazione degli spermatidi in spermatozoi maturi, non si hanno fenomeni
moltiplicativi). Nello stroma vi sono le cellule di Leydig che producono sotto lo stimolo
dell’ormone ipofisario LH o ICSH ormoni androgeni, dei quali il testosterone rappresenta
il prototipo.
4.1.2 Struttura delle vie seminali
• Tubuli retti
– Corti e rettilinei
– Trasportano gli spermatozoi alla Rete Testis
– Cellule del Sertoli all?inizio, poi epitelio cubico, con corti e tozzi microvilli
• Rete Testis
– Sistema di spazi labirintici
– Epitelio cubico semplice, corti microvilli
• Dotti efferenti
– 10-20, corti tubuli che portano dalla rete testis all?epididimo
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
4.2. EPIDIDIMO
28
– Zone di epitelio cubico semplice alternato a colonnare cigliato
∗ Riassorbimento secrezioni Sertoli e movimento degli spermatozoi
4.2 Epididimo
L’ epididimo è una parte dell’apparato genitale maschile dell’uomo e di tutti gli altri
mammiferi maschi. È un dotto di piccolo diametro, lungo 4-6 cm, e strettamente avvolto
che collega i dotti efferenti dal retro di ogni testicolo al suo dotto deferente. Disposto
lungo la faccia posteriore del testicolo
Può essere diviso in tre regioni principali
• la testa (caput). Unione di 15-20 dotti efferenti, numerosi riavvolgimenti
• il corpo (corpus). Unione di 15-20 dotti efferenti, numerosi riavvolgimenti
• la coda (cauda). Perde la morfologia e si continua nel dotto deferente
4.2.1 Immagazzinamento di spermatozoi
Gli spermatozoi che si sono formati nei testicoli entrano nella testa dell’epididimo, avanzano verso il corpo e alla fine giungono nella regione della coda, in cui vengono immagazzinati. Gli spermatozoi che entrano nella testa dell’epididimo sono incompleti mancano della capacità di muoversi in avanti (motilità) e di fecondare un ovulo. Durante
il loro transito nell’epididimo, gli spermatozoi subiscono processi di maturazione a loro
indispensabili per acquisire queste funzioni. La maturazione dello spermatozoo viene
completata nel tratto riproduttivo della donna (capacitazione).
Durante l’eiaculazione, gli spermatozoi scorrono dalla porzione più bassa dell’epididimo
(che ha la funzione di serbatoio d’immagazzinamento). Essi sono cosı̀ stipati che non
gli è possibile nuotare, ma sono trasportati, grazie all’azione peristaltica di alcuni strati
muscolari all’interno del dotto deferente, e si mischiano con i fluidi diluenti delle vescicole
seminali e di altre ghiandole accessorie prima dell’eiaculazione (formando lo sperma).
4.2.2 Istologia
E’ formato da un epitelio pseudostratificato. È una delle sole due regioni del corpo
ad avere stereociglia (l’altra è l’orecchio interno). All’esterno possiede una muscolatura
liscia per le contrazioni peristaltiche.
Le cellule basali sono:
• Forma poligonale o piramidale
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
4.3. CELLULE DEL SERTOLI
29
• Nucleo tondo, abbondante eterocromatina
• Citoplasma pallido, pochi granuli
• Nucleo ovale, irregolare, più chiaro
• RER e Golgi abbondanti
• Numerose vescicole pinocitotiche
• Stereociglia
• Riassorbono fluido e fagocitano residui di citoplasma
• Producono Glicerofosfocolina inibisce capacitazione
4.3 Cellule del Sertoli
Tappezzano i tubuli seminiferi e fungono da sostegno e nutrimento per le cellule germinative. Partecipano alla regolazione della spermatogenesi.
4.3.1 Istologia
• Cellule colonnari alte
• Membrane laterali, numerose pieghe
• Membrana apicale, numerose pieghe proiettano all?interno del lume
• Nucleo ovale, chiaro, alla base della cellula, grosso nucleolo centrale
• Giunzioni occludenti formano due comparti
– Basale, sottile, disposto all?esterno delle giunzioni circonda l?Adluminale
• Barriera emato-testicolare
– Protegge gameti in via di sviluppo dal sistema immunitario
4.3.2 Funzione
• Supporto nutrizionale e strutturale
• Fagocitosi del citoplasma
• Formazione Barriera Emato-testicolare
• Sintesi e secrezione Proteina legante gli androgeni (ABP) che aumenta concentrazione di testosterone nei tubuli
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
4.4. CELLULE DEL LEYDIG
30
• Sintesi e secrezione Ormone anti-mulleriano che produce differenziazione maschile
• Sintesi e secrezione Inibina che inibisce rilascio di FSH dall?Ipofisi
• Secrezione medium ricco di fruttosio, nutrimento e trasporto spermatozoi
• Sintesi e secrezione Transferrina testicolare
4.4 Cellule del Leydig
4.4.1 Istologia
• Cellule interstiziali, poligonali
• Distribuite nel connettivo
4.4.2 Funzione
Tipiche cellule produttrici di steroidi
• Mitocondri con creste tubulari
• Esteso REL e Golgi
• RER e gocce lipidiche, ma non vescicole secretorie
• Testosterone secreto immediatamente appena prodotto
• Cristalli di Reinke a causa di proteine cristallizzate nel citoplasma
4.5 Sperma
E? composto da Spermatozoi e Fluido Seminale. Il Fluido seminale comprende il 95 per
cento dello sperma. Prodotto dalle ghiandole sessuali accessorie
• Vescichette seminali
• Prostata
• Ghiandole bulbo-uretrali
Ha funzione di nutrire e proteggere gli spermatozoi.
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36
4.6. PERCORSO DEGLI SPERMATOZOI
31
4.6 Percorso degli spermatozoi
Dal testicolo gli spermatozoi passano nell’epididimo, che è costituito da un lungo tubulo
spiralizzato sopra il testicolo ed è circondato da un sottile strato circolare di fibre di
tessuto muscolare liscio. Dall’epididimo passano nel vaso deferente, dove si accumulano.
Il vaso deferente, che è un prolungamento dei tubuli strettamente spiralizzati dell’epididimo, va da ogni testicolo verso la cavità addominale. I vasi deferenti sono ricoperti
da uno spesso rivestimento costituito da tre strati di tessuto muscolare liscio, le cui
contrazioni spingono gli spermatozoi in avanti. (la vasectomia consiste nel legare le due
estremità dei vasi deferenti).
Nella parte posteriore della cavità addominale i vasi deferenti girano intorno alla vescica
dove si uniscono ai dotti delle vescicole seminali. I vasi deferenti provenienti dal testicolo
entrano nella prostata dove confluiscono nell’uretra, che si estende per tutta la lunghezza
del pene. L’uretra è un condotto che viene utilizzato sia per l’escrezione dell’urina sia
per la fuori uscita degli spermatozoi, o eiaculazione, processi che però non vengono mai
contemporaneamente.
A mano a mano che gli spermatozoi procedono lungo questo percorso, a loro vengono
addizionati dei liquidi provenienti dalle vescicole seminali e dalla prostata. Le vescicole
seminali secernono un liquido ricco di fruttosio che nutre gli spermatozoi; questo liquido
contiene anche un’elevata concentrazione di prostaglandine che stimolano le contrazioni
dell’apparato femminile le quali facilitano la risalita degli spermatozoi nell’utero.
cc
BY-NC-SA
c 2012 Emiliano Bruni ([email protected])
Copyright Rev. 414 del 2012-05-11 03:36