CLASSE
DISCIPLINA
ORE SETTIMANALI
TIPO DI PROVA GIUDIZIO SOSPESO
PRIMA
CHIMICA
TRE
ORALE
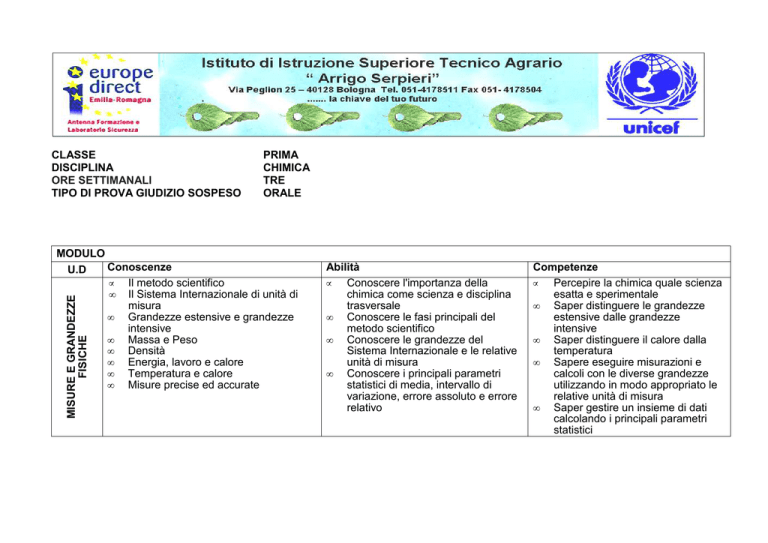
MISURE E GRANDEZZE
FISICHE
MODULO
Conoscenze
U.D
• Il metodo scientifico
• Il Sistema Internazionale di unità di
misura
•
Grandezze estensive e grandezze
intensive
•
Massa e Peso
•
Densità
•
Energia, lavoro e calore
•
Temperatura e calore
•
Misure precise ed accurate
Abilità
•
Conoscere l'importanza della
chimica come scienza e disciplina
trasversale
•
Conoscere le fasi principali del
metodo scientifico
•
Conoscere le grandezze del
Sistema Internazionale e le relative
unità di misura
•
Conoscere i principali parametri
statistici di media, intervallo di
variazione, errore assoluto e errore
relativo
Competenze
•
Percepire la chimica quale scienza
esatta e sperimentale
•
Saper distinguere le grandezze
estensive dalle grandezze
intensive
•
Saper distinguere il calore dalla
temperatura
•
Sapere eseguire misurazioni e
calcoli con le diverse grandezze
utilizzando in modo appropriato le
relative unità di misura
•
Saper gestire un insieme di dati
calcolando i principali parametri
statistici
LE TRASFORMAZIONI CHIMICHE E
FISICHE DELLA MATERIA
TEORIE DELLA
MATERIA
•
•
•
•
•
•
•
•
•
•
•
•
•
Stati fisici della materia
Sistemi omogenei ed eterogenei
Sostanze pure e miscugli
Passaggi di stato
Principali metodi di separazione dei
miscugli e sostanze
Peculiarità delle trasformazioni
chimiche
Elementi e composti
Simboli e formule brute
Tavola periodica
•
Teoria atomica e proprietà della
materia
Le leggi ponderali
Molecole e composti
Teoria cinetico-molecolare della
materia
•
•
•
•
•
•
•
Conoscere caratteristiche e
differenze tra trasformazioni fisiche
e trasformazioni chimiche
Classificare i materiali in base al
loro stato fisico
Descrivere i passaggi di stato delle
sostanze pure e disegnare le curve
di riscaldamento e di
raffreddamento
Conoscere i principali metodi di
separazione dei miscugli
Conoscere struttura e significato
della Tavola periodica
Definire le tre leggi ponderali della
chimica
Descrivere il modello atomico di
Dalton
Spiegare le proprietà delle tre
particelle che compongono l’atomo
•
•
•
•
•
•
•
Saper distinguere i diversi stati di
aggregazione della materia
Spiegare i fattori che determinano i
passaggi di stato e la loro dinamica
Saper classificare i materiali come
sostanze pure e miscugli
Saper distinguere le trasformazioni
fisiche dalle reazioni chimiche
Saper distinguere gli elementi dai
composti e desumere le
caratteristiche fondamentali di un
elemento chimico in funzione della
posizione che occupa nella tavola
periodica
Escludere un modello continuo
della materia
Saper spiegare le evidenze
macroscopiche delle trasformazioni
fisiche e chimiche mediante il
modello cinetico - molecolare della
materia
LA QUANTITÀ CHIMICA:
LA MOLE
•
•
•
•
STRUTTURA DELL'ATOMO
•
•
•
•
•
•
IL SISTEMA
PERIODICO
Massa atomica, massa molecolare e
massa molare
Mole
Calcoli con le moli
Formule chimiche e composizione
percentuale
•
•
•
•
Le particelle fondamentali dell'atomo
Numero atomico, numero di massa,
isotopi
Modelli atomici di Thomson,
Rutherford, Bohr
Modello atomico a strati
Modello atomico ad orbitali
Configurazione elettronica degli atomi
•
•
•
•
•
•
•
•
•
•
Tavola periodica degli elementi
Struttura della tavola periodica
Classificazione e proprietà chimicofisiche degli elementi
Proprietà periodiche
•
•
Conoscere il concetto massa
atomica, massa molecolare, massa
molare e di mole
Capacità di calcolare la massa
molare di una sostanza e il numero
di moli di un campione
Capacità di calcolare le formule
minime dei composti conoscendo la
percentuale di composizione
Conoscere le formule chimiche
brute e le informazioni da esse
desumibili
•
Saper utilizzare la mole quale unità
di misura della quantità di sostanza
e come ponte fra i sistemi
macroscopici (solidi, liquidi, gas) e i
sistemi microscopici (atomi,
molecole, ioni)
Spiegare le proprietà delle tre
particelle che compongono l’atomo
Conoscere la struttura dell'atomo
così come è stata teorizzata nelle
varie fasi dell’evoluzione della
chimica
Confrontare i modelli atomici di
Thomson e di Rutherford
Conoscere e descrivere il modello
atomico di Bohr e il modello atomico
a strati
Conoscere e descrivere il modello
atomico ad orbitali
Conoscere le connessioni tra
struttura atomica e proprietà
macroscopiche della materia
•
Saper identificare gli elementi della
tavola periodica mediante il
numero atomico
Saper distinguere gli isotopi di un
elemento in funzione della massa
atomica
Saper spiegare i limiti dei modelli
atomici di Rutherford e di Bohr e le
differenze con il modello atomico
ad orbitali
Essere in grado di costruire la
configurazione elettronica di un
elemento conoscendone il numero
atomico
Conoscere i criteri su cui si basa la
moderna Tavola Periodica
Descrivere le principali proprietà
periodiche che confermano la
struttura a strati dell’atomo
•
•
•
•
Saper identificare gli elementi in
funzione delle loro proprietà
periodiche
I LEGAMI CHIMICI
LE FORZE
INTERMOLECOLARI
NOMENCLATURA DEI
COMPOSTI
INOLRGANICI
•
•
•
•
•
•
Legami tra elementi
Energia di legame
Regola dell'ottetto
Scala di elettronegatività e legami
chimici
Legame ionico
Composti ionici
Legame covalente (puro, polare,
dativo)
Legame metallico
•
•
•
•
•
La forma delle molecole
La teoria VSEPR
Molecole polari e apolari.
Le forze intermolecolari
Il legame idrogeno
•
•
•
Valenza e numero di ossidazione
La classificazione dei composti
inorganici
Proprietà e nomenclatura dei
composti inorganici binari: ossidi,
idruri, idracidi, sali
Sintesi proprietà e nomenclatura dei
composti ternari: idrossidi, ossiacidi,
sali
•
•
•
•
•
•
•
•
•
•
•
Conoscere il concetto di energia di
legame e le variabili che la
influenzano
Conoscere la regola dell'ottetto
Conoscere il concetto di
elettronegatività e le relative
implicazioni nel meccanismo di
formazione dei legami chimici
Comparare i diversi legami chimici
•
Descrivere le proprietà osservabili
dei materiali sulla base della loro
struttura microscopica
•
•
•
•
Assegnare il numero di ossidazione •
Classificare i composti inorganici in
base agli elementi che li
costituiscono (binari e ternari)
Conoscere le regole della
nomenclatura IUPAC per la
denominazione e le formule dei
composti
Saper classificare un legame
chimico tra due atomi di due
elementi differenti
Spiegare la struttura delle sostanze
che presentano legame ionico,
legame covalente e legame
metallico
Saper dedurre le proprietà delle
sostanze sulla base delle tipologie
di legame in esse presenti
Saper dedurre le proprietà delle
sostanze sulla base delle tipologie
di legame in esse presenti
Saper spiegare le differenze
relative alle proprietà fisiche dei
materiali, determinate dai legami
tra atomi e dalle interazioni
intermolecolari
Saper derivare le formule brute e
di struttura dei composti inorganici
e denominarli secondo la
nomenclatura IUPAC
ATTIVITÀ DI
LABORATORIO
•
•
•
Norme di sicurezza e di
comportamento in laboratorio
Principali strumenti e tecniche di
laboratorio. Principali informazioni
presenti sulle etichette dei prodotti
Contenuti dei moduli precedenti
•
•
•
Saper riconoscere ed utilizzare
correttamente la vetreria da
laboratorio
Saper leggere l'etichetta dei
prodotti soprattutto per quando
concerne i simboli di pericolosità
Altre abilità in parallelo a quelle
previste nei moduli precedenti
MISURE E GRANDEZZE
FISICHE
OBIETTIVI MINIMI RICHIESTI PER LA PROMOZIONE ALLA CLASSE SUCCESSIVA
MODULO
Conoscenze
Abilità
U.D
• Il metodo scientifico
•
Conoscere l'importanza della
• Il Sistema Internazionale di unità di
chimica come scienza e disciplina
misura
trasversale
•
Grandezze estensive e grandezze • Conoscere le fasi principali del
intensive
metodo scientifico
•
Massa e Peso
•
Conoscere le grandezze del
•
Densità
Sistema Internazionale e le relative
•
Energia, lavoro e calore
unità di misura
•
Temperatura e calore
•
Conoscere i principali parametri
•
Misure precise ed accurate
statistici di media, intervallo di
variazione, errore assoluto e errore
relativo
•
•
•
•
Capacità di muoversi in laboratorio
rispettando le norme basilari di
sicurezza
Conoscenza dei principali
strumenti e di alcune tecniche di
laboratorio
Scrivere una relazione tecnica
delle esercitazioni svolte
Altre competenze in parallelo a
quelle previste nei moduli
precedenti
Competenze
•
Percepire la chimica quale scienza
esatta e sperimentale
•
Saper distinguere le grandezze
estensive dalle grandezze
intensive
•
Saper distinguere il calore dalla
temperatura
•
Sapere eseguire misurazioni e
calcoli con le diverse grandezze
utilizzando in modo appropriato le
relative unità di misura
LE TRASFORMAZIONI CHIMICHE E FISICHE
DELLA MATERIA
TEORIE DELLA
MATERIA
•
•
•
•
•
•
•
•
•
•
•
•
•
Stati fisici della materia
Sistemi omogenei ed eterogenei
Sostanze pure e miscugli
Passaggi di stato
Principali metodi di separazione dei
miscugli e sostanze
Peculiarità delle trasformazioni
chimiche
Elementi e composti
Simboli e formule brute
Tavola periodica
•
Teoria atomica e proprietà della
materia
Le leggi ponderali
Molecole e composti
Teoria cinetico-molecolare della
materia
•
•
•
•
•
•
Conoscere caratteristiche e
differenze tra trasformazioni fisiche
e trasformazioni chimiche
Classificare i materiali in base al
loro stato fisico
Descrivere i passaggi di stato delle
sostanze pure e disegnare le curve
di riscaldamento e di
raffreddamento
Conoscere i principali metodi di
separazione dei miscugli
Conoscere struttura e significato
della Tavola periodica
•
Definire le tre leggi ponderali della
chimica
Descrivere il modello atomico di
Dalton
•
•
•
•
•
•
Saper distinguere i diversi stati di
aggregazione della materia
Spiegare i fattori che determinano i
passaggi di stato e la loro dinamica
Saper classificare i materiali come
sostanze pure e miscugli
Saper distinguere le trasformazioni
fisiche dalle reazioni chimiche
Saper distinguere gli elementi dai
composti e desumere le
caratteristiche fondamentali di un
elemento chimico in funzione della
posizione che occupa nella tavola
periodica
Escludere un modello continuo
della materia
Saper spiegare le evidenze
macroscopiche delle trasformazioni
fisiche e chimiche mediante il
modello cinetico - molecolare della
materia
LA QUANTITÀ
CHIMICA: LA
MOLE
•
•
•
IL SISTEMA
PERIODICO
STRUTTURA
DELL'ATOMO
•
•
•
•
•
•
•
•
•
•
Massa atomica, massa molecolare e
massa molare
Mole
Calcoli con le moli
•
•
Le particelle fondamentali dell'atomo
Numero atomico, numero di massa,
isotopi
Modelli atomici di Thomson,
Rutherford, Bohr
Modello atomico a strati
Modello atomico ad orbitali
Configurazione elettronica degli atomi
•
Tavola periodica degli elementi
Struttura della tavola periodica
Classificazione e proprietà chimicofisiche degli elementi
Proprietà periodiche
•
•
•
Conoscere il concetto massa
atomica, massa molecolare, massa
molare e di mole
Capacità di calcolare la massa
molare di una sostanza e il numero
di moli di un campione
•
Spiegare le proprietà delle tre
particelle che compongono l’atomo
Conoscere e descrivere i modelli
atomici di Thomson, Rutherford,
Bohr, il modello atomico a strati e il
modello atomico ad orbitali
•
Conoscere i criteri su cui si basa la
moderna Tavola Periodica
Descrivere le principali proprietà
periodiche che confermano la
struttura a strati dell’atomo
•
Saper utilizzare la mole quale unità
di misura della quantità di sostanza
e come ponte fra i sistemi
macroscopici (solidi, liquidi, gas) e i
sistemi microscopici (atomi,
molecole, ioni)
Saper identificare gli elementi della
tavola periodica mediante il numero
atomico
• Saper distinguere gli isotopi di un
elemento in funzione della massa
atomica
• Essere in grado di costruire la
configurazione elettronica di un
elemento conoscendone il numero
atomico
Saper identificare gli elementi in
funzione delle loro proprietà
periodiche
I LEGAMI CHIMICI
LE FORZE
INTERMOLECOL
ARI
NOMENCLATUR
A DEI COMPOSTI
INORGANICI
•
•
•
•
•
•
Legami tra elementi
Energia di legame
Regola dell'ottetto
Scala di elettronegatività e legami
chimici
Legame ionico
Composti ionici
Legame covalente (puro, polare,
dativo)
Legame metallico
•
•
•
•
•
La forma delle molecole
La teoria VSEPR
Molecole polari e apolari.
Le forze intermolecolari
Il legame idrogeno
•
•
•
Valenza e numero di ossidazione
La classificazione dei composti
inorganici
Proprietà e nomenclatura dei
composti inorganici binari: ossidi,
anidridi, idruri, idracidi, sali
Sintesi proprietà e nomenclatura dei
composti ternari: idrossidi, ossiacidi,
sali
•
•
•
•
•
•
•
•
•
•
•
•
Conoscere il concetto di energia di
legame e le variabili che la
influenzano
Conoscere la regola dell'ottetto
Conoscere il concetto di
elettronegatività e le relative
implicazioni nel meccanismo di
formazione dei legami chimici
Comparare i diversi legami chimici
Descrivere le proprietà osservabili
dei materiali sulla base della loro
struttura microscopica
Descrivere le proprietà osservabili
dei materiali sulla base della loro
struttura microscopica
•
Assegnare il numero di ossidazione
Classificare i composti inorganici in
base agli elementi che li
costituiscono (binari e ternari) e alla
loro natura ionica o molecolare
Conoscere le regole della
nomenclatura IUPAC o tradizionale
per la denominazione e le formule
dei composti
•
Saper classificare un legame
chimico tra due atomi di due
elementi differenti
•
Saper dedurre le proprietà delle
sostanze sulla base delle tipologie
di legame in esse presenti
• Saper spiegare le differenze
relative alle proprietà fisiche dei
materiali, determinate dai legami tra
atomi e dalle interazioni
intermolecolari
Saper derivare le formule brute e di
struttura dei composti inorganici e
denominarli secondo la
nomenclatura IUPAC e tradizionale
ATTIVITÀ DI
LABORATORIO
•
•
•
Norme di sicurezza e di
comportamento in laboratorio
Principali strumenti e tecniche di
laboratorio. Principali informazioni
presenti sulle etichette dei prodotti
Contenuti dei moduli precedenti
•
•
•
Saper riconoscere ed utilizzare
correttamente la vetreria da
laboratorio
Saper leggere l'etichetta dei
prodotti soprattutto per quando
concerne i simboli di pericolosità
Altre abilità in parallelo a quelle
previste nei moduli precedenti
•
•
•
•
Capacità di muoversi in laboratorio
rispettando le norme basilari di
sicurezza
Conoscenza dei principali
strumenti e di alcune tecniche di
laboratorio
Scrivere una relazione tecnica
delle esercitazioni svolte
Altre competenze in parallelo a
quelle previste nei moduli
precedenti