PROGRAMMAZIONE SCIENZE INTEGRATE (CHIMICA)
Classi: prime
a.s. 2012/2013
Prof.ssa Paola DI CERBO
Prof.ssa Luisa IACCARINO
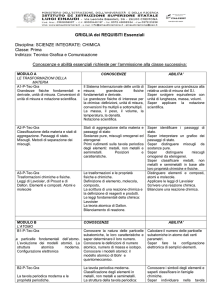
nucleo fondante
dai miscugli alle
sostanze
settembre
ottobre
sostanza
proprietà ed
energia
conoscenze
competenze
abilità
Riconoscere le
grandezze
fondamentali e quelle
derivate.
Conoscere le unità di
misura del sistema
internazionale. Sapere
la differenza tra
misura indiretta e
diretta di una
grandezza.
Definizione di
sostanza pura e sue
proprietà.
Caratteristiche
principali degli stati
fisici della materia.
Miscugli, loro proprietà
e principali tecniche di
separazione
Distinguere le grandezze
intensive da quelle
estensive. Misurare una
grandezza con metodo
diretto e indiretto. Saper
eseguire semplici misure.
:Definizione operativa di
sostanza pura. Individuare le
proprietà dei vari stati della
materia. Conoscere e
utilizzare le tecniche più
opportune per separare un
miscuglio. Riconoscere un
miscuglio omogeneo da un
miscuglio eterogeneo. Saper
distinguere portata e
sensibilità di uno strumento.
Saper riconoscere
l’importanza
dell’operazione di
misura e delle unità
di misura.
Saper utilizzare
strumenti per
effettuare misure.
Riconoscere un
miscuglio e saper
individuare
autonomamente le
procedure utili per
separarne i
componenti.
Acquisire i concetti di
temperatura e calore e
capirne la differenza.
Definire il calore
specifico di un corpo.
Esprimere la temperatura di
un corpo nelle diverse unità
di misura. Esprimere il calore
nelle diverse unità di misura.
Costruire una curva
Utilizzare un
termometro per
misurare la
temperatura di un
corpo. Usare
1
Esperienze
laboratorio
Nome di sicurezza
Illustrazione
vetreria
Miscugli
omogenei e
eterogenei
Tecniche di
separazione di
miscugli
omogenei e
eterogenei
Curva di
riscaldamento di
una sostanza pura
collegamenti con
altre discipline
matematica
fisica
scienze della
terra
fisica
scienze della
terra
novembre
elementi e
composti
dicembre/gennaio
la mole
Conoscere le diverse
scale di temperatura e
le rispettive unità di
misura. Definire che
cosa è un passaggio
di stato e quali sono i
più comuni passaggi
di stato.
Curva di
riscaldamento di una
sostanza pura.
temperatura/tempo di una
sostanza.
l’equivalenza tra la
scala Celsius e la
scala Kelvin.
Misurare il punto di
fusione di una
sostanza pura.
Conoscere i simboli
degli elementi chimici.
Definire una sostanza
compostaConoscere i
punti essenziali della
teoria atomica di
Dalton. Enunciare e
spiegare l’importanza
pratica delle varie
leggi fondamentali
della chimica.
Riconoscere una sostanza
composta
Applicare le leggi
fondamentali alle reazioni
chimiche.
Verificare le leggi
della chimica
attraverso semplici
esperimenti, con
reazioni chimiche.
Il concetto di mole e il
numero di Avogadro
sistematizzare la grandezza
mole in relazione alle altre
unità di misura.
Risolvere semplici
problemi riguardanti
le moli.
Determinazione
della massa di
una mole di semi
Conoscere i vari
modelli proposti per
spiegare la struttura
dell’atomo. Cosa si
intende per orbitale
atomico. Definire cosa
Determinare la
configurazione elettronica di
un elemento, noto il suo
numero atomico.
A partire dalla configurazione
elettronica capire di quale
Risolvere semplici
problemi riguardanti
le configurazioni
elettroniche
Saggi alla fiamma
Identificazione di
elementi e
composti
Verifica delle leggi
di Lavoisier e
Proust
gennaio/febbraio
come sono fatti
gli atomi
marzo
2
scienze della
terra
S.T.A.
la tavola
periodica degli
elementi
aprile
classi formule e
nomi dei
composti
maggio/
giugno
sono i numeri quantici
e come vengono
rappresentati.
Sapere come si
dispongono gli
elettroni negli orbitali
di un atomo,
determinando la sua
configurazione
elettronica.
elemento si tratta.
Definire che cosa è la
tavola periodica e
come sono classificati
gli elementi chimici.
Individuare i gruppi e i
periodi della tavola
periodica.
Definire le principali
proprietà dei metalli
alcalini, degli alogeni,
e dei gas nobili
conoscere
l’andamento delle
proprietà periodiche
all’interno della tavola
degli elementi.
Riconoscere i gruppi e i
periodi della tavola periodica.
Dedurre dalla posizione di un
atomo nella tavola periodica
le proprietà dei metalli e dei
non metalli
Consultare la tavola
periodica,
ricavando il nome e
il simbolo di un
elemento.
Caratteristiche dei
metalli e dei non
metalli
scienze della
terra
Conoscere i criteri per
attribuire a ciascun
elemento un proprio
numero di
ossidazione.
Conoscere e
Prevedere il tipo di legame in
base alla posizione nel
sistema periodico degli
elementi coinvolti. Scrivere la
formula di un composto
chimico. Usare le
Saper costruire
modelli molecolari.
Utilizzare la
nomenclatura
chimica
costruzione di
modelli molecolari
utilizzo della
nomenclatura
chimica
scienze della
terra
3
classificare i vari tipi di
composti inorganici.
Conosce le regole
tradizionali e IUPAC
per assegnare i nomi
ai composti inorganici.
Saper definire a quale
classe appartiene un
composto.
i legami nei
composti
chimici
maggio/giugno
conoscenze acquisite per
assegnare il nome a semplici
composti.
Descrivere i vari tipi di
legame. Conoscere i criteri
per attribuire a ciascun
elemento un proprio numero
di ossidazione. Conoscere e
classificare i vari tipi di
composti inorganici.
Conoscere le regole
tradizionali e IUPAC per
assegnare i nomi ai composti
inorganici. Saper definire a
quale classe appartiene un
composto. Indicare la
reazione di preparazione di
un composto.
Acquisiti i primi modelli e
teorie della struttura atomica,
impiegare il numero atomico
come grandezza ordinatrice
della tavola periodica e la
notazione di Lewis per
esprimere la situazione
elettronica periferica degli
atomi e la formazione dei
diversi tipi di legami
4
Verificare le leggi della
chimica Saper costruire
modelli molecolari.
Utilizzare la
nomenclatura chimica.
Applicazione dei metodi
preparativi dei composti
inorganici.
Sostanze
polari e
apolari
Miscibilità
Conducibilità
elettrica
Reazioni di
formazione
dei composti
biologia