OBIETTIVI MINIMI CL. II O BIOTEC A.S. 2014/15
1.
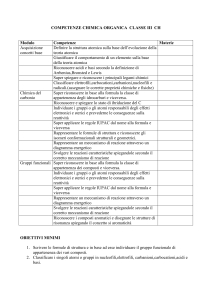
Elementi e composti. Simbolismo chimico. Leggi ponderali. Descrizione di una trasformazione
chimica mediante l’equazione di reazione. Teoria atomica di Dalton.
Atomi, molecole, simboli e formule: regole fondamentali.
Equazione di reazione e suo significato. Bilanciamento. Composizione percentuale di un composto.
Massa atomica assoluta e relativa; massa molecolare.
2.
Quantità di sostanza, mole, numero di Avogadro. Formule minime e molecolari. bilanciamento e
calcoli stechiometrici. Resa di reazione. Determinazione della formula minima dalla composizione
percentuale.
Unità di misura fisiche e chimiche della concentrazione di una soluzione ( molarità, %, m/m, etc…).
Le leggi dei gas in riferimento all’equazione di stato. Principio di Avogadro. Volume molare.
3.
Cariche negative, positive e loro interazione.
Particelle sub-atomiche.
Significato di Z ed A: isotopi. Massa atomica come media ponderale. Modelli atomici, numeri
quantici e orbitali. Riempimento dei livelli e configurazioni elettroniche. Configurazioni
elettroniche esterne. Simboli di Lewis e loro significato.
4.
Struttura generale della tavola periodica: gruppi, periodi, blocchi. Proprietà periodiche: energia di
prima ionizzazione, affinità elettronica, valenza con l’ossigeno nei gruppi principali.
Regola dell’ottetto e suo utilizzo per la previsione degli ioni più stabili. Elettronegatività.
Il legame covalente. Il legame ionico. Il legame metallico. Proprietà composti ionici e covalenti.
5.
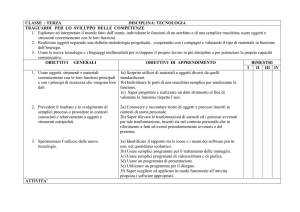
Saper prevedere il tipo di legame che si forma fra vari atomi della tavola periodica.
Saper prevedere lo stato di aggregazione di un composto e di una miscela di composti.
Saper disegnare prospetticamente molecole anche di una certa complessità.
6.
Saper prevedere la solubilità reciproca di più composti.
Saper svolgere calcoli relativi alla concentrazione e commutare i valori di diversi metodi di calcolo.
Saper svolgere problemi relativi alla diluizione delle soluzioni e al calcolo del contenuto del soluto.
7. Calcolare la resa di una reazione reversibile e irreversibile applicata anche alle reazioni di
elettroliti. Calcolare quindi il pH di diverse soluzioni comprese idrolisi e tampone.