PROTEINE
dal greco “al 1° posto”
• costituiscono il 50% circa del peso secco della maggior
parte degli organismi viventi
• composti quaternari (C, H, O, N)
• macromolecole organiche, molecole informazionali,
polimeri di aminoacidi
• molecole estremamente varie dal punto di vista funzionale
(la flessibilità di funzione è dovuta a quella di struttura)
Flavia Frabetti
Tecnici di laboratorio
2010/2011
FUNZIONI DELLE PROTEINE
STRUTTURALI
CONTRATTILI
DI TRASPORTO
DI DIFESA
ENZIMATICHE
ORMONALI
RECETTORIALI
FATTORI DI TRASCRIZIONE
1
PROTEINE
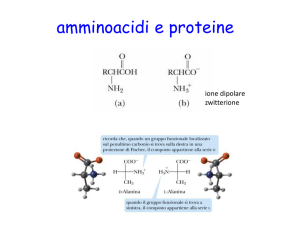
AMINOACIDI
H
NH3+
gruppo
aminico
C
R
catena
laterale
COOgruppo
carbossilico
20 aa diversi:
APOLARI (R idrofobici)
POLARI (R idrofilici)
IONIZZABILI ACIDI (R carico -)
BASICI (R carico +)
In base alla catena laterale
si possono distinguere
3 gruppi di aa:
Catena laterale:
non polare, aa idrofobici
polare non carico, aa idrofili
polare carico, aa idrofili
aa basici (+)
aa acidi (-)
2
Aa aggiuntivi: selenocisteina e pirrolisina
UGA
In enzimi quali glutatione-perossidasi,
alcune idrogenasi ecc
UAG
In enzimi degli
archea metanogeni
3
PROTEINE
CATENE POLIPEPTIDICHE
da decine a migliaia
di monomeri
H
NH2
H
C
C
N
H
C
C
N
R
O
H
COOH
R
H2O
H
LEGAME
PEPTIDICO
COOH
C
R
H
C
N
O
H
C
R
C
H
H
NH2
H
O
R
NH2
OH
C
R
H
C
N
O
H
amminoacido 1
Formazione del
legame peptidico
COOH
C
R
amminoacido 2
legame covalente forte
estremità N-terminale
La sintesi è direzionata:
una estremità con
gruppo amminico libero,
mentre l’opposta con
gruppo carbossilico.
estremità C-terminale
catena polipeptidica
la sequenza ripetitiva degli atomi lungo la catene polipeptidica (N-C-C-N-C-C-)
è detta scheletro polipeptidico.
4
La lunghezza dei polipeptidi varia
alcuni esempi:
PROTEINA
p.m.
(dalton)
N° di aa N° di catene
polipep.
Insulina bovina
5.733
51
2
Emoglobina
umana
64.500
574
4
DNA polimerasi I
di E.Coli
109.000
975
1
Fibrinogeno
umano
340.000
2994
6
sequenza degli
aminoacidi
peculiare conformazione
FUNZIONE
CONFORMAZIONE
PROTEINE
PRIMARIA
4 LIVELLI
DI
STRUTTURA
SECONDARIA
TERZIARIA
QUATERNARIA
5
LIVELLI DI STRUTTURA
Struttura primaria
• sequenza specifica di aa legati da LEGAMI COVALENTI
• l’ordine degli aa non è casuale dipende dall’informazione genetica
• il cambiamento anche di un solo aa può influenzare la funzione
La funzione di una proteina dipende dalla specifica
conformazione.
Per “conformazione” si intende la forma tridimensionale
Quando una cellula sintetizza un
polipeptide, questo si ripiega
spontaneamente per assumere la
conformazione funzionale specifica,
detta CONFORMAZIONE
NATIVA
6
Dunque la struttura primaria si complica...
Struttura secondaria
• “strutture” date dall’avvolgimento e/o ripiegatura di segmenti
• stabilizzate da legami a H tra il gruppo -NH- e -CO- di legami peptidici
diversi, disposti regolarmente lungo lo scheletro peptidico.
Le principali sono:
α−elica
legami a
idrogeno
β-foglietto o foglietto β
struttura TERZIARIA
RIPIEGAMENTO IRREGOLARE DELLE
CATENE R E DEI VARI AMINOACIDI
LEGAMI:
- legami a H
- legami ionici
- interazioni idrofobiche
- ponti disolfuro (S-S) tra cisteine
α-elica
β-foglietto
7
STRUTTURA TERZIARIA: interazioni e stabilità
legami a idrogeno
α- elica
β- foglietto
Struttura quaternaria
• data dall’unione di 2 o più catene polipeptidiche
• in questo caso le singole catene si chiameranno “subunità” della
Proteina. Proteine oligomeriche o multimeriche.
collageno = proteina fibrosa costituita
da 3 subunità elicoidali superavvolte
emoglobina = proteina globulare
costituita da 4 subunità,
2 di tipo α e 2 di tipo β
8
50-350 aa
α-elica
dominio
β-foglietto
struttura
secondaria
subunità proteica
struttura
terziaria
molecola proteica (dimero)
struttura
quaternaria
9
Proteine diverse come patchwork di domini simili
sequenza ordinata di aa
conformazione nativa
Esempi:
ormone
R specifico
neuropeptidi R specifico
anticorpo
sostanza estranea
(antigene)
enzima
substrato
funzione proteica
proteina A
spesso dipende dal riconoscimento
di un’altra struttura proteica di
conformazione complementare
proteina B
10
DENATURAZIONE
PROTEINE
PERDITA DELLA STRUTTURA TERZIARIA
INATTIVITA’
FUNZIONALE
VARIE CAUSE
-t° alta
- radiazioni ionizzanti
- pH
- alta conc. salina
ROTTURA DEI LEGAMI
Si possono
alterare
le proteine?
Agenti denaturanti
denaturazione
(urea e β-mercaptoetanolo)
rinaturazione
11