ALDEIDI E CHETONI
ALDEIDI E CHETONI
Aldeidi e chetoni fanno parte di quella classe di composti che è caratterizzata dalla presenza del gruppo carbonilico (C=O).
IL GRUPPO CARBONILICO
C sp2
O sp2
ibrido di risonanza del gruppo carbonilico
12. Aldeidi e chetoni
2
ALDEIDI E CHETONI
Nelle aldeidi
N
ll ld idi il gruppo carbonilico è legato a un atomo di idrogeno e a un il
b ili è l
di id
atomo di carbonio.
Nei chetoni il gruppo carbonilico è legato a due atomi di carbonio.
12. Aldeidi e chetoni
3
ALDEIDI : NOMENCLATURA IUPAC
Il gruppo aldeidico è indicato sostituendo il suffisso ‐o
l
ld d è d
d l ff
d ll’ l
dell’alcano corrispondente d
con il suffisso –ale.
etanale
(aldeide acetica)
(acetaldeide)
butanale
3‐metil‐pentanale
3‐fenil‐propanale
Nel caso di aldeidi contenenti un doppio legame olefinico, il suffisso –e dell’alchene viene sostituito dal suffisso –ale. Nel caso di aldeidi contenenti un triplo legame C‐C, il suffisso –o dell’alchino viene sostituito dal suffisso –ale.
(E)‐2‐butenale
12. Aldeidi e chetoni
(E)‐3‐metil‐2‐pentenale
3‐fenil‐propinale
3
fenil propinale
4
ALDEIDI:: NOMENCLATURA IUPAC
ALDEIDI
Nel caso di molecole cicliche in cui il gruppo –CHO (formile) è legato l
d
l l
l h
l
(f
il ) è l
direttamente all’anello, il nome viene assegnato sostituendo il suffisso –o del composto ciclico con il suffisso –carbaldeide. All’atomo
All
atomo di carbonio a cui è legato il gruppo formile viene assegnato il numero 1 di carbonio a cui è legato il gruppo formile viene assegnato il numero 1
3,4‐dimetilcicloesancarbaldeide
d
l l
b ld d
12. Aldeidi e chetoni
5
CHETONI:: NOMENCLATURA IUPAC
CHETONI
I chetoni sono denominati scegliendo come alcano base la catena più lunga che
I chetoni sono denominati scegliendo come alcano base la catena più lunga che contiene il gruppo carbonilico.
La presenza del gruppo chetonico viene indicata sostituendo il suffisso –o
d ll’ l
dell’alcano con il suffisso –one.
il ffi
La catena è numerata in modo da assegnare al carbonile il numero più piccolo.
2‐eptanone
5‐metil‐3‐eptanone
1‐fenil‐3‐metil‐butan‐1‐one
N l
Nel caso di chetoni contenenti un doppio legame olefinico, il suffisso –e
di h t i
t
ti
d
i l
l fi i il ffi
d ll’ l h
dell’alchene viene i
sostituito dal suffisso –one. Nel caso di chetoni contenenti un triplo legame C‐C, il suffisso –o dell’alchino viene sostituito dal suffisso –one.
t
trans‐5‐epten‐2‐one
5 t 2
12. Aldeidi e chetoni
6 ti 2
6‐eptin‐2‐one
6
ALDEIDI E CHETONI
ORDINE DI PRIORITÀ DI ALCUNI GRUPPI FUNZIONALI
priorità
p
crescente
2‐butanolo
b
l
12. Aldeidi e chetoni
2‐idrossi‐butanale
d
b
l
2‐idrossi‐3‐osso‐butanale
d
b
l
7
ALDEIDI e CHETONI
CHETONI:: REATTIVITÀ
‐ reazioni di addizione
‐ reazioni di addizione‐eliminazione
dissociazione del legame C‐H
‐ condensazioni aldoliche
‐ alogenazione in α
alogenazione in α
12. Aldeidi e chetoni
8
ALDEIDI e CHETONI
CHETONI:: REAZIONI DI ADDIZIONE
REAZIONI DI ADDIZIONE:
‐Addizione di “H‐H”
‐ Addizione di “R‐H”
‐Addizione di “RO‐H”
12. Aldeidi e chetoni
9
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “H‐
“H‐H”
RIDUZIONE
RIDUZIONE DI COMPOSTI CARBONILICI AD ALCOLI RIDUZIONE DI COMPOSTI CARBONILICI AD DI COMPOSTI CARBONILICI AD ALCOLI ALCOLI
CON IDRURI METALLICI
litio alluminioidruro: LiAlH4
sodio boroidruro: NaBH4
Il sodio boroidruro è meno reattivo del litio alluminioidruro a causa della maggiore elettronegatività del boro.
maggiore elettronegatività del boro.
12. Aldeidi e chetoni
10
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “H‐
“H‐H”
Riduzione di composti carbonilici ad alcoli con LiAlH4
Riduzione di composti carbonilici ad alcoli con LiAlH
reagisce velocemente con composti contenenti gruppi ossidrilici.
deve essere usato in solventi anidri
alcuni solventi comunemente usati con il LiAlH4
etere etilico
etere etilico 12. Aldeidi e chetoni
tetraidrofurano (THF)
tetraidrofurano (THF) 1,2‐dimetossietano
1,2
dimetossietano (DME)
(DME)
11
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “H‐
“H‐H”
Rid ione di composti carbonilici ad alcoli con NaBH4
Riduzione di composti carbonilici ad alcoli con NaBH
reagisce abbastanza lentamente con H2O, CH
O CH3OH, CH
OH CH3CH2OH (a temperature OH (
relativamente basse)
H2O, CH3OH, CH3CH2OH e (CH3)2CHOH possono essere usati come solventi
12. Aldeidi e chetoni
12
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “H‐
“H‐H”
Meccanismo di rea ione
Meccanismo di reazione
12. Aldeidi e chetoni
13
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “R‐
“R‐H”
ADDIZIONE di “R‐H” (R = alchile, vinile, alchinile, arile, CN)
di “
”(
l hil i il l hi il
il
)
Reazione con alchini terminali
Reazione con organomagnesiaci (reattivi di Grignard)
Reazione con acido cianidrico
Reazione con acido cianidrico
12. Aldeidi e chetoni
14
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “R‐
“R‐H”
Reazione con alchini terminali
Reazione con alchini terminali
sintesi di alchinil litio
litio diisopropilammide
(LDA)
differenza di elettronegatività C‐Li:
2,5 – 1,0 = 1,5 3 butin 2 metil 2 olo
3‐butin‐2‐metil‐2‐olo
meccanismo di reazione
un alcossido di litio
l
id di liti
12. Aldeidi e chetoni
15
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “R‐
“R‐H”
Reazione con organomagnesiaci (reattivi di Grignard)
Reazione con organomagnesiaci (reattivi di Grignard) Sintesi di composti organomagnesio
differenza di elettronegatività C‐Mg:
2,5 – 1,2 = 1,3
12. Aldeidi e chetoni
16
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “R‐
“R‐H”
R i
Reazione con organomagnesiaci : SINTESI DI ALCOLI
i i SINTESI DI ALCOLI
Esempio
3‐pentanone 3‐metil‐3‐pentanolo
12. Aldeidi e chetoni
17
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “R‐
“R‐H”
Reazione con organomagnesiaci : SINTESI DI ALCOLI
Reazione con organomagnesiaci : SINTESI DI ALCOLI
attacco dall’alto
( o dal basso)
12. Aldeidi e chetoni
18
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “R‐
“R‐H”
R
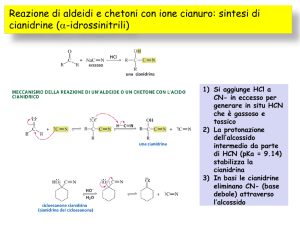
Reazione con acido cianidrico: CIANOIDRINE
Reazione con acido cianidrico: i
id i id i CIANOIDRINE
etanale
( ld id
(aldeide acetica)
i )
cianoidrina dell’acetaldeide
meccanismo di reazione
12. Aldeidi e chetoni
19
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “RO‐
“RO‐H”
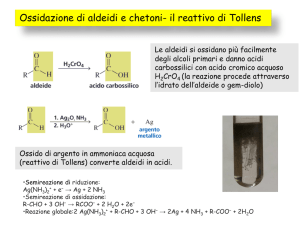
Reazione con acqua (R = H)
Reazione con alcoli (R = alchile)
12. Aldeidi e chetoni
20
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “RO‐
“RO‐H”
REAZIONE CON ACQUA (R H) FORMAZIONE DI GEM DIOLI
REAZIONE CON ACQUA (R = H): FORMAZIONE DI GEM‐DIOLI
aldeide
formica
(0,1%)
acetone
t
(99,9%)
12. Aldeidi e chetoni
metandiolo
(99,9%)
2,2‐propandiolo
2
2
di l
(0,1%)
21
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “RO‐
“RO‐H”
REAZIONE CON ACQUA (R = H)
REAZIONE CON ACQUA (R H)
meccanismo di reazione (in assenza di catalisi acida specifica)
lento
veloce
12. Aldeidi e chetoni
22
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “RO‐
“RO‐H”
REAZIONE CON ACQUA (R H)
REAZIONE CON ACQUA (R = H)
meccanismo di reazione (in presenza di catalisi acida specifica)
veloce
R
O
+
H
R
lento
veloce
12. Aldeidi e chetoni
23
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “RO‐
“RO‐H”
REAZIONE CON ALCOLI (R = ALCHILE)
REAZIONE CON ALCOLI (R ALCHILE)
formazione di (emi)acetali e (emi)chetali
emiacetale
emiacetale acetale acetale
emichetale chetale
12. Aldeidi e chetoni
24
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “RO‐
“RO‐H”
REAZIONE
REAZIONE CON ALCOLI (R = ALCHILE)
CON ALCOLI (R = ALCHILE)
SINTESI DI EMIACETALI emiacetale
SINTESI DI EMICHETALI
SINTESI DI EMICHETALI emichetale
12. Aldeidi e chetoni
25
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “RO‐
“RO‐H”
REAZIONE CON ALCOLI (R = ALCHILE)
REAZIONE CON ALCOLI (R = ALCHILE)
SINTESI DI EMIACETALI e EMICHETALI CICLICI
In genere, gli emiacetali (emichetali) sono i componenti minori della
miscela di equilibrio.
Solo nel caso della formazione di composti ciclici a cinque o sei termini
l’emiacetale (emichetale) è quasi l’unico composto presente.
5‐idrossieptanale 12. Aldeidi e chetoni
emiacetale ciclico
26
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “RO‐
“RO‐H”
SINTESI DI EMICHETALI (EMIACETALI)
SINTESI DI EMICHETALI (EMIACETALI)
meccanismo di reazione (in presenza di catalisi acida specifica)
veloce
R
O
+
H
R
lento
veloce
12. Aldeidi e chetoni
27
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “RO‐
“RO‐H”
SINTESI DI ACETALI DA EMIACETALI
SINTESI DI CHETALI DA EMICHETALI
12. Aldeidi e chetoni
28
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “RO‐
“RO‐H”
SINTESI DI CHETALI (ACETALI) DA EMICHETALI (EMIACETALI)
SINTESI DI CHETALI (ACETALI) DA EMICHETALI (EMIACETALI) meccanismo di reazione (in presenza di catalisi acida specifica)
H3C
OCH2CH3
H3C
OCH2CH3
12. Aldeidi e chetoni
H
29
ALDEIDI e CHETONI
CHETONI:: ADDIZIONE di “RO‐
“RO‐H”
SINTESI DI CHETALI (ACETALI) SENZA ISOLARE GLI EMICHETALI SINTESI
DI CHETALI (ACETALI) SENZA ISOLARE GLI EMICHETALI
(EMIACETALI) 12. Aldeidi e chetoni
30
ALDEIDI e CHETONI: REAZIONI DI ADDIZIONE/ELIMINAZIONE
REAZIONI DI ADDIZIONE/ELIMINAZIONE
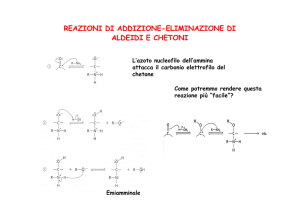
REAZIONE CON R‐‐NH2: SINTESI DI IMMINE
REAZIONE CON R
REAZIONE CON R
REAZIONE CON R2NH: SINTESI DI ENAMMINE
NH SINTESI DI ENAMMINE
O
O
O
H
N
H2O
N
H
morfolina
12. Aldeidi e chetoni
31
REAZIONI DI ADDIZIONE/ELIMINAZIONE
SINTESI DI IMMINE
SINTESI DI IMMINE
cicloesanone anilina immina
meccanismo di reazione
12. Aldeidi e chetoni
32
REAZIONI DI ADDIZIONE/ELIMINAZIONE
N
H3C
CH3
H3C
Ph
H3C
N
Ph
immine (basi di Shiff)
Reazione con R‐NH2
R i
Reazione con NH
NH2‐NH
NH2
R i
Reazione con NH
NH2‐OH
OH
I composti in cui è presente il doppio legame C‐N possono esistere come miscele di diastereoisomeri.
12. Aldeidi e chetoni
33
REAZIONI DI ADDIZIONE/ELIMINAZIONE
SINTESI DI ENAMMINE
SINTESI DI ENAMMINE
meccanismo di reazione 12. Aldeidi e chetoni
34