TRIVONA 2 – Report – 28 Novembre 2013
Multicentre Italian Trials in Ovarian Cancer
TRINOVA 2
Studio in doppio cieco randomizzato di fase III con
Doxorubicina Liposomiale Pegilata (PLD) in associazione ad
AMG 386 o placebo in donne con carcinoma epiteliale ovarico,
carcinoma peritoneale primario o cancro delle tube di Falloppio
recidivati, parzialmente sensibili o resistenti al platino.
REPORT
28 Novembre 2013
Data contained in this report are CONFIDENTIAL
for Investigators participating in the trial and cannot be divulgated.
page 1 of 4
TRIVONA 2 – Report – 28 Novembre 2013
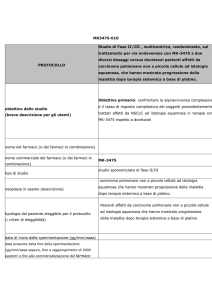
Disegno dello Studio
Circa 380 soggetti saranno randomizzati in un rapporto 1:1 in uno dei seguenti
bracci di trattamento:
Braccio A: PLD 50 mg/m2 EV ogni 4 settimane (Q4W) e AMG 386 15
mg/kg EV in cieco una volta la settimana (QW)
Braccio B: PLD 50 mg/m2 EV ogni 4 settimane (Q4W) e AMG 386
placebo EV in cieco una volta la settimana (QW)
La randomizzazione sarà stratificata in base all’intervallo libero da platino
(platinum-free interval, PFI) (PFI ≥ 0 mesi e ≤ 6 mesi verso PFI > 6 mesi e ≤ 12
mesi), presenza / assenza di malattia misurabile, e regione geografica (Nord
America, Europa occidentale/Australia, Resto del mondo ).
Si definisce intervallo libero da platino (PFI) il periodo di tempo intercorso tra
l’ultima dose della più recente somministrazione di farmaco contenente platino
e la prima data in cui è stata osservata la progressione della malattia durante o
dopo la sospensione del precedente farmaco contenente platino.
I soggetti continueranno a ricevere AMG 386 o placebo (in base al braccio di
trattamento) più PLD fino a progressione della malattia in base ai Criteri di
Valutazione della Risposta nei tumori solidi, versione 1.1. (Response Evaluation
Criteria in Solid Tumors version 1.1, (RECIST 1.1)
modificati, fino
all’insorgenza di, tossicità inaccettabile, ritiro del consenso o decesso. I soggetti
possono sospendere PLD dopo 6 cicli a discrezione dello sperimentatore. I
soggetti che sospendono PLD per motivi diversi dalla progressione della
malattia in base ai criteri RECIST 1.1 modificati, dal ritiro del consenso, o da
decesso devono continuare a ricevere AMG 386 o placebo. I soggetti che
sospendono AMG 386 o placebo per motivi diversi dalla progressione della
malattia in base ai criteri RECIST 1.1 modificati, dal ritiro del consenso, o da
decesso, possono continuare a ricevere PLD (vedereSezione 6.2.3 per
indicazioni ulteriori sulle dosi cumulative di PLD ≥ 450 mg/m 2).
I soggetti saranno valutati ogni 8 settimane ± 1 settimana per le prime 64
settimane, poi ogni 16 settimane ± 1 settimana per le successive 32 settimane,
e poi ogni 24 settimane ± 4 settimane successive in base ai criteri RECIST 1.1
modificati per la risposta radiologica obiettiva e la progressione radiologica della
malattia.
Gli sperimentatori non possono sospendere i farmaci in studio (PLD, AMG
386 o placebo) o dichiarare la presenza di progressione della malattia
esclusivamente in base alla progressione di CA-125 . I soggetti dovranno
essere trattati con i farmaci fino a progressione radiologica in base ai
criteri RECIST 1.1 modificati e, fino a tossicità inaccettabile, ritiro del
consenso o decesso.
Obiettivo primario
Determinare se AMG 386 più doxorubicina liposomiale pegilata (PLD) è
superiore al placebo più PLD in termini di sopravvivenza libera da progressione
(progression-free survival, PFS)
page 2 of 4
TRIVONA 2 – Report – 28 Novembre 2013
Obiettivi secondario
Determinare se AMG 386 più PLD è superiore al placebo più PLD in
termini di sopravvivenza globale (overall survival, OS)
Valutare il tasso di risposta obiettiva (objective response rate, ORR) e la
durata della risposta (duration of response, DOR) nei soggetti che
ricevono AMG 386 più PLD rispetto ai soggetti che ricevono placebo più
PLD
Valutare il tasso di risposta del CA-125 in base ai criteri del Gynecologic
Cancer Intergroup (GCIG) e le variazioni dei livelli di CA-125 nei soggetti
che ricevono AMG 386 più PLD rispetto al gruppo con placebo più PLD
Valutare la sicurezza e la tollerabilità di AMG 386 più PLD
Valutare la farmacocinetica di AMG 386 (ad es. Cmax. e Cmin.)
Stimare l'incidenza della formazione di anticorpi anti-AMG 386
Stimare gli effetti di AMG 386 sui sintomi specifici del carcinoma ovarico
riportati dalle pazienti usando il questionario del Functional Assessment
of Cancer Therapy – Ovary (FACT-O) e la sottoscala specifica per il
carcinoma ovarico (ovarian cancer-specific subscale, OCS)
Stimare gli effetti di AMG 386 sullo stato di salute complessivo riferito
dalle pazienti, misurato tramite il questionario EuroQOL (EQ-5D)
Criteri di inclusione
Donne di età pari o superiore ai 18 anni
Carcinoma invasivo ovarico epiteliale, peritoneale primario o delle tube di
Falloppio documentato istologicamente o citologicamente.
Progressione della malattia documentata radiologicamente durante o
successivamente, l’ultima dose del precedente regime per il trattamento
di carcinoma epiteliale ovarico, peritoneale primario o delle tube di
Falloppio
Malattia valutabile radiologicamente in base ai criteri RECIST 1.1
modificati
I soggetti devono avere avuto un regime chemioterapico precedente per
il trattamento della malattia primaria contenente carboplatino, cisplatino,
o altro organo composto a base di platino. Questo trattamento iniziale
può avere incluso la terapia intraperitoneale, la terapia ad alte dosi, la
terapia di consolidamento, la chemioterapia neoadiuvante con chirurgia
di intervallo, bevacizumab o terapia prolungata somministrata dopo
valutazione chirurgica o non chirurgica
Performance Status ECOG di 0 o 1
Adeguata funzionalità ematologica, renale ed epatica
Frazione di eiezione ventricolare sinistra (LVEF) ≥ limite inferiore di
normalità istituzionale
page 3 of 4
TRIVONA 2 – Report – 28 Novembre 2013
Criteri di esclusione
Soggetti che hanno ricevuto più di 3 regimi precedenti di terapia
antitumorale per il carcinoma epiteliale ovarico, carcinoma peritoneale
primario o cancro delle tube di Falloppio
Soggetti trattati con doxorubicina liposomiale pegilata (PLD) o con
qualunque chemioterapia a base di antraciclina o di mitoxantrone
Soggetti con malattia primaria refrattaria al platino
Soggetti con intervallo libero da platino (PFI) > 12 mesi dall’ultima terapia
a base di platino
Anamnesi di tromboembolismo arterioso o venoso nei 12 mesi
precedenti alla randomizzazione
Anamnesi di metastasi a carico del sistema nervoso centrale
Cardiopatia clinicamente significativa nei 12 mesi precedenti alla
randomizzazione
Ipertensione non controllata, definita come pressione arteriosa diastolica
> 90 mmHg OPPURE pressione arteriosa sistolica > 140 mmHg
Centri Aderenti
Pazienti
arruolate
1
Policlinico A. Gemelli (Roma)
7
2
Istituto Europeo di Oncologia (Milano)
9
3
Istituto Nazionale Tumori (Milano)
13
4
Fondazione Giovanni Paolo II (Campobasso)
1
5
Istituto Nazionale Tumori “Fondazione G. Pascale” (Napoli)
3
6
Istituto Nazionale Tumori Regina Elena (Roma)
2
7
Ospedali Galliera (Genova)
2
totale pazienti arruolate
37/380
page 4 of 4