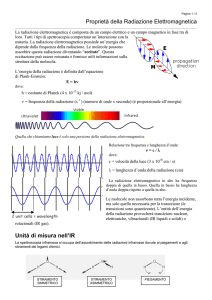
Spettroscopia Infrarossa (IR)
Quando le molecole sono sottoposte all’assorbimento
all assorbimento di una radiazione infrarossa vengono
sollecitati i moti vibrazionali e rotazionali.
Un assorbimento IR avviene quando vi è un netto cambiamento del momento di dipolo
Il momento di dipolo è in funzione della differenza di carica e della distanza fra gli atomi
atomi.
La vibrazione porta a una variazione del momento di dipolo che instaura un campo elettrico
che può interagire con il campo elettrico della radiazione
υdi vibrazione naturale = υ della radiazione elettromagnetica
⇓
Assorbimento
⇓
Aumento dell’ampiezza delle vibrazioni
υ=
1
υ ( Hz )
⋅10 − 4 ( µm / cm) =
λ (cm)
c(cm / s )
La radiazione IR è nel range υ 12,800 – 10 cm-1 o l = 0.78 – 1000 μm
%T
Transmittance
- le transizioni rotazione hanno basse differenze di energia
≤ 100 cm-1, λ > 100 μm
- le transizioni vibrazioni richiedono energie maggiori
- le transizioni rotazioni e vibrazionali spesso avvengono assieme
Wavenumber (cm-1)
E=hν = hc/λ
Tipico spettro IR delle molecole organico
- molte più bande rispetto allo spettro UV/VIS
- la bande sono molto più strette
- lo spettro è specifico per le singole molecole
eccetto che per gli isomeri
- ottimo strumento per l’analisi qualitativa
può
ò essere utilizzato
ili
per l’id
l’identificazione
ifi
i
d
delle
ll molecole
l
l
analisi dei gruppi funzionali
- è uno strumento anche quantitativo
intensità della banda è proporzionale alla concentrazione
- solitamente lo spettro mostra la trasmittanza (invece dell’assorbanza)
vs. il numero d’onda (invece di λ) per convenienza
Hexane
Hexene
Hexyne
Teoria dell’assorbimento
Assorbimento delle molecole
Modello di oscillazione armonica
- approssimativamente rappresenta lo stiramento di un legame
- due masse collegate da una molla
F = -ky
E = ½ ky2
y spostamento della molla
k costante di forza
IIn quite
i (equilibrio)
(
ilib i )
y=0
E=0
Frequenza di vibrazione
1° legge di Newton
F = m⋅a
L’
L’accelerazione
l
i
è iin ffunzione
i
d
della
ll di
distanza
t
F = m ⋅ a = −k ⋅ y
d²y
F = m⋅a = m
dt ²
1 k
υm =
2π m
y = a ⋅ cos 2π ⋅υ m ⋅ t
υm
d²y
− ky = m
dt ²
m
Sostituisco m con la massa
ridotta e ottengo la frequenza di
vibrazione fra due atomi
m1 ⋅ m2
μ=
m1 + m2
Dipende
Di
d d
da k ma è iindipendente
di
d t d
da E la
l variazione
i i
di energia
i porta
t a un
aumento dell’ampiezza delle vibrazioni
Trattamento quantistico
Le equazioni della meccanica classica non tengo conto che l’energia vibrazionale è
quantizzata.
Possiamo utilizzare il concetto di oscilattore armonico semplice per sviluppare
ll’equazione
equazione donda della meccanica quantistica.
quantistica
1⎞ h
⎛
E = ⎜υ + ⎟
2 ⎠ 2π
⎝
k
m
υ = numero quantico vibrazionale, può
assumere solo
l numerii iinteri
t i positivi
iti i
1⎞
⎛
E = ⎜υ + ⎟ ⋅ h ⋅ υ m
2⎠
⎝
ΔE fra livelli energetici vibrazionali consentiti è
sempre uguale
h
ΔE = h ⋅υ m =
2π
k
m
1
E0 = ⋅ h ⋅ υ m
2
υ=0
Temperatura ambiente
Promozione al primo
livello vibrazionale
3
E1 = ⋅ h ⋅υ m
2
υ=1
1
υ = υm =
2π
ΔE = E1 − E0 = h ⋅υ m
La frequenza dell’onda
elettromagnetica che produce
questa vibrazione è uguale alla
frequenza di vibrazione
naturale
k
μ
R
Regole
l di selezione
l i
-Differenza di numero
quantico ±1
-Variazione del momento di
dipolo
1
υ =
2πc
k
μ
= 5,3 ⋅10
−12
k
μ
Oscillatore anarmonico
- il modello di dell’oscillatore armonico funziona sola a basse energie (ν0, ν1, ν2, …)
g intervengo
g le forze di attrazione e di repulsione
p
- ad elevate energie
quando due atomi sono molto vicini, le forze di repulsione columbiana si
aggiungono alle forze di legame, l’energia aumenta più velocentemente rispetto al
modello armonico
quando gli atomi sono molto distanti, interviene l’energia di
dissociazione, la curva dell’energia potenziale diminuisce più velocemente
Harmonic oscillation
Anharmonic oscillation
Il moto anarmonico è òa causa della presenza della bandfe di overtone, poco intense e a
frequenze due o tre volte minori rispetto alle frequenze normali
Tipi di vibrazioni molecolari
Bond Stretching
symmetric
asymmetric
Bond Bending
In-plane rocking
In-plane scissoring
Out-of-plane wagging
Out-of-plane twisting
symmetric
O t f l
Out-of-plane
ttwisting
i ti
asymmetric
I l
In-plane
rocking
ki
In-plane scissoring
Out-of-plane wagging
Another Illustration of Molecular Vibrations
Numero di modi vibrazionali:
- molecole non lineari, numero di possibili vibrazioni: 3N-6
- molecole
l
l lilineari,i numero di possibili
ibili vibrazioni:
ib i i 3N
3N-5
5
- molti picchi nello spettro IR
- le vibrazioni osservate sono minori rispetto a quelle teoriche
simmetria (non cambia il dipolo)
energie vibrazionali uguali
basse intensità di assorbimento
frequenze cadono fuori del range strumentale
Examples:
1) HCl: 3(2)-5 = 1 mode
2) CO2: 3(3)-5 = 4 modes
-
+
-
moving in-out of plane
See web site for 3D animations of vibrational modes for a variety of molecules
http://www.chem.purdue.edu/gchelp/vibs/co2.html
IR Active Vibrations:
- quando avviene un assorbimento IR:
l ib i
lavibrazione
avviene
i
alla
ll ffrequenza d
della
ll lluce
quando la vibrazione produce un cambiamento di dipolo
Examples:
1) CO2: 3(3)-5 = 4 modes
δ-
2δ+
δ-
μ = 0; IR inactive
μ > 0; IR active
δ-
degenerate –identical energy single IR peak
δ-
2δ+
δ-
+
-
2δ+
δ-
2δ+
δ-
δ-
μ > 0; IR active
μ > 0; IR active
Strumentazione
IR a dispersione
- molto simile all’UV-vis
-p
principali
p differenze sono nella sorgente
g
e nel detectors
Light Source:
- must produce IR radiation
- can’t use glass since absorbs IR radiation
- several possible types
a)) filamento
fil
t di N
Nernstt
Zr, Ce, Th
V
- rare earth metal oxides (Zr, Ce, Th) heated electrically
- apply
l currentt tto cylinder,
li d h
has resistance
i t
tto currentt flflow
generates heat (1200o – 2200o C).
- causes light production similar to blackbody radiation
-1
- range
g of use ~ 670 – 10,000cm
,
- need good current control or overheats and damaged
b) Globar
- similar
i il to N
Nernst Gl
Glower b
but uses silicon
ili
carbide
bid rod
d iinstead
d off
rare earth oxides
- similar usable range
c) Incandescent Wire Source
- tightly wound nichrome or rodium wire that is electrically heated
- same principal as Nernst Glower
- lower intensity then Nernst Glower or Globar, but longer lifetime
d) CO2 Laser
- CO2 laser gas mixture consists of 70% He, 15% CO2, and 15% N2
- a voltage is placed across the gas, exciting N2 to lowest vibrational levels.
- the excited N2 populate the asymmetric vibrational states in the CO2 through
collisions.
- infrared
i f
d output
t t off the
th laser
l
iis th
the resultlt off transitions
t
iti
between
b t
rotational
t ti
l states
t t off
the CO2 molecule of the first asymmetric vibrational mode to rotational states of
both the first symmetric stretch mode and the second bending mode
-g
gives off band of ~ 100 cm-1’s in range
g of 900-1100 cm-1
- small range but can choose which band used & many compounds have IR
absorbance in this region
- much more intense than Blackbody sources
- using
i iin th
the LIDAR system
t
e) Others
- mercury arc (λ > 50 μm) (far IR)
- tungsten lamp (4000 -12,800cm-1) (near IR)
ii.) Detectors:
- two main types in common IR instruments
a) Thermal Detectors
1.) Thermocouple
- two
t
pieces
i
off dissimilar
di i il metals
t l ffused
d ttogether
th att th
the ends
d
- when heated, metals heat at different rates
- potential difference is created between two metals that varies with their
difference in temperature
- usually made with blackened surface (to improve heat absorption)
- placed in evacuated tube with window transparent to IR (not glass or
quartz)
- IR “hit
“hits”” and
dh
heats
t one off th
the ttwo wires.
i
- can use several thermocouples to increase sensitivity.
hν
metal1
metal2
- +
V
IR transparent
material (NaCl)
2.) Bolometer
- strips of metal (Pt, Ni) or semiconductor that has a large change in
resistance to current with temperature
temperature.
- as light is absorbed by blackened surface, resistance increases and
current decreases
- veryy sensitive
i
hν
A
b) Photoconducting
Ph
d i D
Detectors
- thin film of semiconductor (ex. PbS) on a nonconducting glass surface
and sealed in a vacuum.
- absorption of light by semiconductor moves from non-conducting
non conducting to
conducting state
- decrease in resistance
increase in current
hν
-1
- range: 10,000 -333 cm at room temperature
vacuum
semiconductor
glass
Transparent
to IR
c) Pyroelectric Detectors
- pyroelectric (ceramic, lithium tantalate) material get polarized (separation
off (+)
( ) and
d (-)
( ) charges)
h
) iin presence off electric
l t i fifield.
ld
- temperature dependent polarization
- measure degree of polarization related to temperature of crystal
- fast response, good for FTIR
iii.) Other Components
a.) Sample Cell
- must be made off IR transparent material (KBr
(
pellets or NaCl)
C)
Liguid Sample Holder
b.) monochromator
- reflective grating is common
- can’t use glass prism, since absorbs IR
NaCl plates
iv.) Overall Instrument Design
-Need chopper
pp to discriminate source light
g
from background IR radiation
-Monochromator after sample cell
-Not done in UV-Vis since letting in all
hν to sample
p may
y cause
photdegradation (too much energy)
-IR lower energy
-Advantage that allows
monochromator to be used to screen
out more background IR light
-Problems:
-Source weak , need long scans
-Detector response
p
slow – rounded
peaks
Strumenti in trasformata di Fourier
Vantaggi
- Pochi componenti ottici
- Nessuna fenditura
Maggiore potenza ⇒ alto rapporto segnale/rumore
- Grande potere di risoluzione
- Grande riproducibilità
Negli strumenti in FT si ha l’arrivo simultaneo di tutte le λ al rivelatore
Alte velocità di scansione (t<1s)
S tt
Spettroscopia
i tradizionale:
t di i
l d
dominio
i i d
della
ll ffrequenza, la
l potenza
t
è in
i funzione
f
i
di
Spettroscopia FT: dominio del tempo, la potenza è in funzione di t
υ λ
υ,
Selettori della lunghezza d’onda
In fase
In contro fase
Interferometro
Problema! gli spettri nel dominio del tempo non possono essere acquisiti sperimentalmente
Non esiste un trasduttore di segnale che sia in grado di misurare la modulazione della
potenza a frequenza
p
q
così elevate
Serve convertire il segnale ad alta frequenza in un segnale a bassa frequenza senza perdere
le informazioni relative al tempo contenute nel segnale originale
INTERFEROMETRO
Separa il fascio della
sorgente in 2
La variazione del segnale
misurato è in relazione
alla differenza di
cammino ottico
Si ottiene un grafico della potenza in
funzione del ritardo
Il segnale misurato dal rivelatore dell’interferometro avrà una frequenza molto più bassa
rispetto a quella della sorgente
Relazione fra la frequenza della sorgente (υ) e
quella al rivelatore (f)
ritardo δ = 2(M-F)
Ciclo è completo
p
q
quando δ = λ
2(M-F) = λ
M F = λ/2
M-F
Vt = velocità di spostamento di M
τ = tempo
p p
per p
percorrere λ/2
vm ⋅ τ =
λ
2
1 2v m
1
f = =
= 2vmυ = 2vm υ
τ
λ
c
A velocità costante f è direttamente
proporzionale a υ
Vm=1,5cm/s
C=3x1010 cm/s
f=10-10υ
Trasformata di Fourier
Onda coseno
1
P(δ ) = P(υ ) cos 4Πft
2
Interferometro non divide esattamente la
radiazione in 2
La risposta del detector dipende dalla υ
P(δ ) = B(υ ) cos 4Πft
f = 2vmυ
P(δ ) = B(υ ) cos 4Πvmυ t
vm =
δ
2t
P(δ ) = B(υ ) cos 2Πδυ
P(δ ) = B1 (υ1 ) cos 2Πδυ1 + B2 (υ 2 ) cos 2Πδυ 2
+∞
P(δ ) = ∫ B(υ ) cos 2Πδυ dυ
−∞
+∞
B(υ ) = ∫ P(δ ) cos 2Πδυ dδ
−∞
Trasformata di Fourier
v.) Fourier Transfer IR (FTIR) – alternative to Normal IR
- Based on Michelson Interferometer
Principal:
1) light from source is split by central mirror into 2 beams of equal intensity
2)) beams go
g to two other mirrors,, reflected byy central mirror,, recombine and pass
p
through sample to detector
3) two side mirrors. One fixed and other movable
a) move second mirror, light in two-paths travel different distances before
recombined
b) constructive & destructive interference
c) as mirror is moved, get a change in signal
D) Application of IR
1)
1.)
Qualitative
Q
lit ti Analysis
A l i (Compound
(C
d Id
Identification)
tifi ti )
- main application
- Use of IR, with NMR and MS, in late 1950’s revolutionized organic
chemistryy
► decreased the time to confirm compound identification 101000 fold
i.) General Scheme
1) examine what functional groups are present by looking at group
frequency region
- 3600 cm-1 to 1200 cm-1
al di sopra
dei 4000
cm-1 sono
dette
bande di
overtones
A
3650
2500
cm-1
B
2300
2100
cm-1
C
1800
1500
cm-1
D
1650
1300
cm-1
stretching del
legame X–H
(x è un
generico
atomo)
stretching
dei tripli
legami
stretching
dei doppi
legami
bending
nel piano
X–H
E
1300
900
cm-1
stretching
dei legami
singoli
X–Y
zona dell’impronta
digitale:
Gruppo
OH
O-H
n (cm-1)
stretching
3650 2500
3650-2500
N-H
3550-3050
C-H
3040-2840
C
C
2260-2100
C=O
C
O
1850-1630
1850
1630
C=C
1690-1590
C-O
1300-1060
CC
C-C
1200 800
1200-800
BANDE CARATTERISTICHE DELL'O-H (3600 - 3000 cm-1)
La regione dell'O-H è quella che raggiunge numeri d'onda più elevati.
L'O-H g
genera una banda molto intensa e slargata
g
che è facilmente riconoscibile.
Poiché questa banda si genera ogni qualvolta sia presente un gruppo O-H è necessario
considerare alcuni problemi riscontrabili nell'analisi di uno spettro.
Infatti anche nel caso di molecole che non presentino gruppi ossidrilici è possibile
riscontrare la presenza di bande relative all'O-H: ciò si determina a causa di possibili
contaminazioni del campione dovute alla presenza di H2O che ritroviamo anche come
umidità atmosferica.
I PONTI DI IDROGENO INDEBOLISCONO IL LEGAME O-H, FACILITANO LO
STIRAMENTO: BANDA PIU’ LARGA SPOSTATA A NUMERI D’ONDA MINORI
SPETTRI IR:
etanolo
fenolo
acido acetico
n (cm-1)
In assenza di ponti di
idrogeno
3650-3590
Ponti di idrogeno
i t
intermolecolari
l
l i
3600-3200
Ponti di idrogeno
intramolecolare
3200-2500
SPETTRI:
Anilina
BANDE CARATTERISTICHE DELL'N-H (3530 - 3060 cm-1)
La banda dell'N-H
dell N H si trova a lunghezza d'onda
d onda simile a quella del'O-H
del O H
Metilamina
Dietilammina
Formammide
Ammine p
primarie stretching
g asimmetrico ~3500
stretching simmetrico ~3400
scissoring 1650-1580
Ammine secondarie stretching 3350-3310
3350 3310
bending ~1515
Ammidi semplici stretching asimmetrico ~3520
stretching simmetrico ~3400
bending 1620-1590
Ammidi mono N sostituite stretching 3500
3500-3400
3400
bending1550-1510
Possono dar luogo a ponti idrogeno ed allargamento delle bande, ma
in modo meno marcato che nel gruppo O-H
ZONA DELL’AROMATICO (2000/1800 - 1650 cm-1)
Poiché la zona 2000 - 1800 cm-1
cm 1 è abbastanza sgombra sono facilmente
visibili le cosiddette DITA DELL'AROMATICO, costituite da 2, 3 bande.
Le sostanze che contengono un nucleo benzenico danno luogo a tali bande.
Queste sono bande multiple
p di altre p
presenti a 1000 o a 500 e sono relative a
vibrazioni di scheletro C-C.
SPETTRI:
Benzene
Toluene
SPETTRI:
Acetone
Acetaldeide
ce a de de
STIRAMENTO DEI CARBONILI (1850 - 1700 cm-1 ,C=O)
Intorno a 1850 - 1700 cm
cm-1
1 troviamo la banda dei carbonili
(C=O) che è molto evidente.
per determinare l'esatta natura del composto è necessario
considerare delle "bande
bande d'appoggio“:
d appoggio :
Benzaldeide
C-H a 2700 cm-1 per le aldeidi
m-Nitrobenzaldeide C
C-O
O a 1200 cm-1
cm 1 per l'estere
l estere
l'O-H a 3330 cm-1 per l'acido carbossilico
Etilacetato
*La forza di legame
g
del carbonile è influenzata dal
sostituente legato al C, infatti esso può avere un effetto
induttivo (atomo più elettronegativo), che ne riduce la
lunghezza
g
aumentando così la sua k e la frequenza di
assorbimento.
*Effetto coniugativo o di risonanza che aumenta la
lunghezza del legame e ne riduce la frequenza di
assorbimento.
*Effetto
*Eff
tt campo dovuto
d
t alla
ll presenza di una atomo
t
polare
l
(O) nelle vicinanze.
STIRAMENTO DEL LEGAME C-O
SPETTRI:
Fenolo
Acido Acetico
Etanolo
Composti
n (cm-1)
E t i
Esteri
1300 1050
1300-1050
Acidi Carbossilici
1250
Eteri aromatici (2 bande)
1275-1200
1075-1020
Eteri alifatici
1150-1060
1150
1060
Fenoli
1230-1140
Alcoli terziari
1150
Alcoli secondari
1100
Alcoli primari
1050
2-Butanolo
1-Butanolo
1
Butanolo
Butiletere
STIRAMENTO DEI LEGAMI C-C
La banda di vibrazione si sposta verso numeri d’onda maggiori al crescere
d ll molteplicità
della
lt li ità del
d l legame,
l
cioè
i è della
d ll sua forza
f
SPETTRI:
2-Butino
Composti
p
n ((cm-1)
Alchini
2260-2100
Alcheni con doppi legami
isolati
1680-1620
Alcheni con doppi legami
coniugati (2 bande)
1650
1600
Arilalcheni coniugati
1625
Areni (2 bande)
1600
1500
Alcani
1200-800
t1,4Esadiene
1,3Pentadiene
STIRAMENTI DEI LEGAMI C-H
C H (tripli, doppi, singoli) (3200 - 3000 cm-1)
cm 1)
Nella zona relativa agli stiramenti C-H è possibile distinguere il legame di un
alchino terminale ((≡C-H)) da quello
q
di un alchene ((=C-H),
), di un aromatico(C-H)
(
)
o anche di un semplice alcano (-C-H).
I dati hanno però scarso valore pratico perché cadono nella zona dello stretching
del N-H.
SPETTRI:
Composti
n (cm-1)
Alchini
~3300
1Pentene
Alcheni
3095-3075
2-Butino
Aromatici
3040-3010
Aldeidi
~2720
Alcani
2980-2840
2980
2840
Pentano
Benzene
ACETONITRILE
C
N
INTERPRETAZIONE SPETTRI IR
Stretching (cm-1)
Composti
X-H
C=O
C-O
Alcoli
OH 3600-3200
1200-1000
Fenoli
OH 3600-3200
1230-1140
Eteri alifatici
1150-1060
Eteri aromatici
1275-1200
1075-1020
Aldeidi
CH 2720
Chetoni
Acidi Carbossilici
1740-1675
1725-1660
OH 3300-2500
1725-1680
Cl
Cloruri
i acilici
ili i
1815 1750
1815-1750
Esteri
1880-1715
Ammidi
NH 3520-3400
Ammine
NH 3500
3500-3310
3310
1700-1630
1250
1300-1050
ii.) Group Frequency Region
- approximate frequency of many functional groups (C=O,C=C,C-H,O-H) can be
calculated from atomic masses & force constants
- positions changes a little with neighboring atoms, but often in same general region
- serves as a good initial guide to compound identity, but not positive proof.
Abbreviated Table of Group Frequencies for Organic Groups
Bond
Type of Compound
C-H
Alkanes
C-H
Alkenes
H
C
C
Frequency Range, cm-1
Intensity
2850-2970
Strong
3010-3095
675 995
675-995
Medium
strong
3300
Strong
C-H
Alkynes
C-H
Aromatic rings
3010-3100
690 900
690-900
Medium
strong
t
0-H
Monomeric alcohols, phenols
Hydrogen-bonded alchohols, phenols
Monomeric carboxylic acids
Hydrogen-bonded carboxylic acids
3590-3650
3200-3600
3500-3650
2500-2700
Variable
Variable, sometimes broad
Medium
broad
N-H
Amines, amides
3300-3500
medium
C=C
Alkenes
1610-1680
Variable
C=C
Aromatic rings
1500-1600
Variable
Alkynes
2100-2260
Variable
Amines, amides
1180-1360
Strong
Nit il
Nitriles
2210 2280
2210-2280
St
Strong
C-O
Alcohols, ethers,carboxylic acids, esters
1050-1300
Strong
C=O
Aldehydes, ketones, carboxylic acids, esters
1690-1760
Strong
NO2
Nitro compounds
1500-1570
1500
1570
1300-1370
Strong
C
C
C-N
C
N
C
C
H
iii.) Fingerprint Region (1200-700 cm-1)
- region of most single bond signals
- many have similar frequencies,
frequencies so affect each other & give pattern characteristics of
overall skeletal structure of a compound
- exact interpretation of this region of spectra seldom possible because of complexity
- complexity
uniqueness
Fingerprint Region
iv.) Computer Searches
- many modern instruments have reference IR spectra on file (~100,000 compounds)
- matches based on location of strongest band
band, then 2nd strongest band
band, etc
overall skeletal structure of a compound
- exact interpretation of this region of spectra seldom possible because of complexity
- complexity
uniqueness
Bio-Rad SearchIT database
of ~200,000 IR spectra
2.)
Quantitative Analysis
- not as good as UV/Vis in terms of accuracy
acc rac and precision
► more complex spectra
► narrower bands (Beer’s Law deviation)
► limitations of IR instruments ((lower light
g throughput,
g p , weaker detectors))
► high background IR
► difficult to match reference and sample cells
► changes in ε (A=εbc) common
- potential advantage is good selectivity,
selectivity since so many compounds have different IR
spectra
► one common application is determination of air contaminants.
Contaminants
Concn, ppm
Found, ppm
Relative error, %
Carbon Monoxide
50
49.1
1.8
Methylethyl ketone
100
98.3
1.7
Methyl alcohol
100
99.0
1.0
Ethylene
y
oxide
50
49.9
0.2
chloroform
100
99.5
0.5
Example 9: The spectrum is for a substance with an empirical formula of C3H5N. What is the
compound?
Aliphatic
hydrogens
Nitrile or
alkyne group
No aromatics
One or more
alkane groups