•
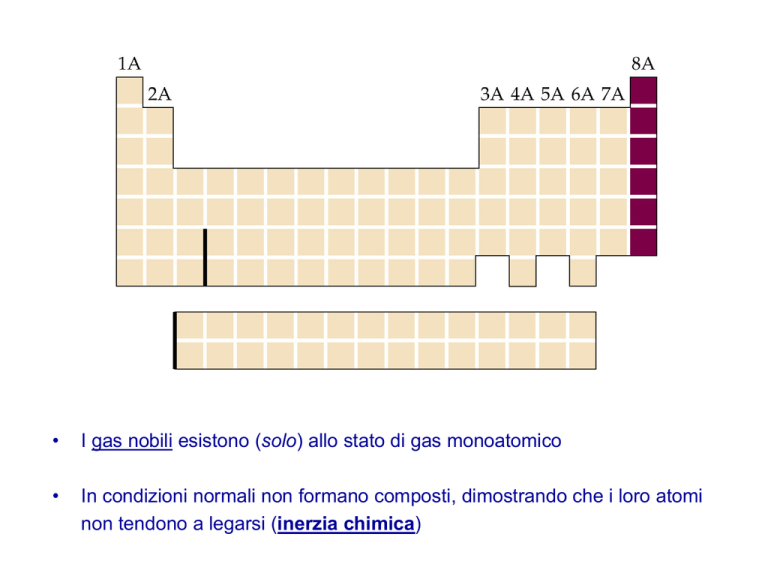
I gas nobili esistono (solo) allo stato di gas monoatomico
•
In condizioni normali non formano composti, dimostrando che i loro atomi
non tendono a legarsi (inerzia chimica)
Legame chimico
•
G. N. Lewis (1916): gli elettroni del livello esterno (livello di valenza) sono i
responsabili dell’unione tra gli atomi
•
I gas nobili esistono allo stato di gas
monoatomico
He 1s2
•
In condizioni normali non formano
composti, dimostrando che i loro atomi
non tendono a legarsi (inerzia chimica)
Ne 1s2 2s2 2p6
Ar 1s2 2s2 2p6 3s2 3p6
Regola dell’ottetto
Ogni atomo, in base al numero di elettroni di valenza, tende a cedere, acquistare
o mettere in comune gli elettroni tramite la formazione di legami fino a
raggiungere una configurazione elettronica esterna simile a quella dei gas nobili,
caratterizzata cioè dalla presenza di otto elettroni
Legame chimico
1.
Gli elettroni del livello esterno (elettroni di valenza) giocano un ruolo
fondamentale nel legame chimico
2.
In alcuni casi gli elettroni vengono trasferiti da un atomo ad un altro; si
formano ioni positivi e negativi che si attraggono tra loro in conseguenza
di forze elettrostatiche (legame ionico)
3.
In altri casi due o più coppie di elettroni vengono condivise tra gli atomi;
questa condivisione di elettroni è detta legame covalente
4.
Gli elettroni vengono trasferiti o condivisi in modo tale che ogni atomo
acquisti una configurazione stabile; in genere, questa configurazione è
quella di un gas nobile, con otto elettroni nel livello esterno (regola
dell’ottetto)
Simboli di Lewis
•
Permettono di visualizzare la configurazione elettronica esterna (elettroni di
valenza) degli atomi
•
Gli elettroni di valenza vengono rappresentati con dei punti, disposti intorno
al simbolo chimico dell’elemento
•
Se sono inferiori a 4, i punti che li rappresentano vengono collocati intorno al
simbolo, il più possibile spaziati l’uno dall’altro (fino al C e al Si)
•
Se sono in numero superiore a 4, i punti che li rappresentano vengono
collocati sui quattro lati intorno al simbolo, disposti a coppie (rappresentate
anche con un trattino) o spaiati
Metalli alcalini
Facile da rimuovere
Difficile da rimuovere
Alogeni
Difficile da aggiungere
Facile da aggiungere
Perdono elettroni
Acquistano elettroni
Cariche dei cationi dei metalli di
transizione comunemente presenti
in soluzione acquosa
Formano
anioni
Formano
cationi
Elettronegatività
• L’elettronegatività è una
misura della capacità di un
atomo di attrarre verso di
sé gli elettroni di legame
• Sulla tavola periodica
l’elettronegatività aumenta
andando verso destra e
verso l’alto e diminuisce
andando verso sinistra e
verso il basso
Cationi, anioni o atomi neutri con
configurazioni elettroniche nello
stato fondamentale dei gas nobili
Gli elementi più elettronegativi sono il F (4.0), l’O (3.5), l’N (3.0) e il Cl (3.0)
Gli elementi meno elettronegativi sono il K (0.9), il Rb (0.9), il Cs (0.8) e il Fr (0.8)
Legame ionico
•
Il legame ionico si realizza in
seguito al trasferimento di
elettroni da un atomo all’altro
(formazione di cationi e anioni)
•
Gli ioni si attraggono tramite forze
elettrostatiche
•
Si forma tra atomi con un’alta
differenza di elettronegatività
I composti ionici tendono ad
aggregarsi in reticoli cristallini
Na 1s2 2s2 2p6 3s1 Cl 1s2 2s2 2p6 3s2 3p5
EN (Na) = 0.9
EN (Cl) = 3.0
Nel cloruro di sodio
(NaCl), gli ioni Na+ e
Cl– si alternano in
una struttura cubica
Struttura del cloruro di sodio
Struttura cristallina del cloruro di sodio (NaCl)
•
I composti ionici sono costituiti da un insieme di ioni di carica opposta
tenuti insieme da forze di attrazione elettrostatiche
•
Il reticolo di NaCl è cubico con gli ioni Cl– posti ai vertici e al centro delle
facce del cubo
•
Gli ioni Na+ occupano il centro e i punti medi degli spigoli del cubo
• Un composto ionico coinvolge un elevato numero di ioni positivi e
negativi, organizzati in un reticolo cristallino
• I reticoli cristallini possono essere di vari tipi
• Dal punto di vista energetico, questa è la situazione più favorevole
• Una formula come NaCl (o CsCl, ZnS, CaF2) indica solo un rapporto
• I composti ionici sono fragili!!
• I composti ionici disciolti in soluzione acquosa
conducono l’elettricità!!
–
+
–
+
–
+
–
+
–
+
FIGURA 5-2 Conducibilità dell’elettricità in una soluzione
Soluzione acquosa di MgCl2
Sali o ossidi
I composti (prevalentemente) ionici formati da un catione (derivante da un
elemento della parte sinistra della tavola periodica, cioè un metallo) o un
catione poliatomico come l’NH4+ e un anione monoatomico o poliatomico
(derivante da uno o più elementi della parte destra della tavola periodica,
cioè non metalli) si chiamano sali
per es. NaCl, MgF2, CaCO3, Na2SO4
Se l’anione è O2– i composti si chiamano ossidi
per es. Li2O, Al2O3, Fe2O3, MnO2
Se l’anione è S2– si chiamano solfuri
per es. Cu2S, PbS, HgS, ZnS
Come si possono prevedere le formule di sali e ossidi?
• I sali e gli ossidi sono complessivamente neutri
• La carica di tutti i cationi presenti nell’unità formula deve essere
bilanciata da quella di tutti gli anioni
•
Na+ (se si lega con Cl– ci vuole solo un anione per formare NaCl, se si lega con O2– o S2–
ci vogliono due cationi per formare Na2O o Na2S, se si lega con PO43– ci vogliono tre
cationi per formare Na3PO4)
•
Mg2+ (se si lega con F– ci vogliono due anioni per formare MgF2, se si lega con O2– ci
vuole un solo anione per formare MgO, se si lega con PO43– ci vogliono tre cationi e due
anioni per formare Mg3(PO4)2)
•
Al3+ (se si lega con Cl– ci vogliono tre anioni per formare AlCl3, se si lega con O2– ci
vogliono due cationi e tre anioni per formare Al2O3, se si lega con PO43– ci vuole un
anione per formare AlPO4)
Per scrivere la formula si scambiano le cariche di catione e anione,
mettendole come pedice
Si semplificano gli indici nel caso siano divisibili per uno stesso numero
I sali
I sali sono composti ionici formati da un:
• catione monoatomico derivante da un metallo dei gruppi
principali (per es. Na+, K+, Ca2+, Mg2+, Al3+, Pb2+) o da un
metallo di transizione (per es. Cr3+, Mn2+, Fe2+, Fe3+, Co2+,
Co3+, Ni2+, Cu+, Cu2+, Zn2+, Ag+, Cd2+, Hg2+) o un catione
poliatomico (per es. NH4+)
• anione monoatomico (per es. F, Cl, Br, I, S2) o un anione
poliatomico (NO3, SO42, CO32, ClO4, CH3COO)
Ossidi
Sia i metalli che i non metalli formano composti binari con l’ossigeno
METALLO
+
OSSIGENO
NON METALLO
+
OSSIGENO
OSSIDO BASICO
(OSSIDO)
OSSIDO ACIDO
(ANIDRIDE)
Nomenclatura IUPAC: alla parola OSSIDO si aggiunge il nome
dell’elemento; entrambi vanno preceduti da prefissi indicanti il
numero di atomi di ossigeno e di atomi metallici presenti nella
formula (mono, di, tri, tetra, penta, esa, epta, otta, enna, deca, …)
Il prefisso
mono- a volte
può essere
omesso
Ossidi basici
Metallo + Ossigeno: MxOy
Gli indici x e y dipendono dalle rispettive cariche:
M(+1) + O(2–) M2O (Na2O)
M(+2) + O(2–) MO (MgO)
M(+3) + O(2–) M2O3 (Al2O3)
Per scrivere la formula si scambiano le caariche
Si semplificano gli indici nel caso siano divisibili per uno stesso numero
Ossidi acidi (anidridi)
Non metallo + Ossigeno: ExOy
Gli indici x e y dipendono dai rispettivi numeri di ossidazione (per il
non metallo vanno considerati i numeri di ossidazione positivi):
E(+1) + O(2–) E2O (Cl2O)
E(+2) + O(2–) EO (CO, NO)
E(+3) + O(2–) E2O3 (N2O3, Cl2O3)
E(+4) + O(2–) EO2 (CO2, SO2)
E(+5) + O(2–) E2O5 (P2O5 , Cl2O5)
E(+6) + O(2–) EO3 (SO3)
E(+7) + O(2–) E2O7 (Cl2O7)
Per scrivere la formula si scambiano i numeri di ossidazione
Si semplificano gli indici nel caso siano divisibili per uno stesso numero
Ossidi basici (metallici)
• Na2O: (Mon)ossido di disodio
• Fe2O3: Triossido di diferro
• BaO: (Mon)ossido di bario
• Li2O: (Mon)ossido di dilitio
• SnO2: Diossido di stagno
Ossidi acidi (non metallici)
• Cl2O: (Mon)ossido di dicloro
• Cl2O3: Triossido di dicloro
• Cl2O5: Pentossido di dicloro
• Cl2O7: Eptossido di dicloro
• CO: Monossido di carbonio
• CO2: Diossido di carbonio
• SO2: Diossido di zolfo
• SO3: Triossido di zolfo
Idrossidi (basi)
Derivano formalmente dalla reazione degli ossidi basici (ossidi
metallici) con l’acqua:
K2O + 2 H2O 2 KOH
MgO + H2O Mg(OH)2
Al2O3 + 3 H2O 2 Al(OH)3
Sono costituiti da uno IONE METALLICO positivo Mx+ e da x IONI
OSSIDRILE o IDROSSIDO OH
Valgono le stesse regole di nomenclatura degli ossidi basici:
NaOH
Fe(OH)2
Fe(OH)3
Ca(OH)2
Monoidrossido di sodio
Diidrossido di ferro
Triidrossido di ferro
Diidrossido di calcio
Dissociazione in acqua delle basi
Le basi sono composti che in acqua si dissociano (si
“separano”) liberando ioni OH– e i cationi metallici
NaOH Na+ + OH
KOH K+ + OH
Mg(OH)2 Mg2+ + 2 OH
Ca(OH)2 Ca2+ + 2 OH
Al(OH)3 Al3+ + 3 OH
Gli ioni OSSIDRILE o IDROSSIDO OH fa abbassare il pH
Acidi ossigenati
Derivano formalmente dalla reazione degli ossidi acidi (anidridi) con
l’acqua:
Nella formula si scrive prima l’H, quindi il simbolo dell’elemento, ed infine
l’ossigeno
Al nome dell’acido si associano gli stessi suffissi dell’anidride da cui
deriva (che è osa se l’elemento ha il più basso numero di ossidazione e
ica se l’elemento ha il più alto numero di ossidazione)
(anidride solforosa; n.ox. S +4) SO2 + H2O H2SO3 (acido solforoso)
(anidride solforica ; n.ox. S +6) SO3 + H2O H2SO4 (acido solforico)
(anidride nitrosa; n.ox. N +3) N2O3 + H2O H2N2O4 2 HNO2 (acido nitroso)
(anidride nitrica; n.ox. N +5) N2O5 + H2O H2N2O6 2 HNO3 (acido nitrico)
(anidride carbonica; n.ox. C +4) CO2 + H2O H2CO3 (acido carbonico)
(anidride fosforica; n.ox. P +5) P2O5 + 3H2O H6P2O8 H3PO4 (acido fosforico)
Dissociazione in acqua degli ossiacidi
Gli acidi sono composti che in acqua si dissociano (si
“separano”) liberando uno o più ioni H+ e i corrispondenti
anioni
Gli ioni H+ fanno abbassare il pH
Ossiacidi monoprotici
Sono acidi che liberano solo un H+
Possono formare solo un anione
HNO3 H+ + NO3 (ione nitrato)
HNO2 H+ + NO2 (ione nitrito)
HClO4 H+ + HClO4 (ione perclorato)
CH3COOH H+ + CH3COO (ione acetato)
Ossiacidi diprotici
Sono acidi che liberano due H+ in due stadi successivi
Possono formare due anioni
H2SO4 H+ + HSO4 (ione idrogenosolfato o bisolfato)
HSO4 H+ + SO42– (ione solfato)
H2SO3 H+ + HSO3 (ione idrogenosolfito o bisolfito)
HSO3 H+ + SO32– (ione solfito)
H2CO3 H+ + HCO3 (ione idrogenocabonato o bicarbonato)
HCO3 H+ + CO32– (ione carbonato)
Ossiacidi triprotici
Sono acidi che liberano tre H+ in tre stadi successivi
Possono formare tre anioni
H3PO4 H+ + H2PO4 (ione diidrogenofosfato)
H2PO4 H+ + HPO42– (ione idrogenofosfato)
HPO42– H+ + PO43– (ione fosfato)
Idracidi
Il loro nome finisce con il suffisso -IDRICO
HF
acido fluoridrico
HCl
acido cloridrico
HBr
acido bromidrico
HI
acido iodidrico
HCN
acido cianidrico
H2S
acido solfidrico
Dissociazione in acqua degli idracidi
Gli idracidi, analogamente agli ossiacidi, sono composti che in
acqua si dissociano (si “separano”) liberando uno o più ioni H+
e i corrispondenti anioni
Idracidi monoprotici
Sono acidi che liberano solo un H+
Possono formare solo un anione
HF H+ + F (ione fluoruro)
HCl H+ + Cl (ione cloruro)
HBr H+ + Br (ione bromuro)
HI H+ + I (ione ioduro)
HCN H+ + CN (ione cianuro)
Idracidi diprotici
Sono acidi che liberano due H+ in due stadi successivi
Possono formare due anioni
H2S H+ + HS (ione idrogenosolfuro o bisolfuro)
HS H+ + S2– (ione solfuro)
I sali si formano per reazione di un acido con una base
• HF (acido fluoridrico)
• LiOH (idrossido di litio)
• HCl (acido cloridrico)
• NaOH (idrossido di sodio)
• HBr (acido bromidrico)
• KOH (idrossido di potassio)
• HI (acido iodidrico)
• Mg(OH)2 (idrossido di magnesio)
• HCN (acido cianidrico)
• Ca(OH)2 (idrossido di calcio)
• H2S (acido solfidrico)
• NH3 (ammoniaca)
• HNO3 (acido nitrico)
• HClO4 (acido perclorico)
• H2SO4 (acido solforico)
• H2CO3 (acido carbonico)
• H3PO4 (acido fosforico)
• CH3COOH (acido acetico)
• La parte anionica di un sale deriva sempre da un acido
• L’anione (monoatomico o poliatomico) è sempre formato da elementi
che stanno a destra e in alto della tavola periodica
HF F– (ione fluoruro)
HCl Cl– (ione cloruro)
HBr Br– (ione bromuro)
HI I– (ione ioduro)
HCN CN– (ione cianuro)
H2S HS– (ione idrogenosolfuro o bisolfuro) e S2– (ione solfuro)
HNO3 NO3– (ione nitrato)
HClO4 ClO4– (ione perclorato)
H2SO4 HSO4– (ione idrogenosolfato o bisolfato) e SO42– (ione solfato)
H2SO3 HSO3– (ione idrogenosolfito o bisolfito) e SO32– (ione solfito)
H2CO3 HCO3– (ione idrogenocarbonato o bicarbonato) e CO32– (ione carbonato)
H3PO4 H2PO4– (ione diidrogenofosfato), HPO4– (ione idrogenofosfato) e PO43– (ione fosfato)
CH3COOH CH3COO– (ione acetato)
• La parte cationica di un sale deriva sempre da una base
• Il catione (a parte NH4+) è sempre formato da elementi che stanno a
sinistra della tavola periodica
LiOH Li+ (ione litio)
NaOH Na+ (ione sodio)
KOH K+ (ione potassio)
Mg(OH)2 Mg2+ (ione magnesio)
Ca(OH)2 Ca2+ (ione calcio)
Al(OH)3 Al3+ (ione alluminio)
Cr(OH)3 Cr3+ (ione cromo(III))
Mn(OH)2 Mn2+ (ione manganese(II))
Fe(OH)3 Fe3+ (ione ferro(III))
Co(OH)2 Co2+ (ione cobalto(II))
Ni(OH)2 Ni2+ (ione nichel(II))
Cu(OH)2 Cu2+ (ione rame(II))
Zn(OH)2 Zn2+ (ione zinco(II))
I sali si formano per reazione di un acido con una base
La reazione è sempre totalmente spostata verso destra
Acido(monoprotico) + Base Sale + H2O
HCl + NaOH NaCl + H2O (cloruro di sodio)
HNO3 + KOH KNO3 + H2O (nitrato di potassio)
HClO4 + KOH KClO4 + H2O (perclorato di potassio)
CH3COOH + NaOH CH3COONa + H2O (acetato di sodio)
HCN + KOH KCN + H2O (cianuro di potassio)
HBr + KOH KBr + H2O (bromuro di potassio)
HI + NaOH NaI + H2O (ioduro di sodio)
Acido(diprotico) + Base Sale(1) + H2O
H2SO4 + NaOH NaHSO4 + H2O (bisolfato di sodio)
H2CO3 + NaOH NaHCO3 + H2O (bicarbonato di calcio)
H2S + NaOH NaHS + H2O (bisolfuro di sodio)
Acido(diprotico) + Base Sale(2) + 2 H2O
H2SO4 + 2 NaOH Na2SO4 + 2 H2O (solfato di sodio)
H2CO3 + 2 NaOH Na2CO3 + 2 H2O (carbonato di calcio)
H2S + 2 NaOH Na2S + H2O (solfuro di sodio)
Acido(triprotico) + Base Sale(1) + H2O
H3PO4 + NaOH NaH2PO4 + H2O (diidrogenofosfato di sodio)
Acido(triprotico) + Base Sale(2) + 2 H2O
H3PO4 + 2 NaOH Na2HPO4 + 2 H2O (idrogenfosfato di sodio)
Acido(triprotico) + Base Sale(3) + 3 H2O
H3PO4 + 3 NaOH Na3PO4 + 3 H2O (fosfato di sodio)
Acido + Base Sale
HCl + NH3 NH4Cl (cloruro di ammonio)
HNO3 + NH3 NH4NO3 (nitrato di ammonio)
CH3COOH + NH3 CH3COONH4 (acetato di ammonio)
HCN + NH3 NH4CN (cianuro di ammonio)
HBr + NH3 NH4Br (bromuro di ammonio)
Acidi monoprotici
–
HCl
H
+
Cl
NaOH
OH–
Na+
Acidi diprotici
+
H2CO3
H
NaOH
OH–
HCO3
–
H2CO3
Na+
2 NaOH
+
2–
2H
CO3
2 OH–
2 Na+
Acidi triprotici
+
H3PO4
H
NaOH
OH–
–
H2PO4
Na+
H3PO4
2 NaOH
+
2–
2H
HPO4
2 OH–
2 Na+
H3PO4
3 NaOH
+
3H
3 OH–
3–
PO
3 Na+
I sali in acqua si dissociano (ionizzano) nella parte cationica e
anionica (a meno che non siano insolubili):
NaCl Na+ + Cl
KNO3 K+ + NO3
CH3COONa CH3COO + Na+
KCN K+ + CN
Na2SO4 2 Na+ + SO42
Na2CO3 2 Na+ + CO32
Na2S 2 Na+ + S2
K3PO4 3 K+ + PO43
NH4Cl NH4+ + Cl
NH4NO3 NH4+ + NO3
CH3COONH4 CH3COO + NH4+
NH4CN NH4+ + CN
Approfondimento: regole di solubilità
1.
Tutti i composti costituiti da elementi del gruppo I (metalli alcalini) sono solubili (per es. NaNO3, KCl, LiF)
2.
Tutti i sali contenenti nitrato (NO3–) perclorato (ClO4–) e acetato (CH3COO–) sono solubili (per es.
Ca(NO3)2, KClO3, Mg(ClO4)2, CH3COONa)
3.
Tutti i sali di ammonio sono solubili (per es. NH4Cl)
4.
Tutti i sali contenenti cloruro (Cl–), bromuro (Br–) e ioduro (I–) sono solubili in acqua ad eccezione di
quelli di Ag+, Pb2+ e Hg22+ (per es. KCl, CaBr2, AlI3 sono solubili, mentre AgCl, PbBr2 e Hg2I2 non sono
solubili)
5.
Tutti i sali contenenti ioni solfato (SO42-) sono ad eccezione di quelli di Ba2+, Sr2+, Ca2+, Pb2+, Hg22+.
Quelli di Hg2+, Ca2+ e Ag+ sono moderatamente solubili (per es. K2SO4 e MgSO4 sono solubili in acqua,
mentre non lo sono PbSO4, BaSO4 e SrSO4)
6.
Tutti gli idrossidi (formati dallo ione OH–) sono poco solubili ad eccezione degli idrossidi dei metalli
alcalini (per es. KOH, NaOH, Ba(OH)2 sono solubili, mentre Al(OH)3 è poco solubile)
7.
Tutti i sali contenenti ioni solfuro (S2–) sono insolubili ad eccezione di quelli dei metalli alcalini e di quelli
del gruppo II (metalli alcalino terrosi) (per es. Na2S e CaS sono solubili, mentre MnS è poco solubile)
8.
Tutti i sali contenenti ioni solfito (SO32–), carbonato (CO32–), cromato (CrO42–) e fosfato (PO43–) sono
insolubili ad eccezione di quelli contenenti lo ione ammonio (NH4+) e i metalli alcalini (per es. (NH4)2SO3,
Na2CO3, K2CrO4, Na3PO4 sono solubili, mentre CaCO3, Mg3(PO4)2 e BaSO4 sono poco solubili)
9.
Tutti gli ossidi sono insolubili ad eccezione di quelli contenenti lo ione Ca2+, Ba2+ e i metalli alcalini
Esercizi
• Scrivere le formule dei composti ionici formati da: a) Al + S; Na + N; Li + O; Ga +
Cl; Be + F; In + O.
• Scrivere le basi che si formano da Na2O, MgO, Al2O3, NiO, Fe2O3.
• Scrivere gli acidi che si ottengono da P2O5, CO2, SO2, SO3, N2O3, Cl2O, Cl2O3,
Cl2O5, Cl2O7.
• Scrivere i sali (e la reazioni complessive) che si formano per reazione di: NaOH
+ H2CO3; KOH + HNO3; Mg(OH)2 + HCl; Ca(OH)2 + H2SO4; Ba(OH)2 + HClO4;
Al(OH)3 + H3PO4.
• Scrivere le reazioni di dissociazione in acqua di NaF, K2SO4, NaHCO3, KH2PO4,
K2HPO4, CH3COONH4, Al2S3, Ga(HS)3, K2SO4, Li2CO3, Na2O, K3PO4, NH4Br,
NH4NO2, Ca(HSO4)2
Esercizi
Dare i nomi ai seguenti composti:
• K2CO3
• Mg(NO3)2
• LiCl
• AlBr3
• Al2(SO3)3
• Na2SO4
• BaSO4
• NaClO4
• Na3PO4
• Al2S3
• KNO2
• NaClO4
Esercizi
Dare i nomi ai seguenti composti:
• cloruro di ammonio
• acetato di ammonio
• idrogenosolfato di potassio (o bisolfato di potassio)
• idrogenosolfito di calcio (o bisolfito di calcio)
• idrogenosolfuro di sodio (o bisolfuro di sodio)
• idrogenocarbonato di sodio (o bicarbonato di sodio)
• idrogenofosfato di sodio
• diidrogenofosfato di sodio
• carbonato di magnesio
• carbonato di alluminio
• acetato di calcio
• acetato di gallio












