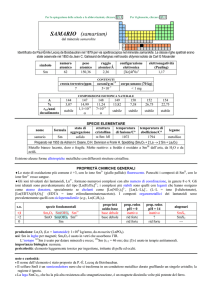
Ioni positivi (cationi)
Ioni positivi monoatomici
Ione+ nome del metallo + stato di ossidazione (notazione di Stock)
‘’
‘’
suffisso oso (n.o. ↓) o ico (n.o. ↑)
Cu 2+ Ione rame (II) Ione rameico
Cu+ Ione rame (I) Ione rameoso
Fe 3+ Ione ferro (III) Ione ferrico
Fe 2+ Ione ferro (II) Ione ferroso
Na+ Ione sodio Ione sodio
Ca 2+ Ione calcio Ione calcio
Zn 2+ Ione zinco Ione zinco
Ioni positivi poliatomici,
Ione+ nome dell’elemento legato all’idrogeno + desinenza onio
H3O+ Ione ossonio
PH4+ Ione fosfonio
Eccezione: NH4+ Ione ammonio
Ioni negativi (anioni)
Ione+ nome dell’elemento + desinenza uro (dall’inglese ide)
Br- Ione bromuro
F- Ione fluoruro
S2- Ione solfuro
Eccezioni:
OH- Ione idrossido Ione ossidrile
H- Ione idruro
Idracidi
Composti formati dall’idrogeno con elementi non metallici del VI e VII
gruppo)
Acido + nome dell’elemento non metallico + suffisso idrico
HCl
HBr
HF
H2S
HCN
Acido cloridrico
Acido bromidrico
Acido fluoridrico
Acido solfidrico
Acido cianidrico
Ossidi acidi (anidridi)
Non metallo + O
Tradizionale
N2O3
N2O5
Anidride nitrosa
IUPAC*
triossido di diazoto
Anidride nitrica
La nomenclatura IUPAC utilizza dei prefissi numerici per indicare i rapporti
numerici tra gli atomi
Ossidi basici (ossidi)
Metallo+ ossigeno
Na2O
ossido di sodio
Fe2O3 ossido ferrico/triossido di diferro/ossido di ferro (III)
Composti ternari
Idrossidi
Composti formati da un catione metallico e da uno o più gruppi
OH- che ne neutralizzano la carica
Idrossido di + nome del metallo + stato di ossidazione(notazione
di Stock)
suffisso oso (n.o. ↓) o ico (n.o. ↑)
NaOH
Mg(OH)2
Fe(OH)3
Fe(OH)2
Idrossido
Idrossido
Idrossido
Idrossido
di sodio
di magnesio
di ferro (III) / Idrossido ferrico
di ferro (II) / Idrossido ferroso
Composti ternari
Acidi ossigenati (ossoacidi)
Composti formati da H + un elemento non metallico + ossigeno.
Acido + nome dell’elemento non metallico + stato di ossidazione
(suffisso oso per n.o. ↓ o ico per n.o. ↑)
HNO3
HNO2
H2SO4
H2SO3
Acido nitrico
Acido nitroso
Acido solforico
Acido solforoso
Quando il non metallo presenta più di due n.o.
uso dei prefissi ipo (n.o. ↓) e per (n.o. ↑)
HClO4 Acido perclorico
HClO3 Acido clorico
HClO2 Acido cloroso
HClO Acido ipocloroso
Ossoanioni
Ione + nome dell’elemento non metallico + stato di
ossidazione (suffisso ito per n.o. ↓ o ato per
n.o. ↑)
SO42- Ione solfato
SO32- Ione solfito
NO3- Ione nitrato
NO2- Ione nitrito
Se il non metallo presenta più di due n.o.
uso dei prefissi per (n.o. ↑) e ipo (n.o. ↓)
ClO4- Ione perclorato
ClO3- Ione clorato
ClO2- Ione clorito
ClO- Ione ipoclorito
Sali degli acidi ossigenati
Nome del corrispondente ossoanione + nome del
catione:
CaSO4 Solfato di calcio
CaSO3 Solfito di calcio
NaNO3 Nitrato di sodio
NaNO2 Nitrito di sodio
Sali con atomi di idrogeno
Idrogeno + nome del sale corrispondente
NaHCO3 Idrogeno carbonato di sodio oppure
Bicarbonato di sodio
KHSO3 Idrogeno solfito di potassio
NaH2PO4 Diidrogeno fosfato di sodio
Sali di idracidi
Nome del corrispondente anione + nome del catione
NaCl
cloruro di sodio
NaS2
solfuro di sodio
Riassumendo
ACIDI
HX (HCl)
IDROSSIDI (basi)
SALI
HXO (H2SO4)
MeOH ( NaOH)
acido + idrossido = sale + acqua
HCl + NaOH = NaCl + H2O
- Idrico
-uro
H2SO4 + 2 NaOH = Na2SO4 + H2O
-ico
-ato
H2SO3 + 2 NaOH = Na2SO3 + H2O
-oso
-ito
ANIDRIDI (ossidi acidi)
CO2 + H2O = H2CO3
SO3 + H2O = H2SO4
OSSIDI (ossidi basici)
Na2O + H2O = 2 NaOH
FeO + H2O = Fe(OH)2
ACIDI DEL FOSFORO (V)
P2O5
+ H2O
H2P2O6
P2O5
+ 2H2O
H4P2O7
P2O5 + 3H2O
H6P2O8
HPO3
meta
piro
H3PO4
orto