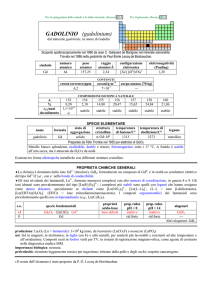
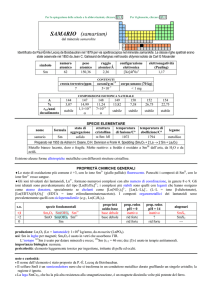
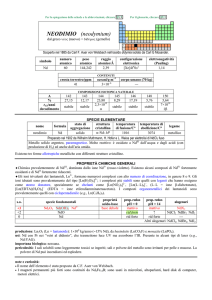
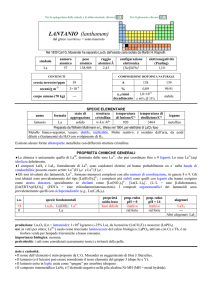
CORREZIONE
Più frequentemente questo processo si riferisce a:
odori e sapori sgradevoli;
torbidità;
quantità di Fe2+ e Mn2+ presenti;
durezza eccessiva;
Odori e sapori sgradevoli: si possono sviluppare nei
bacini di raccolta ad opera
della flora acquatica oppure
dipendono dall’inquinamento;
questi possono essere allontanati
aerando bene l’acqua oppure
assorbendoli su carbone o argilla;
Torbidità ed eventuali colorazioni: la prima viene
eliminata con la
precipitazione per
aggiunta di Al2(SO4)3;
la seconda, invece,
mediante l’ossidazione
con KMnO4 oppure
mediante assorbimento
su carbone attivo;
Quantità di ioni Fe2+ e Mn2+
superiori ai limiti previsti:
Fe2+: per quanto riguarda lo ione Fe2+, questo viene
ossidato a Fe3+ introducendo aria nell’acqua. I sali ferrici
che si formano essendo insolubili precipitano e mediante
filtrazione, su letti di quarzo, vengono allontanati;
Mn2+: per quanto riguarda lo ione Mn2+, questo viene
ossidato a MnO2, specie insolubile, per azione di un
energico ossidante come KMnO4 secondo la reazione:
3Mn2+ + 2MnO4 + 4OH = 5MnO2(s) + 2H2O
Il solido ottenuto viene allontanato per filtrazione.
Durezza eccessiva: per riportare la durezza di un’acqua
a valori normali vengono, in genere,
impiegati due metodi:
Metodo della calce o soda;
Metodo delle resine a scambio ionico;
Metodo della calce o soda: in questo metodo, poco
costoso, si aggiunge calce, Ca(OH)2, oppure soda,
Na2CO3, con formazione di carbonato di calcio insolubile
che precipita e può essere separato per filtrazione. In queste
condizioni si può ridurre sia la durezza temporanea che
quella permanente.
Durezza temporanea:
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3(s) + 2H2O
Durezza permanente:
CaCl2 + Na2CO3 = CaCO3(s) + 2NaCl
Metodo delle resine a scambio ionico: in questo
metodo le resine a scambio ionico impiegate sono
silicoalluminati di sodio naturali (zeoliti) e artificiali
(perdutiti), che hanno la proprietà di scambiare i loro ioni
con il calcio e il magnesio. Indicando con PNa2 una
generica resina in forma sodica si ha come meccanismo di
azione:
Ca(HCO3)2 + PNa2 = PCa + 2NaHCO3
MgCl2 + PNa2 = PMg + 2NaCl
In accordo a queste reazioni, la resina scambiatrice cede
ioni sodio e preleva dall’acqua calcio e magnesio.
La rigenerazione della resina viene effettuata con una
soluzione di NaCl al 10 20%.
POTABILIZZAZIONE
Consiste nel depurare l’acqua dai microrganismi in essa
presenti.
FASI NEL PROCESSO DI
POTABILIZZAZIONE
Preclorazione;
Flocculazione e decantazione;
Filtrazione;
Ozonizzazione;
Filtrazione su carbone attivo;
Postclorazione;
Preclorazione: vengono impiegate sostanze ossidanti e
antibatteriche come Cl2(g), NaClO e, più recentemente,
ClO2.
L’azione ossidante avviene su composti organici ed
inorganici ed hanno, naturalmente, azione battericida verso
microrganismi presenti nell’acqua. La quantità di cloro da
aggiungere nell’acqua è sempre leggermente superiore a
quella richiesta, per cui resta, nell’acqua, una certa quantità
di cloro (cloro residuo) che funziona da battericida nel caso
di processi di contaminazione nella rete di distribuzione.
I primi due agenti ossidanti possono reagire con le sostanze
organiche presenti, naturalmente, nell’acqua formando i
trialometani (THM) tra cui i clorofenoli di odore
sgradevole e tossici per l’uomo. Il ClO2, invece, non
reagisce con le sostanze organiche e quindi viene preferito.
Flocculazione e decantazione: queste operazioni si
eseguono tutte le volte che nell’acqua c’è la presenza di
numerose particelle in soluzione colloidale e quindi, per il
loro allontanamento, si rende necessario introdurre una
sostanza flocculante, in genere rappresentata da sali di
alluminio o ferro. Queste sostanze formano, per idrolisi, i
corrispondenti idrossidi che precipitano sottoforma di
fiocchi e trascinano, di conseguenza, con loro le particelle
sospese.
L’acqua che affiora sulla superficie dei decantatori, deborda
e passa su letti di quarzo.
Filtrazione: questa operazione viene eseguita facendo
passare l’acqua attraverso uno strato di sabbia e ghiaia che
simula il processo di dilavamento che accade, naturalmente,
per le acque piovane quando attraversano il terreno.
Le eventuali sostanze inquinanti che restano nell’acqua
dopo la filtrazione vengono rimosse facendo passare
l’acqua attraverso un filtro.
Ozonizzazione: questa operazione a carico dell’ozono (O3)
ha una spiccata azione battericida, virulicida e ossidante,
data l’azione fortemente ossidante dell’ozono.
La produzione di ozono si ottiene facendo passare aria
depurata e deumidificata tra le scariche elettriche di un
condensatore.
Tuttavia questa operazione ha lo svantaggio di essere
costosa nonché porta alla formazione di radicali perossidici.
Filtrazione su carbone attivo: e’ una operazione con la
quale si rimuove ogni piccola particella sospesa e viene
realizzata facendo passare il campione di acqua su filtri, a
forma circolare, di carbone attivo.
Postclorazione: con questa operazione, l’acqua viene
sottoposta ad un ulteriore processo di clorazione e in genere
si preferisce con il biossido di cloro.
Il suddetto processo occorre per evitare eventuali processi
di contaminazione che l’acqua potrebbe subire durante il
percorso nella rete di distribuzione prima di raggiungere i
vari utenti.
PRINCIPALI ANALISI CHIMICHE
DELL’ACQUA
Determinazione della durezza totale;
Determinazione del residuo fisso;
Determinazione dello ione ammonio (NH4+);
Determinazione dello ione nitrito (NO2);
Determinazione dello ione nitrato (NO3);
Determinazione dei tensioattivi anionici;
Determinazione dello ione cloruro (Cl);
DETERMINAZIONE DELLA DUREZZA
TOTALE
Si effettua mediante titolazione volumetrica impiegando
come reattivo l’EDTA, agente complessante per i metalli
alcalinoterrosi.
Come
indicatore
si
NeroEriocromoT (NET).
Reazione:
Mz+ + EDTA = M(EDTA)
EDTA (acido EtilenDiamminoTetraAcetico)
OOCH2C
CH2COO
NCH2CH2N
OOCH2C
CH2COO
utilizza
il
Il vantaggio nell’uso di agenti complessanti è legato al fatto
che con i metalli formano complessi a stechiometria 1:1
caratterizzati da elevate costanti di formazione.
DETERMINAZIONE DEL RESIDUO FISSO
L’acqua in esame, introdotta in una capsula di porcellana
pesata, viene evaporata ed essiccata in termostato a 100C e
successivamente a 180C. In corrispondenza della prima
temperatura viene evaporata l’acqua come solvente in
corrispondenza, invece, della seconda temperatura si
allontana l’acqua di tipo molecolare.
La differenza di peso, prima e dopo i trattamenti termici,
espressa in mg/l, fornisce il residuo fisso del campione
d’acqua. In corrispondenza del valore ottenuto le acque si
possono classificare come dolci, dure o altamente dure
influenzando, così, il loro uso.
DETERMINAZIONE DELLO IONE
AMMONIO (NH4+)
Si impiega la reazione con il reattivo di Nessler (soluzione
alcalina di K2[HgI4]). In presenza di ammonio si ha una
colorazione gialla in accordo alla reazione:
Reazione:
NH4+ + 2[HgI4]2− + 4OH−
O
Hg
Hg
+
+ −
NH
4 I
+ 7I− + 3H2O
Il dosaggio viene eseguito spettrofotometricamente via
assorbimento molecolare.
DETERMINAZIONE DELLO IONE
NITRITO (NO2)
Si utilizza il reattivo di Griess (soluzione di acido
solfanilico
in
ambiente
acido
e
soluzione
di
naftilammina) che in presenza di nitriti forma un
diazocomposto colorato in rosso.
Il dosaggio viene eseguito spettrofotometricamente via
assorbimento molecolare.
DETERMINAZIONE DELLO IONE
NITRATO (NO3)
La
determinazione
può
essere
realizzata
sia
qualitativamente che quantitativamente.
METODI QUALITATIVI
metodo della difenilammina: la difenilammina viene
ossidata dai nitrati a derivato chinonico colorato in azzurro;
metodo della brucina: la brucina, alcaloide, forma con lo
ione nitrato, in soluzione solforica, una colorazione rossa
che col tempo passa a giallo;
METODI QUANTITATIVI
metodo con l’acido 2,4fenoldisolfonico: l’acido
reagisce con i nitrati per formare l’acido 6nitro2,4
fenoldisolfonico, il cui sale sodico è di colore giallo. Il
dosaggio
è
eseguito
spettrofotometricamente
via
assorbimento molecolare;
metodo della spettrofotometria UV: l’acqua contenente
lo ione nitrato viene letta direttamente nella regione UV alla
lunghezza d’onda di 210nm che corrisponde al massimo di
assorbanza per lo ione nitrato a differenza del valore di
lunghezza d’onda di 193,6nm che corrisponde, invece,
all’assorbimento caratteristico dello ione nitrato.
DETERMINAZIONE DEI TENSIOATTIVI
ANIONICI
I tensioattivi più comunemente ricercati sono quelli anionici
in quanto trovano larga applicazione nelle industrie per la
preparazione di detergenti.
Si sfrutta la reazione con il blu di metilene, che forma un
complesso di colore azzurro estraibile in cloroformio.
Il dosaggio viene eseguito spettrofotometricamente via
assorbimento molecolare.
DETERMINAZIONE DELLO IONE
CLORURO (Cl)
Si effettua per titolazione volumetrica impiegando il
metodo di Mohr. Si utilizza una soluzione di AgNO3 e
come indicatore una soluzione al 5% di K2CrO4. In
presenza di cloruro ha luogo la reazione:
Reazione:
Ag+ + Cl = AgCl(s)
In alternativa è anche possibile, a reazione ultimata,
separare il solido, costituito da AgCl, lavarlo, seccarlo
all’aria e pesarlo. La quantità in peso fornisce il contenuto
di cloruro presente nell’acqua.
ACQUE MARINE
Più del 70% della superficie terrestre è ricoperta da acqua,
9
3
21
3
3
circa 10 km o più precisamente 1,37x10 dm . Ogni km
contiene disciolti circa 35 milioni di tonnellate di sali
inorganici.
Questa particolare soluzione di sali in acqua (SW = sea
water) è oggetto di studio della OCEANOGRAFIA
CHIMICA.
L'oceano
deve
la
elevata
concentrazione
di
sali
all'accumulo di acidi volatili (HCl, H2SO4, CO2),
provenienti da attività vulcanica e dalla reazione, attraverso
millenni, di questi acidi con componenti basici (carbonati,
ossidi), da dilavamento di rocce portati in mare da fiumi
secondo la classica reazione:
acido + base = sale + acqua
L.G.Sillén ha trattato, per via teorica, gli equilibri chimici
coinvolti nell’oceano.
Il modello di equilibrio stabilito da Sillén descrive una SW
che non è molto differente da ciò che attualmente è
l'oceano. Il modello, anche se idealizzato e non
perfettamente conforme allo stato attuale della realtà, ha
permesso di fornire alcune risposte:
I rapporti tra ioni Na+, K+, Mg2+ e Ca2+ sono pressoché
costanti;
La concentrazione di carbonato in SW è 0,0023moli/kg;
Il pH nella massa oceanica è compreso in limiti
abbastanza ristretti intorno a 8,1 (valore che verrà in seguito
utilizzato per eseguire calcoli sull’oceano).