DERIVATIZZAZIONE DEL CAMPIONE
Che cos’è la derivatizzazione:
Insieme delle reazioni chimiche che trasformano
l'analita in un derivato con caratteristiche chimicofisiche adeguate alla sua valutazione analitica
Perchè derivatizzare:
1. Per permettere l’analisi del composto altrimenti non
fattibile (es. non volatilità, poco stabilità).
2. Per modificare il comportamento cromatografico
(aumento della risoluzione, modifica del rt, più picchi,
uno picco solo ma brutto).
3. Per modificare la rilevabilità, rendere o aumentarne
(UV, Fluorescenza, ECD, PCI/MS, NCI/MS, …).
4. Per modificarne lo spettro di massa per la
caratterizzazione strutturale (EI, PCI, MS/MS).
Derivatizzazione
Prima
rt (min)
rt (min)
rt (min)
rt (min)
Dopo
Esempi di analisi
di campioni
prima e dopo
derivatizzazione
Linee guida per l’interpretazione degli spettri EI
9. Ricorrere a derivati per la conferma della struttura
Che cosa opera la derivatizzazione
Aumento di volatilità (es. monosaccaridi):
•Elimina la presenza di gruppi polari (OH, NH, SH). La
derivatizzazione deve diminuire la polarità dell’analita in
modo da minimizzare i fenomeni di adsorbimento dovuti
ai gruppi polari sui siti attivi della colonna
gascromatografica: infatti il sovrapporsi di processi di
adsorbimento ai processi di pura ripartizione determina la
diminuzione del potere risolutivo della colonna con
conseguente allargamento dei picchi cromatografici e
diminuzione della sensibilità.
•Elimina le forze di attrazione intermolecolari che
diminuiscono la volatilità dovute ai gruppi polari.
•Gruppi funzionali modificati (contengono O, S, N e P)
con idrogeni disponibili.
Che cosa opera la derivatizzazione:
Aumento della rilevazione (es. steroidi, colesterolo)
Aumento della stabilità: riduzione della decomposizione
termica
Aumento della sensibilità LOD (es. introduzione di
gruppi elettronattrattori = ECD)
Diminuzione della volatilità: per rendere possibile
l’analisi di composti a basso Mr così da separarli
dal picco del solvente
Modifica del comportamento cromatografico: accentua
le differenze tra i composti presenti nel campione
così da facilitarne la separazione (riduzione o
aumento del rt).
Requisiti della derivatizzazione
Il processo di derivatizzazione deve rispondere ad alcuni requisiti quali:
La derivatizzazione deve essere quantitativa sia per
l'analita che per lo standard interno e non deve introdurre
interferenti dovuti agli agenti derivatizzanti. (Controllare la
resa della reazione di derivatizzazione).
I derivati devono essere stabili e non devono subire
degradazioni nel processo di analisi (es. in GC o in HPLC).
Tipi di reazioni di derivatizzazione
Non esistono metodi di derivatizzazione "universali", cioè che
possano essere applicati indifferentemente a tutti gli analiti, ma per
ogni differente classe di composti chimici esistono delle procedure
standard che, a seconda della strumentazione del tipo di analisi,
possono essere applicate con buone probabilità di successo
Sililazione: la più diffusa in GC, rende il composto
volatile (introduce un gruppo contenente Si).
Alchilazione:utilizzata come seconda scelta per un
successiva reazione o per proteggere idrogeni attivi.
Acilazione: utilizzata prevalentemente per introdurre
gruppi alogenati.
PROCEDURA DI
DERIVATIZZAZIONE
ESTRATTO PURIFICATO
1. -Aggiunta dei solvente e dei reagenti di derivatizzazione
2. -Condizioni di reazione (temperatura, tempo)
3. -Eventuale allontanamento dei reagenti e del solvente
4. -Eventuale aggiunta di solvente per sciogliere il solido
CAMPIONE ANALITICO
Introduzione nel sistema cromatografico
ANALISI STRUMENTALE
PRINCIPALI GRUPPI FUNZIONALI CHE
POSSONO ESSERE DERIVATIZZATI
Classe di composti
Gruppo funzionale
Alcoli
Acidi
Amidi
Ammine
Immine
Ossime
Tioli
Solfonici
Fosfonici
-OH
-COOH
-CONH2; -COONHR
-NH2;-NHR;-NR2
=NH
=NOH
-SH
-SOH
-POH
ALTRI GRUPPI CHE POSSONO ESSERE DERIVATIZZATI
Aldeidi,chetoni
Alcheni
C=O
C=C
Sililazione
La sililazione produce dei silil-derivati più volatili, più
stabili alla decomposizione termica ma “poco stabili”
nel tempo. E’ una delle reazioni più utilizzate.
1. Rimpiazza l’idrogeno attivo (sito protico) con il gruppo
TMS (trimetilsilil) riducendo le interazioni dipolodipolo e aumentando la volatilità.
2. Avviene tramite un attacco nucleofilo con meccanismo
SN2.
3. Migliore gruppo uscente migliore è la sililazione.
4. I reagenti di sililazione reagiscono velocemente con
acqua ed alcoli (usare solventi privi di tracce di acqua o
con idrogeni mobili: solventi aprotici).
5. Spesso occorre aggiungere dei solventi.
Sililazione
6. Spesso occorre scaldare < 60°C per 10-15 min. Basse temp
e breve tempo di reaz per “evitare degradazioni”
(ATTENZIONE in alcuni casi si può/deve scaldare a temp.
superiori (100-150°C) o nel caso di gruppi “nascosti”
occorrono tempi di reazione superiori).
7. Reagenti (sililanti) ordinati per capacità di donare gruppi
silil:
MSTFA < BSA < BSTFA < BSTFA+1%TMCS < TMSI
8. I silil-derivati sono sensibili a reazioni di idrolisi in
presenza di umidità riformando il prodotto iniziale.
9. Utilizzati per derivatizzare alcoli, amine, amidi, acidi
carbossilici, fenoli, tioli, steroidi, amine biogene, alcaloidi
e dalle forme enoliche di chetoni/aldeidi.
Sililazione
Utilizzati per derivatizzare alcoli, amine, amidi, acidi
carbossilici, fenoli, tioli, steroidi, amine biogene, alcaloidi
e dalle forme enoliche di chetoni/aldeidi.
Reazione di sililazione
Le reazioni di sililazione avvengono per sostituzione di un
idrogeno da un gruppo OH, NH ed SH.
R3Si-X + R’Y-H
R3Si-YR’ +HX
Attacco nucleofilo di un eteroatomo elettronegativo al silicio
+δ
R’
-δ
H-Y + -Si –X [ Y- - -Si--X ]
R’
H
R’Y-Si + HX
Ordine di reattività:
alcoli > fenoli > ac. Carbossilici >amine > amidi
Alcoli:
Amine:
Io > IIo > IIIo
Io > IIo
Reattivi per Sililazione 1
BSA =N,O-bis-(Trimetilsilil)-acetamide
BSTFA =N,O-bis-(Trimetilsilil)-trifluoroacetamide
CH3 -
BSA
MW 203.4
bp. 71-73oC/35mm
Possono non reagire
completamente con la
BSTFA:
-Per amidi, amine
secondarie,
idrossili
stericamente impediti
si aggiunge 1% di
TriMetilCloroSilano
Reattivi per Sililazione 2
TMSI = N-trimetilsilil-imidazolo
-Reagisce con i gruppi idrossilici e
carbossilici ma non con amidi e amine.
-Rende possibile schemi di
multi-derivatizzazione.
MTBSTFA = N-metil-N-(tert-butildimetilsilil)-trifluoroacetamide
-Reagisce rapidamente 5-20min con resa >96%.
-Eteri/Esteri TBDMS sono 104 volte più stabili dei relativi TMS
-Formano ioni ad m/z = Mr-57 molto intensi in EI/MS.
Sililazione -solventi
Acilazione
1. Riduce la polarità dei gruppi funzionali: -OH, -SH, -NH
per sostituzione dell’idrogeno reattivo formando esteri,
tioesteri ed amidi ed è una alternativa alla sililazione.
2. Migliora le proprietà cromatografiche riducendo le
interazioni aspecifiche di adsorbimento (evita la
formazione di picchi “scodati” in GC).
3. Può conferire una maggior stabilità (es a fenomeni di
ossidazione o di decomposizione termica) e maggior
volatilità (carboidrati-aminoacidi).
4. Sfrutta generalmente l’azione di un acido carbossilico o
di un suo derivato (cloruro – anidride).
5. Derivati più stabili rispetto ai silil-derivati
Acilanti
Le reazioni di acilazione sono eseguite utilizzando tre tipi di
agenti:
1. - Anidridi di acidi carbossilici:
anidride acetica, propionica, butirrica
anidridi di perfluoroacidi: eptafluorobutirrica,
pentafluoropropionica, trifluoroacetica (ECD,
NCI/MS)
2. - Cloruri acilici:
pentafluorobenzoil-cloruro
3. - Acil derivati molto reattivi (acil-amidi, acil-imidazoli,
acil-fenoli):
eptafluorobutiril-imidazolo,
N-metil-N-bis(trifluoroacetamide) (MBTFA),
Acilanti
• Utilizzata per sostituire idrogeni reattivi (-OH, -SH, NH) formando esteri, tioesteri.
– Anidridi di perfluoroacidi (utili con ECD, NCI/MS)
– Anidride pentafluoropropionica = PFPA o PFPPA
– Anidride pentafluorobutirrica = HFBA o HFBAA
Acilazione
•
•
R-CO-X + R’Y-H R-CO-YR’ + HX
Il reagente acilante può perdere il gruppo X (= Cl
o OCOR) come gruppo elettrofilo, nucleofilo o
come radicale libero.
R-CO+ + X-
•
R-CO-X
R-CO-
+ X+
.
R-CO
+ X.
Acilazione
•
R-CO-X + R’Y-H R-CO-YR’ + HX
Es:
•
R-NH2 + R’COCl R-NH-CO-R’ + HCl
Pentafluorobenzoil-Cloruro/bromuro
F5Ph-COCl + R’-OH, R’-NH2, R’-SH F5Ph-CO-XR’ (X= O, N, S)
Alchilazione
• Utilizzata per sostituire idrogeni reattivi presenti in
composti alifatici-aromatici con gruppi funzionali quali:
-COOH, -OH, -SH, R-NH-R’, -NH2, -CONH2, CONHR’, R-CO-CH2-CO-R’.
• I derivati sono meno polari dei prodotti di partenza
• Reagisce con gruppi carbossilici e fenoli formando
esteri, eteri.
• Forma anche tioeteri, tioesteri, N-alchilamine, amidi,
sulfonamidi.
–
–
–
–
HCl in metanolo
BF3 in metanolo
Diazometano (CH2N2)
Pentafluorobenzilbromuro = PFBBr
Alchilazione
• Acidi carbossilici
R-COOH + CH2N2 R-COOCH3 + N2
• Fenoli
Ph-OH
Ph-OCH3
• Alcoli, acidi,…
R-OH
+PFB-Br R-O-CH2C6F5
R-COOH
+PFB-Br R-COO-CH2C6F5
Ph-SO2-NH2 +PFB-Br Ph-SO2-N(CH2C6F5)2
Derivatizzanti 1
Derivatizzanti 2
Derivatizzanti 3
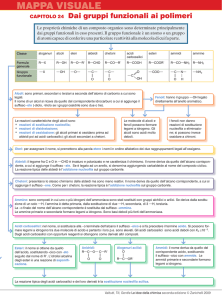
PRINCIPALI TECNICHE DI
DERIVATIZZAZIONE
Gr. funzionale
Reazione
Derivato
ALCHILAZIONE
Alcoli
Acidi
Ammine
ROH
RCOOH
RNH2
ROR’
RCOOR’
RNR’2
Eteri
Esteri
Ammine
ACILAZIONE
Alcoli
Ammine
ROH
RNH2
R’COOR
R’CONHR
Esteri
Ammidi
SILILAZIONI
Alcoli
Ammine
Ammidi
Acidi
ROH
RNH2
RCONH2
RCOOH
ROSiR’3
RN(SiR’3)2
RCON(SiR’3)2
RCOOSiR’3
Eteri
Ammine
Ammidi
Esteri
PRINCIPALI TECNICHE DI
DERIVATIZZAZIONE
Gruppo funzionale
Reazione
Derivato
CONDENSAZIONE
Chetoni
R2C=O
R2C=NOH
Ossime
CICLIZZAZIONE
Glicoli
HO-CHR-CHR-OH
RCH-CHR
O-R’-O
Eteri ciclici
Reagenti per
aminoacidi (HPLC)