Distribuzione e composizione dei liquidi
corporei
Cavità principali del
corpo umano
Dee Unglaub Silverthorn, Fisiologia umana © 2010 Pearson Italia S.p.A
Organizzazione
generale
dell’organismo:
un visione
semplificata
Compartimenti liquidi dell’organismo
Compartimenti
liquidi del
corpo
8%
25%
67%
1,5% (liquido transcellulare)
Contenuto in cationi ed anioni dei
liquidi corporei
Misura degli spazi idrici
(Principio di diluizione di un tracciante)
C
Q
V
V
Q
C
Q = quantità del tracciante.
V = volume spazio idrico.
C = concentrazione tracciante.
Q1 C1 V1 V2
V2
Q2
C2
C1 V1
C2
Q2
Q1
Volume idrico
totale
Volume idrico
extracellulare
Volume
plasmatico
ossido
di deuterio
Inulina
Blu Evans
Urea
Tiocianato
Albumina
iodinata
2H O
2
Antipirina
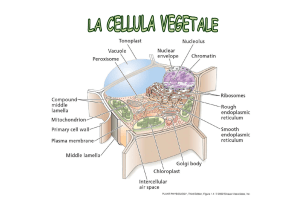
LA MEMBRANA CELLULARE
e
I CANALI IONICI
Prove dell’esistenza della membrana
• I coloranti entrano difficilmente nelle cellule,
ma se vengono microiniettati, colorano
rapidamente il citoplasma.
• Una soluzione ipertonica provoca perdita di
acqua dalla cellula, mentre una ipotonica la
rigonfia (W. Pfeffer).
• Se si aumenta la pressione di turgore
endocellulare oltre un certo limite la cellula
esplode.
Modelli della membrana plasmatica
Evidenziazione delle membrane plasmatiche
al microscopio elettronico (1960)
Il metodo del criodecapaggio ha permesso la
visualizzazione della struttura fine della
membrana superficiale (1970)
Modello a mosaico fluido
Funzioni generali di una
membrana cellulare
• Isolamento fisico
• Regolazione degli scambi con l’ambiente
• Comunicazione tra cellula e ambiente
• Supporto strutturale
I lipidi di membrana
Fosfolipide
Colesterolo
Organizzazione dei lipidi in doppio strato
1925 E. Gorter e F. Grendel
1925 Fricke
A = area della membrana
C
A
4 l
= costante dielettrica dei lipidi (6)
l = spessore della membrana (50 Å) C = capacità della membrana (1 Farad · cm-2)
Studio della diffrazione ai raggi X della mielina, delle membrane degli
eritrociti e dei bastoncelli hanno mostrato una struttura a doppio strato lipidico.
Al microscopio elettronico lo spessore della membrana è risultato pari a 70 Å.
Fosfolipidi di membrana
Dee Unglaub Silverthorn, Fisiologia umana © 2010 Pearson Italia S.p.A
Formazione del doppio strato fosfolipidico
Formazione delle micelle
Fluidità del doppio strato lipidico
Spettroscopia a risonanza elettronica di spin (ESR).
Fluidità del doppio strato lipidico
CARBOIDRATI :
I carboidrati di membrana sono generalmente polimeri del glucosio legati
alle proteine di membrana (glicoproteine) oppure ai lipidi di membrana
(glicolipidi). Essi si trovano esclusivamente sulla superficie esterna
della cellula, dove formano uno strato protettivo detto glicocalice.
Le glicoproteine sulla superficie della cellula svolgono un ruolo chiave
nella risposta immunitaria dell’organismo.
Un esempio è dato dai gruppi sanguigni ABO, che vengono determinati
dal numero e dalla composizione degli zuccheri legati agli sfingolipidi
della membrana dei globuli rossi.
40% nel monostrato
esterno
della
membrana
delle
cellule
accessorie
del sistema nervoso
(glia e cellule di
Schwann).
I glicolipidi
Glicolipidi neutri
Gangliosidi
Zattere lipidiche (lipid raft)
Funzione:
•Segregazione di proteine,
•Contenuto informazionale
degli antigeni di superficie
•Mantenimento
dell’asimmetria funzionale
delle cellule polarizzate
•Trasduzione del segnale
•Ingresso in cellula di molti
virus (HIV)
Sfingolipidi (in arancione)
Fosfatasi alcalina placentare (in giallo)
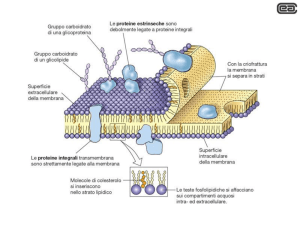
Proteine della membrana plasmatica
• Proteine integrali di membrana (proteine intrinseche o
di transmembrana)
– Interazioni idrofobiche con l’interno.
• Proteine associate (proteine periferiche o estrinseche).
– Interazioni elettrostatiche con le proteine integrali o con i
fosfolipidi.
* Da un punto di vista strutturale, le proteine di membrana vengono
suddivise in tre categorie : proteine intrinseche, proteine estrinseche e
proteine ancorate a lipidi.
PROTEINE INTEGRALI : le molecole di queste proteine sono costituite da catene
polipeptidiche particolarmente lunghe e variamente convolute, che attraversano più
volte il doppio strato lipidico interamente, tramite domini strutturali ad α elica.
Struttura delle proteine transmembranali
Segmento transmembrana
Grafico di idropatia (indice d’idropatia)
Associazione delle proteine al doppio strato fosfolipidico
Associazione a
fosfatidil-inositolo
Singola
Interazioni non covalenti
ad altre proteine
elica
eliche multiple
Associazione
covalente a lipidi
PROTEINE PERIFERICHE : le molecole di queste proteine sono prive di
caratteristiche anfipatiche e non attraversano l’intero spessore della membrana
cellulare. Si legano debolmente a proteine transmembranali o alle regioni
polari dei fosfolipidi, sia sul versante extracellulare (proteine di superficie, che
sono spesso glicosilate), sia sul versante intracellulare.
Le proteine di superficie hanno spesso carattere di enzimi capaci di operare
specificamente su substrati che vengano in contatto direttamente con la
membrana stessa (ad esempio, nelle cellule dell’epitelio intestinale).
Le proteine periferiche sul lato intracellulare possono svolgere funzione
enzimatica, regolatrice o strutturale.
PROTEINE ANCORATE ai LIPIDI :
queste proteine sono legate covalentemente a code
lipidiche che si inseriscono nel doppio strato,
in entrambi i lati della tela fosfolipidica.
Legame tra proteine e lipidi di membrana
Legame carbamidico
Legame tioeterico
Funzioni delle proteine di membrana
•
•
•
•
Elementi strutturali
Enzimi
Recettori
Trasportatori (canali o carrier)
Proteine strutturali
Le proteine strutturali di membrana hanno diversi ruoli:
1 - legare la membrana al citoscheletro
2 - formare le giunzioni con le cellule adiacenti
3 - collegare le cellule alle proteine della matrice
Gli enzimi
I recettori.
Queste proteine fanno parte
del sistema di trasmissione di
segnali
chimici.
Ogni
recettore è specifico per un
determinato ligando.
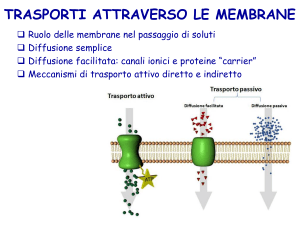
Proteine di trasporto.
Le proteine di trasporto sono
fondamentali per gli scambi tra
citosol e matrice extracellulare.
Si classificano solitamente in
due tipi: canali e carriers.
Canali.
Solitamente i canali
possiedono una apertura centrale
che è controllata o meno da un
meccanismo che ne permette la
chiusura. L’apertura o la chiusura
del canale può essere controllata da
molecole,
da
voltaggio
o
meccanicamente
Carrier.
Queste proteine legano
molecole specifiche e le trasportano
attraverso la membrana con
meccanismi
che
prevedono
cambiamenti conformazionali della
proteina stessa.
Caratteristiche dei canali ionici
L’ apertura dei canali ionici influenza l’equilibrio chimico ed elettrico
della cellula determinando flussi di ioni che generano modificazioni
rapide del suo potenziale transmembrana.
Possono essere
aperti chiusi inattivati
• Pori intramembrana
• Selettività
• Permeabilità
Selettività dei
canali ionici
I canali ionici possono avere elevata
selettività per una determinata
specie ionica o permettere il
passaggio di diversi tipi di ioni (Na+,
K+ e Ca2+).
Gli ioni sono circondati da una corona
di molecole di H2O (solvatazione), la
cui dimensione è proporzionale alla
concentrazione della carica elettrica
ionica.
Ione con raggio atomico piccolo
maggiore concentrazione carica
maggiore solvatazione
Carica: Na+ = K+
Dimensioni (raggio atomico): Na+ < K+
Idratazione (raggio solvatazione):
Na+ > K+
Selettività
dei canali
ionici
•Dimensioni ioniche
•Carica dello ione
•Energia di idratazione
•Diametro del poro
La selettività dipende da uno specifico filtro molecolare, costituito da residui
aminoacidici polari (regione P), che stabiliscono legami labili con lo ione.
Lo ione lascia una parte rilevante di molecole di H2O, si lega per un
tempo brevissimo (< s) al sito specifico e attraversa il canale spinto
dal gradiente elettrochimico.
Canale del K+
Selettività del canale del K+ e del Na+
Canali presenti nelle membrane cellulari:
Passivi: sempre aperti, il flusso ionico è determinato dalla forza elettrochimica
esistente tra i due versanti della membrana.
Coinvolti nella genesi del potenziale di membrana.
Ad accesso variabile: possiedono un meccanismo che ne regola l’apertura a
seguito di stimoli specifici di natura elettrica (voltaggio-dipendenti), chimica
(ligando-dipendenti) o meccanici.
Responsabili dell’insorgenza di segnali elettrici nelle cellule eccitabili
Canale sempre aperto
Canale a cancello: solitamente
chiusi si aprono in risposta ad un
fattore specifico
La direzione del flusso ionico dipende dal gradiente elettro-chimico esistente ai
lati della membrana:
Gradiente di concentrazione (forza chimica)
Differenza di potenziale elettrico (forza elettrica)
Canali ionici passivi (Na+, K+)
(non-gated channels)
Leakage = flusso ionico
Permeabilità dei canali ionici
Apertura e chiusura dei canali ionici ad accesso variabile
• Canali ionici aperti da
ligandi.
• Canali ionici aperti da
fosforilazione.
• Canali ionici aperti dal
voltaggio (voltaggiodipendenti).
• Canali ionici aperti da
stiramento.
• Canali ionici delle gap
junction.
Canali ionici aperti dal voltaggio
(Na+, K+ e Ca2+)
Questi canali possiedono
una
porzione
particolarmente sensibile
alle
variazioni
del
voltaggio (sensore). Il
movimento delle cariche
di questa zona sembra
responsabile dell’apertura
del
cancello
di
attivazione.
Canali ionici
aperti da ligandi
Sono canali il cui stato di
apertura è regolato da un
segnale chimico (es.
neurotrasmettitore)
Recettore-canale dell’acetilcolina
Inattivazione
Pur perdurando lo stimolo specifico che determina l’apertura del canale, il transito
degli ioni è impedito. Chiusura del canale ad opera dello stesso stimolo che lo ha
aperto.
Dipendenza dal voltaggio: Il
perdurare delle modificazioni del
voltaggio causa un cambiamento
conformazionale di una regione del
canale (canale del Na+).
Dipendenza dallo ione: Lo ione
trasportato si lega al canale
bloccandolo (canali del Ca2+).
Dipendenza dalla defosforilazione
Un canale dallo stato aperto può passare a quello chiuso o refrattario.
Una volta inattivato torna allo stato aperto solo se passa attraverso lo stato chiuso.
Giunzioni comunicanti (gap)