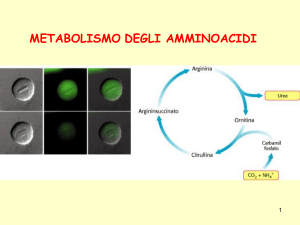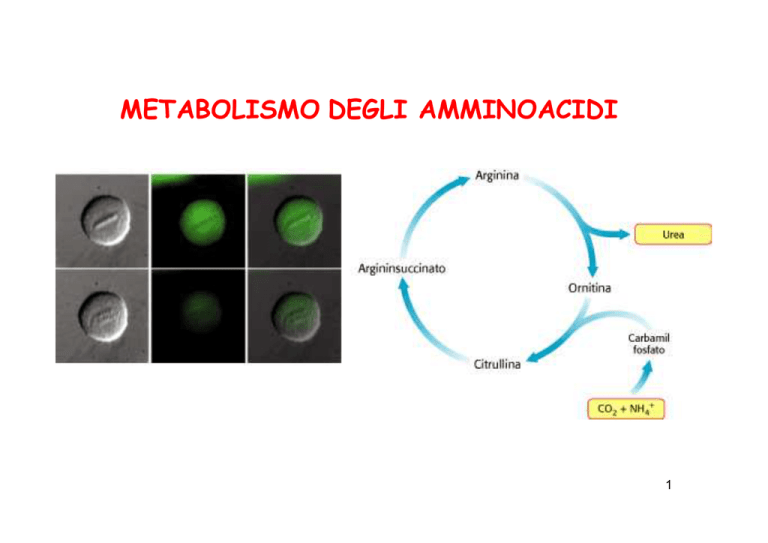
METABOLISMO DEGLI AMMINOACIDI
1
Metabolismo degli amminoacidi:
1. Degradazione delle proteine
2. Incorporazione dell’azoto nell’urea
3. Sintesi dei singoli amminoacidi
2
Le cellule sintetizzano continuamente le proteine
partendo dagli amminoacidi e le degradano
ottenendo amminoacidi
3 funzioni:
1) Conservare il materiale nutriente nella forma di proteine
2) Eliminare le proteine anomale
3) Permettere la regolazione del metabolismo cellulare
3
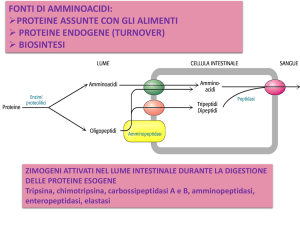
DIGESTIONE DELLE PROTEINE
PROTEASI GASTRICHE
ATPasi H+,K+
- pepsina (endopeptidasi)
PROTEASI PANCREATICHE
-tripsina (endopeptidasi)
-chimotripsina (endopeptidasi)
pH 7.4
pH 1
gradiente di pH
-elastasi (endopeptidasi)
-carbossipeptidasi A e B (esopeptidasi)
PEPTIDASI INTESTINALI
4
5
5
Alcune proteine non possono essere correttamente digerite da individui
che presentano alcune patologie.
MORBO CELIACO
MORBO DI HARTNUP
6
Degradazione intracellulare delle proteine
a. Degradazione lisosomiale
b. Ubiquitina
c. Proteasoma
7
A. Degradazione lisosomiale
-
i lisosomi mantengono un pH interno di circa 5.0
gli enzimi che contengono sono attivi ad un pH acido
Processi normali e patologici associati ad un’aumentata attività lisosomiale
-
regressione dell’utero dopo il parto
atrofia muscolare causata dal disuso o da ferite traumatiche
artrite reumatoide
8
B. Ubiquitina
Struttura ai raggi X dell’ubiquitina
IL TURNOVER DELLE PROTEINE E’ STRETTAMENTE
REGOLATO
• Come fa una cellula a identificare le proteine che devono essere
degradate?
• L’ UBIQUITINA, una piccola proteina di peso molecolare 8,5 Kd,
presente in tutte le cellule eucariotiche, è il segnale che identifica le
proteine destinate alla distruzione
L’ UBIQUITINA è l’equivalente cellulare della “MACCHIA NERA “ nel libro
“ L’ ISOLA DEL TESORO di Robert Louis Stevenson: è un segnale di
“ CONDANNA A MORTE “.
Il legame dell’ubiquitina alla proteina bersaglio è attuato da un enzima chiamato E3
10
Alcune condizioni patologiche illustrano molto chiaramente l’importanza
della regolazione del ricambio delle proteine:
1. Il virus del papilloma umano (HPV) produce una proteina che attiva
uno specifico enzima E3.
2. L’ enzima lega l’ ubiquitina alla proteina oncosoppressore p53 e ad
altre proteine che controllano i meccanismi di riparazione del DNA,
che sono di conseguenza distrutte
3. L’attivazione di questo enzima E3 si osserva nel 90% dei carcinomi
della cervice
11
Se l’ubiquitina è il segnale di morte chi esegue la
sentenza ?
L’esecutore è un grande complesso detto proteasoma o
proteasoma 26 S che digerisce la proteine combinate con
l’ubiquitina
Questo complesso proteolitico ATP-dipendente,
dipendente composto
da numerose subunità, non degrada l’ubiquitina (che viene
reciclata) mentre i prodoti peptidici sono ulteriormente
degradati
12
PROTEASOMA
Il proteasoma 26 S è costituito da due componenti:
1) Il complesso 20 S costituito da due copie di 14 subunità con una
massa di 700 Kd, che contiene l’ attività catalitica.
2) Il complesso 19 S o complesso regolatore
13
Questa classe di ATPasi, che si trovano in tutti gli esseri
viventi, è associata ad un gran numero di funzioni cellulari,
comprese la regolazione del ciclo cellulare e la biogenesi
degli organelli
Il processo di ubiquitinizzazione e il proteasoma
collaborano nella degradazione delle proteine non più
necessarie
14
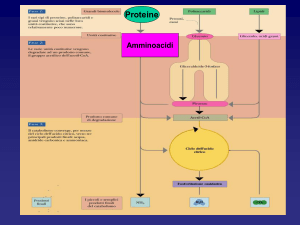
Qual è il destino degli amminoacidi liberi ?
15
La prima tappa della degradazione degli amminoacidi è la
rimozione del residuo azotato
16
17
Deamminazione degli amminoacidi
18
19
Transamminazione
20
amminoacido
NH3+
I
R-CH-COO-
O
II
R-C-COO-
α-chetoacido
α-chetoglutarato
O
II
-OOC-CH -CH -C-COO2
2
+
+
+
NH3
I
-OOC-CH -CH -CH-COO2
2
glutammato
21
Tutti gli amminoacidi, ad eccezione di prolina, lisina e treonina, subiscono la
transaminazione.
α-chetoacidi: α-chetoglutarato, piruvato e ossalacetato
22
Le transaminasi utilizzano il PLP come cofattore che viene convertito in piridossamina
23
TRANSALDIMMINAZIONE
In tutti gli enzimi dipendenti dal PLP il cofattore è legato, in assenza di substrato,
al gruppo ε-amminico di una lisina al sito attivo tramite una base di Schiff.
Il riarrangiamento che porta alla formazione della base di Schiff con il substrato
entrante è una reazione di transaldimminazione
24
LA REAZIONE DELLE TRANSAMINASI SEGUE UN MECCANISMO A PING-PONG
1) il gruppo α-amminico dell’amminoacido va a sostituirsi al gruppo ε-amminico
dell’enzima. La base di Schiff che si forma tra l’amminoacido e il PLP resta
fortemente legata all’enzima tramite interazioni multiple non covalenti.
2) la stessa base perde un protone dall’atomo di carbonio α dell’amminoacido e
successivamente viene idrolizzata in α-chetoacido e PLP legato solo all’NH3.
3) un α-chetoacido (secondo substrato) reagisce con il complesso E-PLP-NH3,
formando un’altra base di Schiff
4) si produce un amminoacido (secondo prodotto) e si rigenera il complesso
E-PLP
PLP-E aa-NH3
PLP-NH3
*
E
PLP-NH3-aa
*
E
2°chetoacido
PLP-NH3… + chetoacido
*
E
aa-NH3 + PLP*
E
25
a)
generica reazione di
transamminazione
b) transamminazione
glutammato-ossalacetato
(GOT)
Meccanismo cinetico a ping-pong
26
Transamminasi in medicina
27
TRANSAMINASI
Aspartato amminotransferasi ( AST o GOT )
α-chetoglutarato + aspartato
glutammato + ossalacetato
Alanina amminotransferasi ( ALT o GPT )
α-chetoglutarato + alanina
glutammato + piruvato
28
29
AST o GOT:
-
1.
2.
3.
4.
-
alta concentrazione nel miocardio, nel fegato e nel cervello
aumenta nel siero in seguito a necrosi cellulare (infarto del
miocardio)dopo 8-12h (liv. max dopo 24-48h; val. norm. dopo 4-7 giorni)
La determinazione serve a 4 scopi:
distinguere l’infarto del miocardio da una crisi di angina pectoris
diagnosticare un infarto nei casi di elettrocardiogramma dubbo
stabilire l’estensione dell’infarto del miocardio
seguire il decorso della malattia
aumento elevato di AST (100 volte sup. ai valori normali):
epatite acuta
avvelenamenti
ALT o GPT:
-localizzata nel fegato, rene, miocardio, muscoli scheletrici, pancreas,
milza
-nell’epatite virale il suo aumento è sovrapponibile a quello della AST
30
α-chetoglutarato
amminoacido
NH3+
I
R-CH-COO-
O
II
R-C-COO-
α-chetoacido
O
II
-OOC-CH -CH -C-COO2
2
+
+
+
NH3
I
-OOC-CH -CH -CH-COO2
2
glutammato
Con la reazione di transaminazione il gruppo amminico è stato solo trasferito.
Il suo definitivo distacco avviene con la reazione di deamminazione.
31
NAD(P)H
+
NAD(P)+
NH3
+ H+
NH2
II
-OOC-CH -CH -C-COO2
2
I
-OOC-CH -CH -CH-COO2
2
glutammato
α- imminoglutarato
Deamminazione ossidativa catalizzata
dall’enzima glutammato deidrogenasi
1) Questa reazione avviene all’interno dei
mitocondri
2) Quasi tutta l’ammoniaca che si forma
nell’organismo viene prodotta in questa
reazione
3) L’enzima è regolato allostericamente:
+ ADP GDP
- ATP GTP
H2O
NH4+
O
II
-OOC-CH
2-CH2-C-COO
α-chetoglutarato
(che entra nel ciclo di Krebs)
32
3 forme dello stesso
scheletro carbonioso
reazione importante:
1. per la sintesi dell’urea
2.per l’α-chetoglutarato
libero che si forma.
La glutamina rappresenta un sistema
tampone che contrasta l’innalzamento
della concentrazione di ammoniaca libera
reazione molto importante nel rene per
il controllo del pH: l’ammoniaca diffonde
attaverso le cellule del tubulo distale renale
e nel lume intrappola gli ioni H+ fomando 33
ione NH4 che è escreto con le urine.
TRANSDEAMINAZIONE
L’accoppiamento della transaminazione con la
deaminazione del glutammato costituisce il
processo della transdeaminazione
34
35
DECARBOSSILAZIONE
• Terza via del catabolismo degli amminoacidi che porta alla formazione
delle corrispondenti ammine
Le decarbossilasi sono enzimi piridossalfosfato-dipendenti
36
AMMINE BIOGENE
CO2
vasodilatatore, stimolante
dell’ attività gastrica
istamina
istidina
CO2
serotonina
5-idrossitriptofano
Potente vasocostrittore,
neurotrasmetitore
CO2
tirosina
tiramina
Agente ipertensivo
CO2
3,4-diidrossifenilalanina
dopamina
Intermedio della sintesi
dell’adrenalina
37
CO2
Acido glutammico
aspartato
CO2
Acido
-γγ-amminobutirrico
GABA
β-alanina
Composto
che svolge
importanti
funzioni a
livello
cerebrale
Costituente del CoA
La decarbossilazione della lisina e della ornitina porta alla
formazione delle diammine cadaverina e putrescina
38
Decarbossilazione (piridossalfosfato dipendente)
dell’acido glutammico:
39
I TESSUTI PERIFERICI TRASPORTANO AZOTO
AL FEGATO
40
Esistono tre processi di incorporazione dell’NH3:
1. Sintesi del glutammato
2. Sintesi della glutammina
3. Sintesi del carbamilfosfato
41
1. Sintesi del glutammato (amminazione riduttiva dell’α
α-chetoglutarato)
glutammato deidrogenasi
Questa reazione è un importante PUNTO DI INCONTRO tra il METABOLISMO
DELL’AZOTO E IL METABOLISMO ENERGETICO, essendo l’ α-chetoglutarato un
42
intermedio del ciclo dell’acido citrico.
2. Sintesi della glutammina
Il più importante donatore di N
nella biosintesi di purine, pirimidine
e amminoacidi
glutammina
sintetasi
(glutammato)
(glutammina)
43
(intermedio
fosforilato)
3. Sintesi del carbamilfosfato
ione bicarbonato
attivato
44
Destino metabolico
dell’ammoniaca
45
Il ciclo dell’urea
2 reazioni nel MT +
3 reazioni nel citosol
delle cellule epatiche
46
Sintesi del carbamilfosfato
47
Sintesi del carbamilfosfato
O
2 ATP + HCO3- + NH3+
H2N – C –OPO3 -- + 2 ADP + Pi
Carbamil fosfato sintetasi I (CPS I)
-enzima mitocondriale
-utilizza ammoniaca come donatote di azoto
-richiede N-acetil glutammato
CPS II
-sintesi pirimidine
-enzima citosolico
-utilizza glutammina
-non necessita di N-acetil glutammato
48
N-acetil-glutammato è l’attivatore allosterico della carbamilfosfato sintetasi mitocondriale che utilizza come fonte di
azoto l’NH+4.
L’ N-acetil-glutammato si forma dall’ acetil-CoA+ glutammato
reazione sulla quale l’ ARGININA esercita un controllo
positivo
49
Il carbamilfosfato reagisce con l’ornitina per formare
citrullina. La reazione è catalizzata dalla
ornitina carbamil trasferasi (OCT)
50
argininosuccinato deidrogenasi
In questa reazione viene introdotto il
secondo atomo di azoto che si ritroverà
nella molecola di urea
51
Meccanismo d’azione della arginosuccinato sintetasi
52
argininosuccinato liasi
53
ciclo di Krebs
arginasi
54
Quantità di urea eliminata con le urine:
10-25g/die
Concentrazione di urea nel sangue:
5-14mg/100ml
Concentrazione di ammoniaca nel sangue:
0.1mg/100ml
Encefalopatia da ammoniaca:
un’alta concentrazione di ammoniaca
stimola la sintesi di glutammato dall’αchetoglutarato: la concentrazione di
quest’ultimo nelle cellule del sistema
nervoso centrale può venir meno con
conseguente inibizione del ciclo di Krebs
e della produzione di ATP.
Disturbi del comportamento in soggetti
con ammoniemia elevata:
il glutammato (neurotrasmettitore
inibitorio) o il GABA (suo derivato)
55
agiscono sul SNC.
DA RICORDARE
NH4+
ione ammonio
ANIMALI AMMONIOTELICI
la maggior parte dei vertebrati acquatici
ANIMALI UREOTELICI
molti vertebrati terrestri
compreso l’uomo
Acido urico
ANIMALI URICOTELICI
uccelli e rettili
56
LEGGE DELL’ ARGINASI
“ L’ENZIMA ARGINASI E’ PRESENTE NEL FEGATO
DEGLI ORGANISMI A RICAMBIO UREOTELICO,
IVI COMPRESO L’UOMO, E’ SCARSAMENTE
PRESENTE O ASSENTE NEL FEGATO DEGLI
ORGANISMI A RICAMBIO URICOTELICO (uccelli
e rettili)”.
Prof. Clementi (1913)
Nel 1932: Premio Nobel a Krebs per il ciclo dell’urea
Nel 1998: Premio Nobel al prof Ignarro per la sintesi dell’ossido nitrico.
57
L’arginina è il precursore dell’ossido nitrico
È un importante messaggero di molti
processi di trasduzione del segnale si
lega e attiva la guanilato ciclasi
solubile
58
CH2 CH
O
O
CH2
O
Nitroglicerina
NO2 NO2 NO2
L’NO è un vasodilatatore prodotto dalle cellule endoteliali in risposta ad una
grande varietà di agenti
L’NO prodotto dai neuroni causa la dilatazione delle arteie cerebrali
NO prodotto dai leucociti si combina con il superossido per produrre il radicale
ossidrilico, fortemente reattivo, che uccide i batteri invasori.
59
60
FUMARATE
ASPARTATE
Alpha-keto-acid
Il ciclo dell’urea e quello dell’acido citrico e la
transamminazione dell’ossalacetato sono collegati tra
loro mediante il fumarato e l’ aspartato
61
Carenza degli enzimi del ciclo dell’urea
i neonati con un difetto in uno dei primi 4 enzimi del ciclo sembrano normali alla
nascita ma presto diventano letargici, ipotermici e manifestano problemi
respiratori. Segue edema cerebrale, coma e morte.
Una carenza di arginasi (ultimo enzima del ciclo) provoca sintomi meno gravi. I
soggetti interessati devono essere sottoposti a emodialisi cui si associa un
trattamento con sodio benzoato e fenillattato per via endovenosa; queste
sostanze si condensano con la glutamina formando composti solubili che
sequestrano l’ammoniaca in una forma atossica che può essere eliminata con le
urine.
62