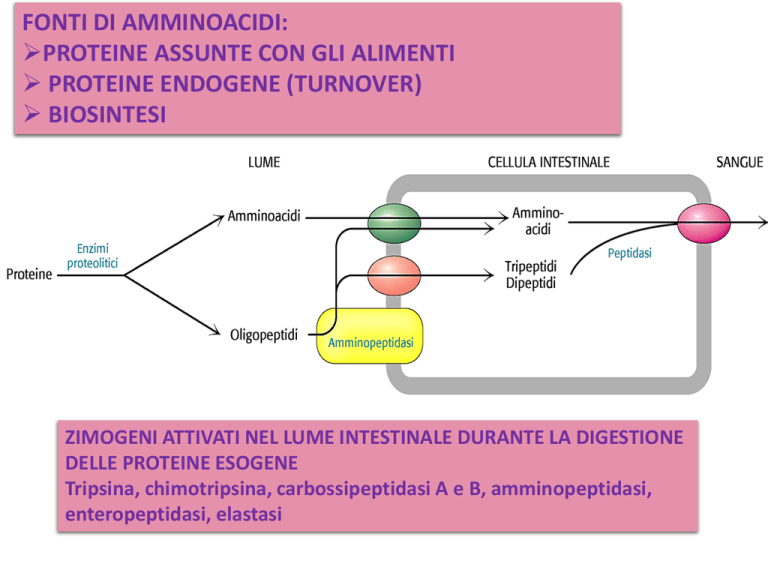
FONTI DI AMMINOACIDI:
PROTEINE ASSUNTE CON GLI ALIMENTI
PROTEINE ENDOGENE (TURNOVER)
BIOSINTESI
ZIMOGENI ATTIVATI NEL LUME INTESTINALE DURANTE LA DIGESTIONE
DELLE PROTEINE ESOGENE
Tripsina, chimotripsina, carbossipeptidasi A e B, amminopeptidasi,
enteropeptidasi, elastasi
Carbossi-peptidasi B
(agisce su AA basici) AA basici
Chimotripsina
Carbossipeptidasi A
(agisce su AA
neutri)
PEPTIDASI
Elastasi
AA neutri
Amminopeptidasi (rimuove gi AA Nterminali uno alla volta)
NH3+
Le proteine sono continuamente
sintetizzate e degradate in tutte le
cellule (TURNOVER)
Il ricambio delle proteine cellulari assicura
rapide risposte alle variazioni delle condizioni
ambientali e consente di recuperare e
mettere in circolo amminoacidi liberi, i gruppi
amminici e gli scheletri carboniosi degli
amminoacidi
Anche le proteine che hanno assunto
una conformazione tridimensionale
difettosa, con un ripiegamento
scorretto sono indirizzate rapidamente
verso la degradazione
Berg et al., BIOCHIMICA 6/E, Zanichelli editore S.p.A.
Copyright © 2007
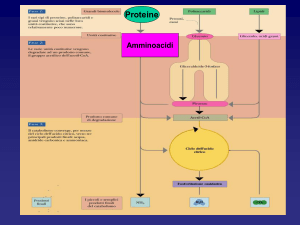
Nel metabolismo degli amminoacidi sono fondamentali le
reazioni di TRANSAMMINAZIONE
Consiste di 2 semireazioni:
1) α-chetoacido convertito nel corrispondente α-amminoacido
2) α-amminoacido convertito nel corrispondente α-chetoacido
Scambio del gruppo –NH3+
Reazioni catalizzate dalle ammino-transferasi (o transamminasi)
Coenzima che funge da scambiatore: PLP (piridossalfosfato)
TRANSAMMINAZIONI
PIU’ COMUNI:
piruvato ↔ alanina
ossalacetato ↔ aspartato
α-chetoglutarato↔ glutammato
:NH3
il gruppo ammidico della
catena laterale dell’Asn
proviene dalla Glutammina
Enz
ˡ
Lys
l
NH
.. 2
α
La piridossamina-fosfato
trasferirà il gruppo
amminico su un secondo
α-chetoacido che
diventerà un αamminoacido
α-chetoacido
..
+H
H-N—Lys-Enz
H
+
Gli aminoacidi sono precursori metabolici
Substrati per la sintesi delle proteine.
Vengono attivati mediante l’attacco al tRNA e vanno a costituire una
riserva di amminoacil-tRNA a disposizione dell’apparato per la
sintesi proteica.
Precursori di purine e pirimidine, porfirine, coenzimi, fosfolipidi
Precursori di ammine e molecole segnale con funzione regolativa
Precursori di molecole carburante
Aminoacidi come precursori di ammine con funzione regolativa
Dalla decarbossilazione di alcuni amminoacidi si ottengono importanti ammine biologiche
Decarbossilazione dell’ISTIDINA
CO2
ISTIDINA DECARBOSSILASI
(PLP-dipendente)
Mediatore dell’infiammazione e delle
reazioni allergiche
Decarbossilazione del TRIPTOFANO
CO2
Idrossilazione in C-5
Monoossigenasi
PLP
SEROTONINA
(neurotrasmettitore)
Metabolismo della FENILALANINA
COO
COO -
-
H- H3
+
Idrossilazione in C-4
Monoossigenasi
H- H3
+
HO
TIROSINA
Idrossilazione in C-3
Monoossigenasi
Vari altri derivati
MELANINE
DOPA
CO2
ADRENALINA
transmetilazione
NORADRENALINA
Decarbossilasi-PLP
Idrossilazione
sul C-β
(Ascorbatodipendente)
DOPAMINA
Aminoacidi come precursori di molecole carburante
Gli aminoacidi negli animali possono subire degradazione ossidativa in 3 condizioni:
1) con il turnover delle proteine cellulari
2) con una dieta ricca di proteine
3) durante il digiuno o nel diabete mellito
Gli amminoacidi che possono essere utilizzati per sintetizzare GLUCOSIO sono detti
GLUCOGENICI
Quelli che sono utilizzati per sintetizzare acetil-CoA e corpi chetonici sono detti
CHETOGENICI
*
chetogenici
*(glucogenici)
*
*
*
*
RUOLO CENTRALE DEL FEGATO E DELLE
TRANSAMMINASI EPATICHE NEL
METABOLISMO DEGLI AMMINOACIDI
Proteine
cellulari
Transamminazione
Transamminazione
Deamminazione
ossidativa
Proteine cellulari
Tessuti extraepatici
TRANSAMMINASIONE
Disponibili per
il metabolismo
ossidativo.
Glutammato
NH3, ATP
Pi
Trasformato in
glutammina
Nei mammiferi, quando è
necessario eliminare l’azoto
in eccesso dall’organismo,
viene prodotta glutammina
a partire dal glutammato.
La Glutammina trasporta
azoto nel sangue dai tessuti
extraepatici al fegato.
La glutammina raggiunge il fegato, all’interno dei mitocondri la
GLUTAMMINASI elimina azoto dalla catena laterale della glutammina
sottoforma di NH4+.
Una reazione simile coinvolge l’asparagina mediante l’ASPARAGINASI
Glutammina
Glutamminasi
(mitocondrioepatociti)
Escrezione dell’azoto
in eccesso
Glutammato
DEVE RILASCIARE IL GRUPPO ALFA-AMMINICO.
Va incontro ad una DEAMMINAZIONE OSSIDATIVA.
La GLUTAMMATO DEIDROGENASI catalizza la Deamminazione
ossidativa del glutammato in α-chetoglutarato e ammoniaca.
..
H2N
Glutammato
Glutammato
Intermedio imminico
H2O
α-chetoglutarato
NH4+
α-chetoglutarato
Urea
Ciclo di KREBS
Ciclo alanina/glucosio: coinvolge fegato e muscolo
Avviene quando viene meno la disponibilità di glicogeno, e di glucosio per le cellule
muscolari. I miociti degradano le proprie proteine liberando amminoacidi ramificati
che mettono a disposizione gruppi amminici e scheletri carboniosi.
gluconeogenesi
Deamminazione
ossidativa
α-chetoglutarato
Ciclo dell’urea
glicolisi
transamminazione
Proteine muscolari
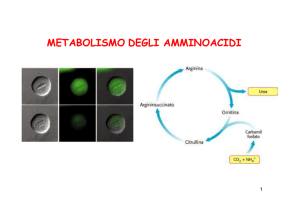
IL CICLO DELL’UREA
IL CICLO DELL’UREA (o
dell’ORNITINA)
avviene negli
EPATOCITI , in parte
dentro il mitocondrio,
in parte nel citosol
+ 2ATP
1) Nel mitocondrio il bicarbonato reagisce con l’ATP in una reazione catalizzata
dalla CARBAMMILFOSFATO SINTETASI 1
Si forma
carbossifosfato
2) L’ammoniaca rimpiazza il
gruppo fosfato e si forma
carbammato
Sono consumate due
molecole di ATP
3) Il carbammato viene
fosforilato per formare
CARBAMMILFOSFATO
Nel mitocondrio il carbammilfosfato reagisce con l’ornitina per formare
citrullina in presenza di ORNITINA TRANSCARBAMMILASI
+
+
+
La citrullina esce dal mitocondrio e nel
citosol si combina con 1 ATP per
formare l’intermedio citrullil-AMP. La
reazione è catalizzata dall’
ARGININOSUCCINATO SINTETASI
Ossalacetato + glutammato
Aspartato amminotransferasi
aspartato + α-chetoglutarato
La citrullina condensa
con l’aspartato a dare
argininosuccinato
D. Voet, J.G. Voet, C.W. Pratt, FONDAMENTI DI BIOCHIMICA 2/E,
Zanichelli Editore S.p.A. Copyright © 2007
L’ARGINATO SUCCINATO LIASI scinde l’argininosuccinato e
libera arginina e fumarato
Arginina
Fumarato
Si riforma ornitina che rientra
nel mitocondrio dove può
ricominciare un successivo ciclo
Un atomo di azoto dell’urea proviene
dall’ammoniaca incorporata nel
carbammilfosfato, l’altro atomo di
azoto proviene dall’aspartato. L’atomo
di carbonio proviene dal bicarbonato.
L’ARGINASI scinde per idrolisi il
gruppo guanidio dell’arginina
rilasciando UREA
Arginina
Il fumarato prodotto nel citosol può essere convertito in malato
dalla FUMARASI CITOSOLICA
Il malato può essere convertito in ossalacetato
dalla MALATO DEIDROGENASI CITOSOLICA
Nel citosol
GLUCONEOGENESI
Ciclo dell’UREA
Fuoriesce dal
mitocondrio.
Può rientrare direttamente nel
mitocondrio dove verrà indirizzato al
ciclo di KREBS: è ossidato a ossalacetato
ASPARTATO
Transamminazione
Si crea un ciclo associato al ciclo dell’urea, in cui dal fumarato ottenuto attraverso il
ciclo dell’urea si rigenera l’aspartato che serve per produrre argininosuccinato