Seconda Università degli Studi di Napoli
DiSTABiF
Corso di Laurea in Scienze Biologiche
Insegnamento di
CHIMICA BIOLOGICA
Prof. Antimo Di Maro
Anno Accademico 2014-15
Lezione 16 bis
Degradazione delle
proteine, amminoacidi e
Ciclo dell’Urea
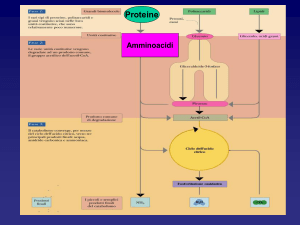
Meccanismo della digestione di proteine
Le proteine ingerite con la dieta vengono degradate ad amminoacidi
liberi nel tratto gastrointestinale. Tutto inizia nello stomaco dove la gastrina
stimola la produzione di HCl e pepsinogeno. A pH bassi (1,0) il pepsinogeno
viene attivato a pepsina che inizia a digerire le proteine (idrolisi dei legami
N-terminali con residui di Trp, Phe, Tyr, Leu). Dallo stomaco all’intestino, si
ha l’aumento di pH grazie al bicarbonato prodotto dal pancreas. Un
meccanismo ormonale infine porta all’immissione dal pancreas di
chimotripsinogeno, tripsinogeno e procarbossipeptidasi A e B. Essi si
trasformano in tripsina (attivata dalla enteropeptidasi), chimotripsina e
carbossipeptidasi ed idrolizzano i peptidi ad amminoacidi. Intervengono
anche l’elastasi (ottenuta dalla proelastasi) e l’amminopeptidasi.
Gli amminoacidi così ottenuti vengono assorbiti
ed arrivano al fegato.
Catabolismo degli amminoacidi
Catabolismo degli amminoacidi
– Eliminazione del gruppo carbossilico:
produzione di ammine biogene. Istamina (H), putresceina (Orn),
cadaverina (K), ciò succede con enzimi «amminoacidi
decarbossilasi» sono molecole importanti in alcune vie di
trasmissione dei segnali (sistema nervoso) ma si possono
formare anche con la degradazione batterica (odore
nauseabondo ….)
-
Metabolismo del gruppo amminico
-
Metabolismo della catena carboniosa
Anche gli amminoacidi possono
entrare nei cicli metabolici per
dare energia, dando scheletri
carboniosi (-chetoacidi) che
vendono degradati.
Il problema è eliminare
l’ammonio (NH4+), tossico ad
alte concentrazione nelle
cellule.
La degradazione delle proteine produce
amminoacidi, che entrano nel catabolismo (divisi in
classi).
Enzimi coinvolti nel metabolismo del gruppo amminico
1-Transamminasi
Transamminasi
L- amminoacido (1) + -chetoacido (2)
-chetoacido (1) + amminoacido (2)
- La specificità delle transamminasi è duplice: per l’ -chetoacido (più elevata)
e per l’amminoacido
Es. Glutammico-piruvato transamminasi (GPT)
L-alanina + -chetoglutarato
Piruvato + glutammato
Glutammico-ossalacetato transamminasi (GOT)
L-aspartato +
-chetoglutarato
Ossalacetato + glutammato
Meccanismo catalitico delle transamminasi.
Normalmente il PLP è legato all’enzima con un residuo di Lys.
Reazioni con meccanismo a ping pong due differenti
substrati che entrano ed escono dal sito attivo
Forma
piridossalica
(gruppo aldeidico)
Forma
piridossamminica
(gruppo amminico)
Meccanismo di reazione delle transaminasi
Transamminazione
L’eliminazione dello ione ammonio proveniente
dalla degradazione delle proteine (esogene ed
endogene) avviene nel fegato. Generalmente
l’accettore di ioni ammonio è il glutammato che è
l’accettore finale di gruppi amminici provenienti
da altri amminoacidi tramite le transamminasi.
Dai tessuti al fegato vi sono dei «trasportatori»
differenti dal glutammato.
L’ammonio viene eliminato
come..
2- Glutammato deidrogenasi (mitocondrio)
NADP+
NADPH + H+
Qui si ottiene lo ione Ammonio da
eliminare (nei mitocondri)
Enzima mitocondriale
Glutammato deidrogenasi
Il glutammato è indispensabile
per la sua funzione
intracellulare, quindi per il
trasporto extracellulare
dell’ammoniaca viene utilizzata
la glutammina. Essa
trasporta l’ammoniaca nel
torrente circolatorio.
L-Glutammato + ATP -->
-glutatammil-fosfato + ADP ->
-glutatammil-fosfato + NH4+ ->
L-glutammina.
Infine, la glutammina nel fegato
libera lo ione ammonio.
Glutamminasi
Oppure dai muscoli l’alanina
Dai muscoli generalmente il
trasportatore è l’alanina, quando
vengono degradate le proteine per
avere energia.
Così la gluconogenesi avviene nel
fegato, il muscolo non consuma
energia
(dal piruvato si ottiene il PEP e così
via…)
- Transamminazione con
ossalacetato
- Glutammato deidrogenasi
Ciclo dell’Urea
o dell’ornitina
-Inizia nel mitocondrio
1
- prosegue nel citosol
2
3
I
Trasporto di
Asp nel
citosol
Il fumarato entra nei
mitocondri
Sintesi Carbamil fosfato nel
mitocondrio
2ATP + HCO3- -----> Carbamil fosfato
Carbamil fosfato Sintasi
Ciclo dell’Urea
(Sintetasi)
(Succinasi)
Sintesi dell’Argininosuccinnato
ATP + Citrullina -----> Citrullin-AMP
------>Argininosuccinnato + PP
Sintesi degli amminoacidi
La sintesi degli amminoacidi prevede la presenza di
ione ammonio (NH4+) e l’utilizzo di scheletri
carboniosi provenienti o dalla glicolisi o da
intermedi del ciclo di Krebs. In generale si arriva
alla produzione di -chetoacidi che poi
successivamente per transamminazione danno L-amminoacidi
Catabolismo ed anabolismo come avevamo già visto…..
Le famiglie di amminoacidi sulla base
delle vie biosintetiche
Biosintesi della Serina per esempio
Errori congeniti del metabolismo
ALBINISMO: Phe
Tyr ≠
Melanine
FENILCHETONURIA: dovuta a un difetto nel gene
che codifica per la fenilalanina-idrossilasi, l’enzima che
converte l’aminoacido essenziale fenilalanina in tirosina.
URINE A SCIROPPO D’ACERO: Leu, Ile, Val
Patologia provocata da un difetto della decarbossilazione ossidativa
degli aminoacidi a catena ramificata.
Il nome è data da un caratteristico odore delle urine
Amminoacidi essenziali
Ciclo dell’azoto
Alcuni aspetti della reazione nitrogenasica, non
funzionante in presenza di O2.
Enzima: nitrogenasi
La reazione prevede un grosso dispendio di
energia ed elettroni:
N2 + 8e- + 16ATP + 10H+ --> 2NH4+ + 16ADP + 16Pi + H2
Enzima: nitrogenasi
Lo ione ammonio viene organicato entrando nei
sistemi biologici come glutammato e glutammina
Glutammico deidrogenasi
Glutammina sintetasi
Sintesi purine e pirimidine
A
Precursori a basso
peso molecolare dell’anello
pirimidinico
4
5
6
2 e 3 dal carbamilfosfato
3
2
1
1, 4, 5, 6 da Asp
Carbamil-P sintetasi
II citosolica
(biosintesi delle pirimidine)
…..Il ribosio dalla via dei pentoso fosfati
B
Precursori a basso
peso molecolare dell’anello
Purinico
I deossinucleotidi si formano dai nucleotidi
tramite l’enzima “ribonucleotide reduttasi“
I nucleotidi trifosfati vengono defosforilati a
NDP e poi il ribosio ridotto a deossi