Farmacologia
Antidolorifici_1
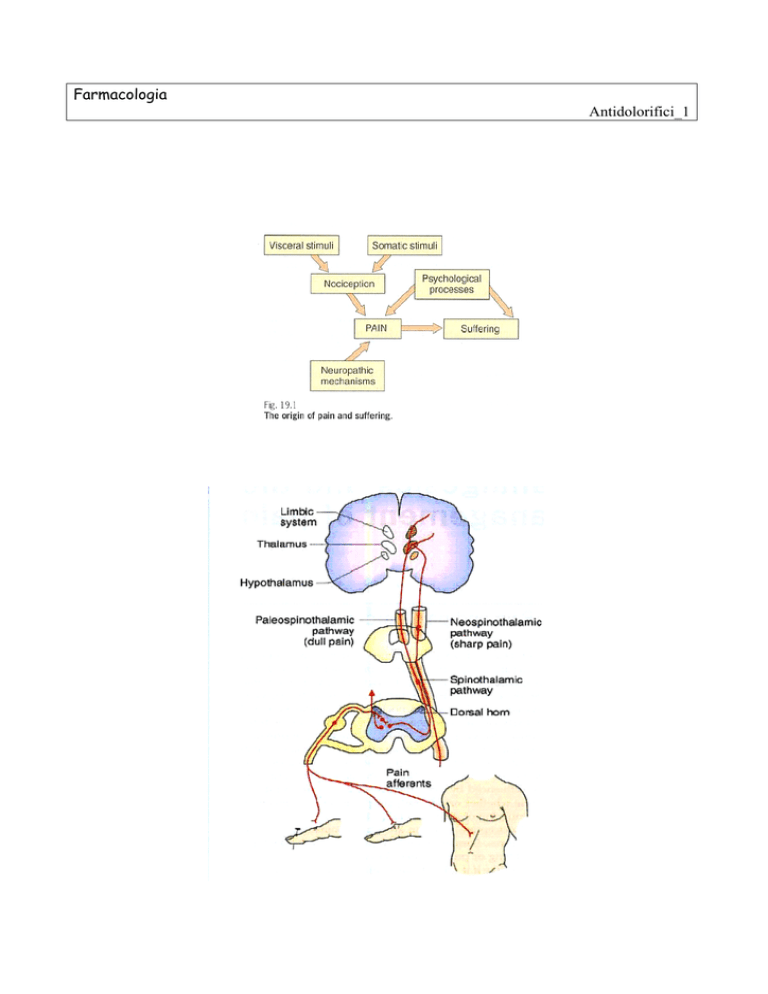
Dolore
•L’informazione nocicettiva nasce in periferia in seguito a diversi stimoli ed è convogliata al
midollo spinale (corno posteriore) da fibre afferenti amieliniche di tipo C a conduzione lenta
(dolore sordo, non localizzato) e da piccole fibre mieliniche (A, tipo delta, dolore acuto).
•Le fibre afferenti entrano nel ms attraverso le radici dorsali e terminano nelle corna posteriori
(sostanza grigia).
•Dal midollo spinale, l’informazione nocicettiva arriva ai centri corticali (talamo) ad opera di
neuroni di trasmissione.
•Il dolore vero e proprio è la presa di coscienza delle informazioni nocicettive trasmesse dal talamo
ed integrate a livello corticale e limbico. Le strutture coinvolte sono la corteccia (anteriore
cingolata, somatico-sensoriale, prefrontale), l’ipotalamo, il talamo, la sostanza grigia
periacqueduttale, il cervelletto ed i gangli della base.
s
Eventi che portano alla attivazione e sensibilizzazione dei terminali nocicettivi afferenti
•A. Attivazione diretta dovuta ad una pressione intensa e conseguente al danno cellulare. Il danno
cellulare induce una riduzione del pH e determina un aumento del K+ nello spazio pericellulare.
Aumenta inoltre la sintesi di prostanoidi (prostacicline e prostaglandine, PGs) e bradichinine (BK).
Le PGs sensibilizzano le terminazioni dolorose.
• B. Attivazione secondaria. Gli impulsi generati nei terminali si propagano non soltanto nel midollo
spinale, ma anche con riflessi assonici locali ad altre branche degli stessi terminali, determinando il
rilascio di sostanza P (SP). La SP causa vasodilatazione e edema neurogenico. La SP causa anche
rilascio di istamina e serotonina rispettivamente da mastociti e piastrine.
Anestetici locali
•Bloccano o riducono la generazione e la propagazione del potenziale d'azione lungo la membrana
eccitabile neuronale. Ciò si ottiene per stabilizzazione del canale del sodio in una conformazione
chiusa; il blocco selettivo dei canali del sodio è voltaggio-dipendente ed è tanto più efficace quanto
più elevata è la frequenza di stimolazione della fibra nervosa (blocco uso-dipendente).
Struttura del canale del sodio
•Come in tutti i canali voltaggio-dipendenti, si può identificare una struttura voltaggio-sensibile e
una struttura operante la inattivazione del canale
Anestetici locali
•Il blocco si ottiene sia sulle fibre sensitive che su quelle motorie, ma le fibre amieliniche (sensitive
dolorifiche) sono le più sensibili (seguono quelle del freddo, caldo, tattili, pressorie ed infine
motorie).
Anestetici locali
•Il blocco della generazione e della conduzione del potenziale d’azione si ottiene per
stabilizzazione del canale del sodio in una conformazione chiusa; il blocco selettivo dei canali del
sodio è voltaggio-dipendente ed è tanto più efficace quanto più elevata è la frequenza di
stimolazione della fibra nervosa (blocco uso-dipendente).
Local anaesthetics reduce firing frequency in small dorsal root ganglia neurones
•. (A) Trains of tetrodotoxin (TTX)-resistant action potentials elicited by a 750 ms 400 pA current
stimulus are reduced in firing frequency by increasing concentrations of lidocaine. (B) Similar
effects as in (A) seen with bupivacaine in another neurone. Extracellular solution in bath
containing TTX 200 nM; high KI in pipette; 22–23°C.
Anestetici locali
•Esteri: Cocaina, procaina, benzocaina;
•Amidici: Lidocaina, bupivacaina
Anestetici locali
•Gli esteri sono metabolizzati da esterasi plasmatiche (psuedocolinoesterasi),
•le amidi a livello epatico.
•Il metabolismo (e quindi la scomparsa dell’effetto anestetico) e la tossicità sono influenzate dalla
rapidità con la quale l’anestetico raggiunge il circolo sistemico.
Anestetici locali
•In associazione con
-agonisti (adrenalina, fenilefrina)
Effetti collaterali:
•Centrali: brividi, tremori, fino a convulsioni e spasmi della glottide;
•Periferici: (cuore) effetto inotropo negativo, riduzione della velocità di conduzione con blocco
atrio-ventricolare;
•Periferici: (circolazione) ipotensione e collasso cardiocircolatorio.
Controllo della sensibilità dolorosa“Gate control”
•Per la complessa rete neuronale esistente nel midollo spinale, la stimolazione ripetuta delle
terminazioni dolorifiche “apre” il cancello (autofacilitazione) ed aumenta l’attivazione delle vie
ascendenti spinotalamiche. Stimoli sensoriali non nocicettivi e informazioni discendenti “chiudono”
il cancello e diminuiscono la sensibilità dolorosa.
Ò
Controllo inibitorio della sensibilità dolorosa
•Midollo spinale (interneuroni inibitori la cui attivazione
inibisce la trasmissione dalle fibre
afferenti ai neuroni di trasmissione).
•Sistema inibitore discendente (meccanismo di feed-back negativo attivato a livello corticale)
Vie inibitorie discendenti per il controllo della sensibilità dolorifica
•I neuroni della zona periacqueduttale (PAG) ricevono impulsi di controllo dalla corteccia
cerebrale, dal talamo e dall’ipotalamo. Dal PAG, alcune terminazioni nervose proiettano nel
midollo spinale, nel nucleo del rafe magno (NRF) e nel nucleo reticolare magnocellulare (NRMC).
Da qui, vie discendenti di controllo entrano nel midollo spinale (sostanza gelatinosa) e modulano
l’attività dei neuroni nocicettivi, inibenboli.
Farmaci per la terapia del dolore
Analgesici Non Oppioidi
•Farmaci Antinfiammatori Non Steroidei
Analgesici Oppioidi
•Agonisti forti (morfina, meperidina, metadone, fentanil e derivati)
• Agonisti deboli (codeina, destropropossifene, tramadolo)
• Agonisti / antagonisti (buprenorfina)
• Agonisti parziali (pentazocina)
Farmaci Adiuvanti
•Antidepressivi triciclici
• Antiepilettici
• Farmaci serotoninergici (SSRI, trazodone)
• Farmaci noradrenergici (clonidina, terazosina)
• Miorilassanti
• Corticosteroidi
• Anestetici locali
• Altri (capsaicina, somatostatina)
•Ansiolitici
Analgesici periferici antiinfiammatori
•Antiinfiammatori non steroidei (FANS), compreso il paracetamolo che non ha effetto come
antinfiammatorio, ma esercita una azione antidolorifica centrale.
Analgesici “centrali” oppioidi
•Antidolorifici potenti, i farmaci del malato di cancro, ma anche farmaci da usare in una serie di
situazioni non così drammatiche e finali come il dolore del malato terminale
Uso
Uso dei
dei farmaci
farmaci analgesici
analgesici
(WHO
ladder”)
(WHO ““ladder”)
Libertà
Libertà dal dolore
Oppioidi forti
+/+/- Non oppioidi +/+/- Adiuvanti
Dolore
Dolore persistente
persistente o aumentato
Oppioidi deboli
+/+/- Non oppioidi +/+/- Adiuvanti
Dolore persistente o aumentato
Analgesici non oppioidi
+/+/- Adiuvanti
Consumo
-91)
(1986
Consumo di
di morfina
morfina per
per milione
milione di
di abitanti
abitanti (1986(1986-91)
Zenz et al, 1993
Figura 1 - Consumo dei farmaci oppiacei in
Europa (% sul totale spesa farmaceutica)
Fonte: Ministero Salute, Repubblica italiana (anni 2000-2002)
Tabella IV - I principi attivi
maggiormente consumati
(DDD/1000 ab die)*
•
•
•
•
•
•
•
•
PRINCIPIO ATTIVO
Codeina
Diidrocodeina
Fentanyl
Morfina
Metadone
Buprenorfina
Totale
2000
0,544
0,299
0,017
0,110
0,053
0,028
1,052
2001
0,556
0,259
0,096
0,120
0,057
0,023
1,11
2002
0,586
0,258
0,158
0,111
0,074
0,020
1,206
Fonte: Ministero Salute, Repubblica italiana (anni
2000-2002)
http://www.ministerosalute.it/dettaglio/pdHomeArea.jsp?lang=italiano&id=525&area=medicinaliterapiaDolore
Terapia del dolore
•L’Italia, secondo recenti analisi sul consumo dei farmaci oppiacei, è risultata un paese che ancora
non risponde ai reali bisogni dei pazienti affetti da dolore severo in corso di patologie neoplastiche
o degenerative negando loro il giusto sollievo in particolare nella fase terminale. Norme legislative
molto restrittive hanno reso difficile in passato l’accesso a tali farmaci ed hanno anche ridotto la
possibilità da parte degli operatori sanitari di sviluppare ulteriori conoscenze sulla terapia. Sulla
base di queste premesse il Ministero della salute ha recentemente adottato nuove iniziative per
promuovere la terapia del dolore e per facilitare la prescrizione e l’impiego dei farmaci analgesici
oppiacei, in particolare attraverso le semplificazioni apportate dalla Legge 8 febbraio 2001 n.12 e
dal successivo D.M. 4 aprile 2003 .
Opioid prescription in Italy: new law, no effect
•Sir—It is estimated that millions of patients with cancer worldwide experience moderate to severe
cancer pain. Unrelieved cancer pain continues to be a major public-health concern, despite
available treatment. The use of opioids is the cornerstone of cancer-pain management. Misguided
national health policies, non-availability of drugs, and inadequate education of physicians and the
public are the main barriers to the prescription of opioids. The trend of increasing medical use of
opioids to treat pain does not seem to be contributing to increases in the health consequences of
opioid analgesic abuse.
•Mercadante S., Pain Relief and Palliative Care Unit, La Maddalena Cancer Center, Via S Lorenzo
312, 90146, Palermo, Italy, (Correspondence, The Lancet, 360, 1254-1255 , 2002)
Opioid prescription in Italy: new law, no
effect
• Table 1. Opioid use in mg per person in general
population sold before and after change in opioid
prescription law
Mercadante S., The Lancet, 360, 1254-1255 , 2002
Opioids in Italy: is marketing more
powerful than the law?
Chinellato et al., The Lancet, 362, 78, 2003
Analgesici oppioidi
•Morfina e derivati dell'oppio
•Molecole di sintesi morfino-mimetiche: levorfano, pentazocina, buprenorfina
•Succedanei della morfina: petidina, metadone
Oppio,
Oppio, oppiacei
oppiacei ed
ed oppiodi
oppiodi
Leu-encefalina
Leu-encefalina
Papaver somniferum
Morfina
Morfina
Recettori
Recettori per
per gli
gli oppiodi
oppiodi
K+
NH2
II
G α G βγ
GDP
cAMP
COOH
GTP
Adenilato
Adenilato ciclasi
ciclasi
Proteina Gi
Ca2+
Effetti degli oppioidi
•Siti e meccanismi di azione
•Inibizione diretta del sistema nocicettivo ascendente (k, µ)
•Attivazione del sistema di controllo del dolore discendente (k, µ)
•Inibizione della trasmissione algica a livello talamico (µ)
•Inibizione periferica della liberazione di mediatori infiammatori dalle cellule immunitarie (µ)
Meccanismo di azione
•La morfina mima gli effetti delle endorfine (oppioidi endogeni). L'effetto analgesico si ottiene per
modulazione della neurotrasmissione dei messaggi nocicettivi a livello
•a) spinale (midollo) per attivazione degli interneuroni inibitori.
•b) sopraspinale (bulbo, ponte, mesencefalo) per facilitazione delle vie discendenti inibitorie.
•A questi effetti post- (diminuzione del firing neuronale) e pre-sinaptici (per diminuita produzione o
liberazione di altri neurotrasmettitori) si aggiungono effetti sulla componente emozionale (sistema
limbico) ed il dolore è meno intenso e più sopportabile.
Effetti clinici degli oppioidi
•Analgesia
•Effetto di sollievo sia sul dolore acuto che su quello cronico, con notevole attenuazione o
scomparsa completa e sensazione di sollievo psichico. Efficacia minore sul dolore neuropatico.
Affinità farmaci per i recettori
oppioidi
Farmaco
µ
Morfina
+++
Metadone
+++
Fentanil
+++
Sufentanil
+++
Meperidina
++
Codeina
+
Tramadolo
+Buprenorfina +++AP
Pentazocina -
Recettore
δ
+
κ
++
+
+
+
+
+
-AP
+
Oppioidi
•La morfina è il punto di riferimento di ogni farmaco analgesico. Possiede tutti gli effetti tipici dei
farmaci oppioidi: analgesia, depressione respiratoria, nausea, vomito, modulazione endocrina,
antitosse, rallentamento del transito intestinale, effetti sul sistema immunitario. La durata di azione
della morfina è di circa 4 ore; sono anche disponibili formulazioni a lento rilascio che ne portano la
durata di azione a 8 ore.
Oppioidi
•La codeina, è circa dieci volte meno potente della morfina, ma ne condivide tutti gli effetti.
Rispetto alla morfina, la codeina ha il vantaggio di essere bene assorbita per via orale.
•Il tramadolo (derivato della codeina) è un debole agonista del recettore oppiaceo µ, ma ha anche la
capacità di bloccare la ricaptazione di serotonina e noradrenalina come i classici antidepressivi
triciclici. L’effetto analgesico del tramadolo è comparabile a quello della codeina, ma
accompagnato da effetti riconducibili a quelli degli antidepressivi triciclici, con il potenziamento
delle vie serotoninergica e noradrenergica. Questo particolare meccanismo di azione potrebbe
essere alla base di alcune sue caratteristiche, come la minore tendenza alla depressione respiratoria,
la stimolazione del sistema immunitario e la scarsa tendenza alla tolleranza.
•La buprenorfina ha una potenza analgesica simile a quella della morfina ed è bene assorbita per via
orale. Induce fenomeni allucinatori e vomito che impediscono di utilizzare appieno le sue qualità
analgesiche.
•La meperidina (o petidina) è un oppioide sintetico che non induce la contrazione dello sfintere di
Oddi.
•Il fentanyl (derivato della meperidina) è un farmaco dotato di una notevole potenza analgesica, ma
una breve durata di azione (circa 20 minuti). Può essere usato in formulazioni transdermiche a lento
rilascio.
•Il remifentanil ha una durata di azione di circa un minuto ed è usato in infusione negli interventi
chirurgici. Alla sospensione dell’infusione post-operatorio, non si osserva depressione respiratoria.
La rapidità di azione del remifentanil è dovuta al fatto che è metabolizzato dalle esterasi ematiche.
•Il metadone ha una durata di azione di 8 ore circa ed ha una ottima biodisponibilità orale. Il
metadone è 6/7 volte più potente della morfina. Il metadone si lega alle proteine plasmatiche, e la
quota legata alle proteine plasmatiche si comporta come una riserva, una specie di deposito a lento
rilascio. Attualmente, il metadone sta trovando un impiego sempre più comune nella terapia del
dolore cronico anche a domicilio e nel dolore post-operatorio.
•Il destropropossifene è un analgesico molto più debole del metadone, di potenza paragonabile a
quella della codeina, caratterizzato però dalla stessa lunga durata di azione del metadone; è
generalmente usato in associazione ai FANS.
Effetti collaterali degli oppioidi
•Miosi (segno prognostico della intossicazione acuta grave da oppioidi);
•Nausea, vomito;
•Costipazione con aumento del tono muscolare del duodeno, della porzione antrale e dello sfintere
pilorico dello sfintere anale;
•Spasmo dello sfintere di Oddi (controndicazione nel trattamento dello coliche biliari);
•Iperglicemia con un abbassamento del metabolismo basale per riduzione della temperatura
corporea;
•Vasodilatazione periferica per liberazione diretta di istamina, diminuzione del precarico, effetto
inotropo e cronotropo negativo;
•Depressione respiratoria per inibizione diretta dei centri respiratori bulboponti e depressione dei
chemiorecettori;
La morte per sovradosaggio è dovuta all’effetto inibitorio sui centro respiratorio e quindi alla
depressione respiratoria!!!
Tolleranza e farmacodipendenza da oppioidi
•Per tolleranza si intende una diminuzione degli effetti farmacologici (analgesia, effetto
euforizzante, ma anche effetti collaterali, in particolare depressione respiratoria). La tolleranza è
crociata (cioè è estesa a tutti i farmaci analgesici-narcotici di tipo oppiaceo) e si ottiene dopo duetre settimane alle normali dosi terapeutiche (per la morfina HCl o H2SO4 10-20 mg i.m.)
•Il meccanismo non è metabolico (diminuito assorbimento, aumentata degradazione o eliminazione
del farmaco) ma si ipotizza dovuta a up-regolazione di sistemi di trasduzione intracellulari (cAMP)
che antagonizzano gli effetti della attivazione dei recettori oppioidi.
•Per dipendenza (fisica) si intende lo stato di ipereccitabilità che si sviluppa nelle cellule del snc in
conseguenza della somministrazione di una sostanza. La dipendenza psichica è invece quello stato
di ansia o depressione che nel paziente si ha all'idea di "interrompere" l'uso di una sostanza.
•Nel caso della morfina e degli altri analgesici-narcotici la dipendenza è fisica oltre che psichica e
l'interruzione del farmaco provoca una vera e propria crisi di astinenza, spiegabile con le
modificazione tipiche della tolleranza.
Cannabinoidi
•Analoghi della anandamide
•Derivati cannabinioidi inducono nell’uomo sensazione di benessere, aumento dell’appetito,
bradicardia, vasodilatazione, bronco-dilatazione e controlla la nausea indotta dai chemioterapici
antineoplastici.
•Utilizzati nelle sindromi spastiche e nella sclerosi multipla.
•Gli antagonisti inducono iperalgesia e la presenza dei recettori nei tessuti tende a dimostrare che
gli endocannabinoidi potrebbero contribuire al controllo della sensibilità dolorosa.
Cannabis
Cannabis ee cannabinoidi
cannabinoidi
Anandamide
Cannabis sativa
∆9-THC
Recettori
Recettori per
per ii cannabinoidi
cannabinoidi
K+
NH2
II
G α G βγ
GDP
cAMP
COOH
GTP
Adenilato
Adenilato ciclasi
ciclasi
Na+
Proteina Gi
Effetti antidolorifici dei cannabinoidi
Effetto antinocicettivo
centrale.
Innalzamento della soglia
dolorifica sia a livello
centrale (potenziamento
del GABA e inibizione del
glutammato) che a livello
spinale (promuovono il
rilascio di oppiodi nel
sistema discendente di
controllo del dolore).
Efficaci sul dolore
neuropatico.
Effetto antinocicettivo
periferico di tipo
antinfiammatorio, mediato
dall'inibizione del rilascio
di sostanze algogene
proinfiammatorie da parte
delle cellule del sistema
immunitario.
Antidepressivi triciclici
Inducono una modulazione del dolore probabilmente perché interferiscono con la ricaptazione di
serotonina e di noradrenalina, due sistemi trasmettitoriali importante per la modulazione inibitoria
del dolore.
•Gli antidepressivi triciclici sono usati nel dolore di origine neuropatica. Possono anche essere
utilizzati per potenziare l’effetto analgesico della morfina, ma questo impiego va attentamente
valutato alla luce dei loro effetti collaterali che vengono ad aggiungersi a quelli dell’oppiaceo.
Potranno ad esempio essere associati quando nel dolore da cancro si riconosca una componente
neuropatica per compressione o lesione di tessuto nervoso.
Anticonvulsivanti
•Diversi anticonvulsivanti sono attivi nella modulazione del dolore. La carbamazepina è attiva nel
dolore neuropatico e soprattutto nel dolore trigeminale.
Bloccanti degli Amminoacidi eccitatori
•Ketamina: Questo farmaco, utilizzato soprattutto in anestesia, è tuttavia noto per i suoi effetti
disforici che ne limitano l’impiego a casi molto particolari ed in ambito specialistico ha anche
effetti antinocicettivi.
WHO
•If pain occurs, there should be prompt oral administration of drugs in the following order:
nonopioids (aspirin and paracetamol); then, as necessary, mild opioids (codeine); then strong
opioids such as morphine, until the patient is free of pain. To calm fears and anxiety, additional
drugs – “adjuvants” – should be used. To maintain freedom from pain, drugs should be given “by
the clock”, that is every 3-6 hours, rather than “on demand”. This three-step approach of
administering the right drug in the right dose at the right time is inexpensive and 80-90%
effective. Surgical intervention on appropriate nerves may provide further pain relief if drugs are
not wholly effective. (Last update: May 3, 2002)












