Idrocarburi
Stereoisomeria
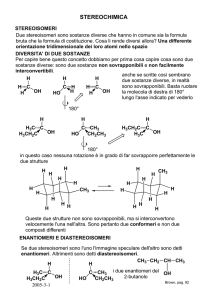
Stereisomeri configurazionali
• Il fatto che gli atomi di carbonio degli
alcani siano tutti ibridati sp3 rende
possibile la formazione anche di altri
stereoisomeri (isomeri con stessa
sequenza e diversa disposizione
tridimensionale degli atomi) che però non
sono interconvertibili l’uno rispetto all’altro
per semplice rotazione di legami sigma.
• Essi sono detti stereoisomeri
configurazionali
Atomi di carbonio chirali
• Negli idrocarburi può spesso capitare che
ad un atomo di carbonio siano legati gruppi
diversi.
CH3 CH2
CH3 CH2 CH2 C
3-metilesano
CH3
H
• Se i 4 gruppi attaccati ad un atomo di
carbonio sono tutti diversi l’atomo in
questione si dice chirale
Stereochemistry.dir
Esempio
• Per esaminare meglio un tale fenomeno
prendiamo un esame una molecola più
semplice come quella di etano in cui due
degli atomi di idrogeno di uno degli atomi
di carbonio sia stato sostituito con un
atomo di cloro ed uno di bromo.
Stereochemistry.dir
Esempio
• In una molecola di questo tipo all’atomo di
carbonio sostituito sono legati 4 gruppi diversi
(bromo, cloro, idrogeno, metile).
• A causa della struttura tetraedica di tale atomo i
gruppi potranno essere legati in due modi diversi
in modo da originare due strutture speculari tra di
loro che vengono detti enantiomeri e che sono
appunto stereoisomeri configurazionali.
ISOMERI
Diversa sequenza degli atomi
Diversa disposizione tridimensionale degli atomi
STRUTTURALI
GEOMETRICI
(Stereoisomeri)
CH3
CH3
CH2
CH2
n-butano
CH3
CH3
Interconvertibili soltanto per rottura
e riformazione di legami semplici
Interconvertibili per
rotazione intorno a
legami semplici
CONFIGURAZIONALI
CONFORMAZIONALI
C CH3
H
iso-butano
Immagini speculari
Eclissata e sfalsata dell’etano
ENANTIOMERI
CHO
H
CHO
C
Composti
con un atomo di C
CH
HOH2C
H
OH
2
carbonio chirale
OH
OH
D-(+)gliceraldeide
L-(-)gliceraldeide
Enantiomeria
• Gli stereisomeri configurazionali che siano uno
l’immagine speculare dell’altro sono detti
enantiomeri.
enantiomeri
• L’atomo di carbonio che genera un tale tipo di
stereoisomeria viene detto centro chirale.
chirale
• La stragrande maggioranza delle molecole del
mondo biologico mostra questo tipo di isomeria
che è fondamentale per il decorso delle reazioni
biologiche e che non è esclusiva delle molecole che
presentano un centro chirale.
Acido Lattico
L'acido lattico (nome IUPAC: acido 2-idrossipropanoico) è un composto
chimico che svolge un ruolo rilevante in diversi processi biochimici.
La molecola dell'acido lattico è chirale, ne esistono pertanto due enantiomeri.
L'enantiomero che compare nei cicli metabolici dei sistemi viventi è l'acido
S-(+)-lattico o acido L-(+)-lattico (a destra).
2-butanolo
2-butanolo
Chiralità
• Esempi di strutture chirali si possono
trovare anche nel quotidiano
Piano di simmetria
• Per determinare se una struttura sia o no
chirale e possa quindi dare origine ad
enantiomeri bisogna verificare che essa
non presenti piani di simmetria
• Il piano si simmetria è un piano immaginario
che divide l’oggetto in due metà, che sono
l’una l’immagine speculare dell’altra
Piani di simmetria
2-propanolo
Formule di Proiezione di
Fischer
• Per descrivere su un piano le molecole
chirali si possono usare le formule
prospettiche, o le formule di Fischer; meno
usate sono le proiezioni di Newman e le
CH CH
proiezioni a cavalletto.
3
2
CH3 CH2 CH2 C
3-metilesano
H3C
CH2
H2
C
C H
H3C
C
H2 CH3
Et
Pr
C
H
Prospettiche
Fisher
CH3
H
Et
Me
CH3
CH3
C
Pr
Me
Newman
Pr
H
H
Cavalletto
H
Formule di Proiezione di
Fischer
Ruoto intorno al legame C-CH3
la molecola in modo da
spostare
dietro l'H e avanti il Cl
CH3
C
Br
Cl
H
CH3
Br
C Cl
H
CH3
Br
C Cl
H
Ottengo la proiezione di Fisher
nella quale i legami orizzontali
escono dal piano e quelli verticali
entrano nel piano
Guardo la molecola dal punto
opposto del sostituente che
entra nel piano
Ottengo la proiezione
di Newman nella quale
il sostituente che si
trova dietro non si
vede
Stereochemistry.dir
Nomenclatura
• Il sistema di nomenclatura che è stato
messo a punto per identificare le diverse
configurazioni è il sistema R-S o di CahnIngold-Prelog (CIP) che permette di
definire ogni centro chirale come (R) o (S)
Regole R e S
1.Identificazione dello stereocentro
e dei quattro sostituenti diversi
2.Assegnazione della PRIORITA' ad
ogni sostituente (a, b, c, d)
L’atomo di carbonio chirale viene
anche detto centro stereogenico
o stereocentro
Assegnazione della priorità
• Si considera il numero atomico dell'atomo
direttamente legato allo stereocentro: più
alto è il numero atomico, più alta è la
priorità assegnata
Assegnazione della priorità
• A parità di numero atomico del primo
atomo dei sostituenti legati allo
stereocentro, si considerano quelli
immediatamente successivi, fino alla prima
differenza
Assegnazione della priorità
• Se ci sono sostituenti con legami multipli,
si considerano come se ci fossero più
legami singoli col medesimo atomo
Esempio
Regole R e S
1.Identificazione dello stereocentro
e dei quattro sostituenti diversi
2.Assegnazione della PRIORITA' ad
ogni sostituente (a, b, c, d)
3.Osservazione dello stereocentro
in modo che il sostituente con
più bassa priorità (d) sia opposto
all'osservatore
4.Identificazione del senso di
rotazione (si disegna una freccia
immaginaria) secondo cui si
succedono i sostituenti in ordine
di priorità decrescente (a)-(b)-(c)
Senso orario => R
Senso antiorario => S
Regole R e S
Esempio
Enantiomeri
• Gli enantiomeri hanno proprietà chimico fisiche
identiche (in ambienti achirali), ovvero:
–
–
–
–
–
Analisi elementare
Punto di fusione ed ebollizione
Indice di rifrazione
Solubilità (in solventi achirali)
Reattività con reagenti achirali
• L’unica proprietà fisica che li differenzia è il loro
effetto sul piano della luce polarizzata
• Tale proprietà li fa anche denominare isomeri
ottici
Luce Polarizzata
Stereochemistry.dir
Potere rotatorio
• I due enantiomeri di un composto chirale
ruotano il piano della luce polarizzata di un
angolo caratteristico per tale specie in
senso opposto l’uno rispetto all’altro.
• Tale angolo viene detto potere rotatorio
specifico
COOH
H
CH2OH
OH
COOH
CH2OH
HO
H
R-(-)-acido lattico
S-(+)-acido lattico
[α]D = - 3.8
[α]D = + 3.8
Polarimetro
Potere rotatorio
• L’enantiomero che ruota verso destra il piano della
luce polarizzata si dice destrogiro (+),
(+) quello che
ruota verso sinistra levogiro (-).
• La direzione della rotazione non ha nulla a che
vedere con la configurazione assoluta (R o S) e
deve essere determinata sperimentalmente.
• La miscela dei due enantiomeri in parti uguali non
ruota il piano della luce polarizzata e viene detta
COOH
COOH
miscela racemica.
racemica
H
CH2OH
OH
CH2OH
HO
H
R-(-)-acido lattico
S-(+)-acido lattico
[α]D = - 3.8
[α]D = + 3.8
Composti con più centri chirali
• Le molecole possono contenere più centri chirali
(stereocentri).
• Se una molecola ha N stereocentri possiamo avere 2N
stereoisomeri.
• Gli stereoisomeri che non sono enantiomeri (non sono
speculari) si definiscono diastereoisomeri.
2,3,4-triidrossibutanale
(a) e (b), (c) e (d) sono enantiomeri tra loro
(a) e (c), (b) e (d) sono tra loro diastereoisomeri
Composti con più centri chirali
• Se i gruppi legati ai due stereocentri sono uguali la
molecola presenta un piano di simmetria e quindi
due degli enantiomeri sono tra loro uguali e si
definiscono composto meso
Acido tartarico
(a) e (b), sono enantiomeri tra loro (c) e (d) sono lo stesso composto (meso)
(a) e (c), (b) e (c) sono tra loro diastereoisomeri
ISOMERI
Diversa sequenza degli atomi
Diversa disposizione tridimensionale degli atomi
STRUTTURALI
GEOMETRICI
(Stereoisomeri)
CH3
CH3
CH2
CH2
CH3
CH3
C CH3
H
n-butano
Interconvertibili per
rotazione intorno a
legami semplici
Interconvertibili soltanto per rottura
e riformazione di legami semplici
iso-butano
CONFIGURAZIONALI
Non immagini speculari
CONFORMAZIONALI
Immagini speculari
Eclissata e sfalsata dell’etano
DIASTEREOISOMERI
CO2H
H
C
OH
HO
C
H
CO2H
HO
C
H
H
C
OH
Composti con più di un
CO2H
2H
atomo
di carbonioCOchirale
Acido (+)-tartarico
Acido (-)-tartarico
ENANTIOMERI
Composti con un atomo di
carbonio chirale
CO2H
H
HO
C
C
OH
OH
3
H
C
H
3
H
Acido (-)-tartarico
CO2H
OH
3
2
C
H
H
R
C
H
Acido S,S-tartarico
1
OH
3
2
C
OH
H
S
CO2H
H
C
OH
1
OH
OH
CO2H
H
C
C
OH
CO2H
Acido meso-tartarico
Acido R,S-tartarico
3
2
HO2C
C
CHOHCO2H
OH
CO2H
C
CHOHCO2H
H
S
H
CO2H
H
C
HO2C
CO2H
1
C
HO
H
R
CO2H
3
2
HO2C
CO2H
2
C
OH
CO2H
OH
HO2CCHOH
OH
C
1
OH
HO2CCHOH
CO2H
Acido R,R-tartarico
CO2H
HO
C
1
H
C
H
R
Acido (+)-tartarico
C
HO
2
HO2CCHOH
CO2H
H
CO2H
1
H
S
CHOHCO2H
Acido Tartarico
Significato della chiralità
nel mondo biologico
• Quasi tutte le molecole organiche sono
chirali.
• Sebbene queste molecole possano esistere
sotto forma di diversi stereoisomeri, quasi
invariabilmente in natura si trova un solo
stereoisomero.
• Naturalmente, vi sono casi in cui più
stereoisomeri esistono in natura, ma
raramente essi si trovano insieme nello
stesso sistema biologico.
Significato della chiralità
nel mondo biologico
• Il limonene è una molecola chirale, pertanto si può
presentare nelle forme enantiomere destrogira e
levogira e nella forma racema detta anche
dipentenica.
• L'enantiomero R è un liquido che odora di arancia
mentre l'enantiomero S odora di limone.
• L’enantiomero più presente
in natura e di maggior
interesse in campo
industriale e merceologico
è il D-limonene, ovvero il
(4R)-(+)-4-isoprenil-1metilcicloesene.
(+)
(-)
Chiralità nelle biomolecole
• Forse il caso più evidente di chiralità tra i
composti di interesse biologico, è quello degli
enzimi, molecole che possiedono tutte un
elevato numero di stereocentri.
• Un esempio è rappresentato dalla
chimotripsina, un enzima presente
nell'intestino di animali, che
catalizza la digestione di
proteine che ha 251 stereocentri.
Riconoscimento degli enzimi
• Un enzima catalizza la reazione di una molecola in ambiente
biologico posizionandola prima in un sito di legame sulla sua
superficie.
• Un enzima con siti di legame specifici per tre dei quattro
gruppi su uno stereocentro può discriminare tra una
molecola e il suo enantiomero o uno dei suoi
diastereoisomeri.
Nomeclatura D e L
• In biochimica è in uso un tipo di nomenclatura che
è basata sulla struttura della (+)gliceraldeide.
• A questo composto venne data del tutto
arbitrariamente la struttura spaziale sotto
riportata e poiché tale composto ruota il piano
della luce polarizzata in senso orario venne
identificato con la lettera D (D-gliceraldeide).
• L'altro enantiomero fu denominato Lgliceraldeide.
H
CHO
CHO
C
C
CH2OH
OH
D-(+)gliceraldeide
HOH2C
H
OH
L-(-)gliceraldeide
Nomeclatura D e L
• Basandosi su questo composto venne data la
denominazione D a tutte quelle strutture che
potevano in qualche modo essere correlate alla Dgliceraldeide e la denominazione L a quelle
correlabili alla L-gliceraldeide.
• Ad esempio al (-)acido lattico e al (+)lattato di
metile si diedero le denominazioni seguenti:
•
CO2CH3
CO2H
CHO
C
H
CH2OH
OH
D-(+)gliceraldeide
C
C
H
CH2OH
OH
acido D-(-)lattico
H
CH2OH
OH
D-(+)lattato di metile
Esempio
CHO
CO2H
CO2CH3
C
C
C
CH2OH
OH
D-(+)gliceraldeide
H
H
CH2OH
OH
acido D-(-)lattico
H
CH2OH
OH
D-(+)lattato di metile
• Si noti che in queste denominazioni i simboli D ed
L si riferiscono esclusivamente alla configurazione
e non hanno alcuna relazione con il potere
rotatorio.
• Infatti mentre la D-gliceraldeide ruota in senso
orario il piano della luce polarizzata l'acido
D-lattico fa esattamente il contrario, mentre il
D-lattato di metile fa lo stesso.