Università degli Studi di Enna “Kore”
Facoltà di Ingegneria, Architettura e delle Scienze Motorie
Corso di Laurea triennale in “Scienze delle Attività Motorie e Sportive”
Corso di Biochimica, AA 2012-2013
Appunti dalle lezioni di Biochimica tenute dal
5-11-2012 al 27-11-2012.
Lezione del 5-11-12 (2h-diapositive 1-9_file: lezione 1)
Presentazione del corso.
Lezione del 6-11-12 (3h-diapositive 9-20_file: lezione 1)
Concetti:
1) La cellula come reattore chimico (degradazione dei substrati energetici con produzione di
energia e prodotti di scarto che sono molecole più stabili rispetto ai precursori ovvero meno
reattivi).
2) Definizione di sistema (insieme di oggetti caratterizzati da specifiche proprietà chimico
(specie chimiche, concentrazioni, numero di atomi o molecole)-fisiche (T, P, V, m) e da un
certo livello energetico.
3) Equivalenza energia=calore=lavoro; la quantità di energia utilizzabile per produrre lavoro è
inferiore rispetto all'energia totale del sistema. Dispersione sotto forma di calore.
4) Le proprietà fisiche di un sistema vengono indicate mediante simboli (vedi punto 2).
5) Definizione di materia (riferimento alla natura discontinua della materia data da Democrito
nel 500 A.C., concetti di pieno e vuoto).
6) La materia è costituita da atomi (riferimenti all'evoluzione della teoria atomistica).
7) L'atomo è costituito da particelle sub-atomiche: protoni, neutroni, elettroni.
8) Protoni e neutroni contribuiscono in modo preponderante alla massa dell'atomo. La massa
dell'elettrone e circa 4 ordini di grandezza (potenze del 10) inferiore rispetto alla massa delle
altre particelle subatomiche.
9) Cenni alla notazione scientifica e ad alcune proprietà delle potenze.
10) Definizione di carica elettrica come grandezza capace di perturbare lo spazio circostante.
11) Riferimento alla legge di Coulomb (F proporzionale a q1*q2/r2). La forza sarà attrattiva
nel caso le cariche abbiano segno opposto, repulsiva in caso le cariche abbiano stesso
segno.
12) Protoni carichi positivamente (+), elettroni carichi negativamente (-).
13) Neutroni non caratterizzati da carica definizione di neutralità (carica netta = 0)
14) Anche le molecole e non solo gli atomi possono essere cariche o neutre.
15) Ogni elemento è caratterizzato da uno specifico numero di protoni, neutroni ed elettroni:
definizione di numero atomico e numero di massa.
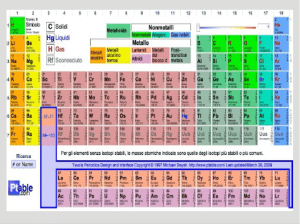
16) Introduzione al sistema periodico (accenno alle proprietà periodiche degli elementi e al
fatto che la disposizione nel sistema periodico delle specie chimiche non è casuale ma
dipende dal numero di elettroni contenuti nell'atomo della specie chimica considerata).
17) Richiami alla meccanica newtoniana (chi è Newton? Concetto di moto rettilineo
uniforme (v = cost; velocità costante) e moto accelerato (v ≠ cost). Una forza (F) può agire
su un corpo determinandone il moto.
18) Modello atomico: dall'atomo di Bohr (modello planetario, orbite elettroniche definite) al
modello atomico attuale (definizione di radiazione elettromagnetica: lunghezza d'onda e
frequenza; natura corpuscolare della luce Einstein; fotoni, E=h, h= costante di Planck,
=frequenza della radiazione elettromagnetica; particelle a massa piccolissima sono
caratterizzate anche da una lunghezza d'onda De Broglie, dualismo onda particella;
principio di indeterminazione di Heisemberg trattazione del moto dell'elettrone
probabilistica, non più descrivibile mediante la meccanica classica).
19) Definizione di orbitale atomico. L'orbitale è descritto da una funzione di x, y, z (funzione
d'onda Ψ(x, y, z)) che soddisfa specifici requisiti e corrisponde a uno specifico livello
energetico dell'elettrone descritto dallo specifico orbitale.
20) Definizione di funzione. Variabili indipendenti (x) e dipendenti (y). Sistemi cartesiani
bidimensionali e tridimensionali. Esempio: funzione corrispondente ad una retta
(y=b0+b1x).
21) Cenni ai numeri quantici principale (n) e secondario (l).
22) L'energia dell'elettrone dipende dal numero quantico principale. N.B.: l'energia associata
all'orbitale è quella dell'elettrone che lo occupa.
23) Diagramma dell'energia e livelli energetici per n crescente (E=f(n); rappresentazione in un
diagramma cartesiano bidimensionale).
24) Es.: l'orbitale 1s ha un diametro minore rispetto al 2s: l'elettrone descritto da un orbitale 2s è
più distante dal nucleo e risente meno della sua forza attrattiva rispetto ad un elettrone
descritto da un orbitale 1s. L'elettrone 2s sarà più svincolato dal nucleo e avrà un'energia
maggiore.
25) Maggiore energia ==> maggiore reattività.
26) Stato fondamentale per H (1s1). Definizione di stato eccitato: conferendo energia al
sistema “atomo d'idrogeno” l'unico elettrone può acquisire energia ed essere descritto da
orbitali corrispondenti ad energia maggiore (eccitazione). Preludio al concetto di livelli
energetici discreti o quantizzati.
Glossario:
Substrato: molecola che viene modificata in uno specifico processo chimico (in biochimica un
substrato è una molecola che viene modificata da un enzima)
Antitetico: che è in antitesi SIN contrario, opposto.
Depauperare: Rendere povero, impoverire.
Precursore: in biochimica un precursore è una sostanza da cui vengono prodotte altre sostanze
attraverso il metabolismo
Sistema: In fisica: il termine sistema indica la porzione dell'universo oggetto dell'indagine.
scientifica. In chimica: il termine sistema indica una porzione limitata di materia, distinta
dall'intorno, che può interagire con esso attraverso trasferimenti di materia e di energia e può essere
aperto, chiuso o isolato. Il suo stato viene definito dai valori di un certo numero di variabili
chimico-fisiche.
Grandezze chimiche: proprietà che dipendono solo dalla composizione chimica della materia e che
vengono evidenziate durante una reazione-trasformazione chimica o anche capacità di una sostanza
di interagire con altre sostanze (Esempi: reattività, idrofilia, idrofobia, solubilità, tendenza alla
dissociazione). Una trasformazione chimica comporta l'alterazione della composizione chimica del
sistema.
Grandezze fisiche: Una grandezza fisica è una proprietà misurabile del sistema. Le grandezze
fisiche fondamentali sono 7: lunghezza (l), massa (m), tempo (t), corrente elettrica (i), temperatura
(T), quantità di sostanza (n9, intensità luminosa (). Forza (F), pressione (P) energia (E) sono
grandezze fisiche derivate. Esse possono essere determinate senza alterare la composizione chimica
del sistema (Esempi: temperatura di fusione, temperatura di ebollizione, densità). Una
trasformazione fisica non altera la composizione chimica del sistema. I passaggi di stato sono
trasformazioni fisiche.
Energia: capacità di un sistema di compiere lavoro.
Materia: tutto ciò che occupa uno spazio ed è caratterizzato dalla proprietà fisica massa.
Discontinuo: disuguale nelle sue parti.
Eterogeneo: composto di elementi diversi.
Sub-atomico: che ha dimensioni inferiori rispetto a quelle dell'atomo; particelle subatomiche:
costituenti dell'atomo.
Notazione scientifica: modo conciso di esprimere i numeri reali utilizzando le potenze intere di
dieci ed è usata per numeri molto grandi o molto piccoli. (Es.: 25204=2,5204*10^5;
0,00000897=8,97*10^(-6); 0,003*10^(-3)=3*10^(-6). RICORDARE LE PROPRIETA' DELLE
POTENZE.)
Carica elettrica: grandezza fisica dotata di segno e proprietà fondamentale della materia. La carica
elettrica è responsabile delle interazioni elettromagnetiche ed è all'origine del campo
elettromagnetico stesso.
Perturbazione: modificazione di una o più grandezze caratterizzanti un sistema.
Proporzionalità diretta: due grandezze sono direttamente proporzionali se al loro variare il
rapporto rimane costante (X/Y=k, k=costante definita di proporzionalità).
Proporzionalità inversa: due grandezze sono inversamente proporzionali quando il loro prodotto
rimane costante al loro variare (X*Y=k).
Neutralità di carica: mancanza di carica elettrica del sistema (carica nulla).
Moto : spostamento che avviene più o meno rapidamente nello spazio e nel tempo, seguendo una
certa traiettoria.
Moto rettilineo uniforme: un corpo si muove di moto rettilineo ed uniforme se mantiene una
velocità costante
Moto rettilineo uniformemente accelerato: un corpo si muove di moto uniformemente accelerato
se la sua velocità cambia in modo proporzionale al tempo.
Radiazione elettromagnetica: forma di energia che si propaga mediante onde o particelle in moto
Lunghezza d'onda (): in un'onda periodica è la distanza tra due massimi o due minimi della
sua forma d'onda, e viene comunemente indicata dalla lettera greca λ.
Frequenza (): è il numero di cicli della forma d'onda che si verifica nell’unità di tempo.
Fotone: definito anche “quanto di luce” è una quantità discreta di energia associata ad una
radiazione elettromagnetica. Ad una radiazione elettromagnetica di frequenza è associata un
energia pari a E=h*, h=costante di Planck=6.63*10-34 J s. Essendo =c/, c=velocità della luce nel
vuoto, =lunghezza d’onda della radiazione elettromagnetica (inversamente proporzionale alla
frequenza), l’energia di un fotone può essere espressa come E=(h*c)/.
Orbitale atomico: spazio attorno al nucleo atomico in cui la probabilità di trovare un elettrone è
massima.
Funzione: è la relazione (corrispondeza) che consente di associare ad ogni elemento dell'insieme A
(dominio) uno e un solo elemento dell’insieme B (codominio).
Variabile dipendente: la variabile dipendente (di solitto indicata con y) è una variabile che assume
valori in funzione della variabile indipendente (disolito indicata con x).
Variabile indipendente: è una variabile che assume valori arbitrari nel dominio in cui è definita
una specifica funzione.
Sistema di riferimento cartesiano ortogonale a due dimensioni (piano cartesiano): è un sistema
di riferimento formato da 2 rette ortogonali che si intersecano in un punto chiamato origine, su
ciascuna delle quali si fissa un orientamento (rette orientate) e per le quali si fissa anche una unità di
misura che consente di identificare qualsiasi punto del piano mediante numeri reali.
Reattività: si intende la tendenza di una particolare specie chimica a reagire e trasformarsi in
presenza di altre specie chimiche.
Stato fondamentale: in relazione ad un sistema atomico, in condizioni standard il moto degli
elettroni di un atomo è descritto dagli orbitali corrispondenti ai livelli energetici più bassi.
Stato eccitato: stato energetico corrispondente ad un orbitale che descrive il moto di elettroni
eccitati identificato da un numero quantico principale superiore a quello degli orbitali nello stato
fondamentale.
Lezione del 12-11-12 (2h-diapositive 20-26 file: lezione 1)
12) E=f(n) concetto di orbitali degeneri (stesso livello energetico).
13) I livelli energetici corrispondenti ad un certo valore di n vengono definiti da lettere (K per
n=1, L per n=2, M per n=3).
14) Definizione di guscio o strato di valenza per un elemento.
15) Configurazione elettroniche: regola dell'aufbau, principio di esclusione di Pauli, regola
di Hund (solo accennata; concetto di spin dell'elettrone; spin parallelo e antiparallelo).
16) Rappresentazione sintetica della configurazione elettronica degli elementi del secondo
periodo (C, N, O).
17) Idrogeno e atomi polielettronici: differenze dovute alle repulsioni tra elettroni occupanti lo
stesso orbitale; le forze repulsive destabilizzano il sistema; rimozione della degenerazione di
orbitali corrispondenti allo stesso numero quantico.
18) Lacune elettroniche e minore stabilità rispetto agli elementi che presentano lo strato di
valenza completo: regola dell'ottetto e introduzione al legame. Gli atomi possono
soddisfare l'ottetto condividendo con altre specie atomiche gli elettroni spaiati (ad es. C può
ricevere 4 elettroni completando l'ottetto; O può riceverne 2 completando l'ottetto.).
19) Definizione di valenza di un elemento in base alla configurazione elettronica dell'elemento
stesso.
20) Legame chimico: formazione della molecola d'idrogeno schematizzata in un diagramma
dell'energia (E=f(r), E= energia, r=distanza tra gli atomi).
21) Il legame chimico corrisponde ad un minimo di energia che si realizza quando gli atomi
sono tra loro a distanza adeguata (distanza di legame).
22) Aumentando la distanza tra gli atomi, l'energia del sistema molecola tende a zero (gli atomi
non possono interagire più tra loro ed il sistema molecolare non può esistere. Quindi la sua
energia sarà nulla).
23) Diminuendo la distanza tra gli atomi, l'energia del sistema tende a infinito (∞): prevalgono
le repulsioni tra i nuclei.
Glossario:
Orbitali degeneri: orbitali corrispondenti allo stesso livello energetico
Valenza: è il numero di legami che un atomo può fare con altri atomi, cedendo acquisendo o
condividendo elettroni.
Strato o guscio di valenza: è il livello energetico più esterno (maggiore energia) dove si trovano gli
elettroni di valenza ovvero quegli elettroni che possono generare legami con altri elementi.
Spin parallelo: Due elettroni hanno spin parallelo quando hanno il numero quantico di spin
concorde (entrambi +1/2 o entrambi -1/2). I due elettroni hanno entrambi moto di spin orario o
antiorario.
Spin antiparallelo: due elettroni hanno spin antiparallelo quando è il numero quantico di spin è
discorde (uno +1/2 e uno -1/2). I due elettroni hanno moto di spin opposto.
Atomi polielettronici: atomi cotituiti da più di un elettrone.
Lacune elettroniche: numero di elettroni necessari affinchè l’atomo arrivi ad avere la
configurazione elettronica corrispondente al completo riempimento dello strato di valenza. Insieme
all'elettrone, è uno dei due portatori di carica che contribuiscono al passaggio di corrente elettrica
nei conduttori e nei semiconduttori.
Ottetto: configurazione elettronica corrispondente al completo riempimento del massimo livello
energetico occupato (strato o guscio di valenza). Tale configurazione si traduce in elevata stabilità e
quindi ridotta reattività dell’atomo. La regola dell’otteto sottende la tendenza di elementi diversi a
formare uno specifico numero di legami
Minimo di una funzione: è il valore più piccolo che la funzione y=f(x) può assumere in funzione
di specifici valori di x appartenenti al dominio su cui è definita.
Massimo di una funzione: è il più grande dei valori che la funzione y=f(x) assume in funzione di
specifici valori di x appartenenti al dominio su cui è definita.
Dominio di una funzione: insieme su cui la funzione è definita.
Codominio di una funzione: insieme dei valori che la funzione può assumere.
Lezione del 13-11-12 (3h-diapositive 26-31 file: lezione 1)
12) Definizione di legame covalente puro: la molecola d’idrogeno (molecola biatomica
omonucleare). Il legame nasce dalla condivisione (messa in compartecipazione) di
elettroni spaiati dei due atomi che formano la molecola.
13) Il numero di legami che un atomo può formare corrisponde al numero di elettroni
spaiati nell’atomo stesso (H ha 1e- spaiato forma un legame; O ha 2e- spaiati
forma a2 legami). Un’eccezione è costituita dalla formazione di un legame dativo.
14) La formazione di un legame corrisponde sempre ad un minimo nel diagramma
dell’energia il sistema “molecola” è più stabile rispetto al sistema “atomi separati”.
La molecola è quindi meno reattiva rispetto agli atomi che la originano.
15) La rottura del legame implica che venga fornita energia al sistema in modo da alzare
l’energia della molecola e renderla più reattiva e propensa ad una trasformazione
energia di dissociazione.
16) I diagrammi energetici per descrivere la formazione di una molecola da due atomi
rappresentano l’andamento dell’energia del sistema (E) al variare della distanza
interatomica (r ). L’energia del sistema costituito da due atomi che interagiscono o meno
tra loro tende a zero per r che tende a ∞ (gli atomi a distanze elevate non interagiscono,
la molecola non può esistere e l’energia del sistema si annulla) e tende a +∞ per r che
tende a zero (repulsione tra i nuclei).
17) Definizione delle proprietà periodiche materia degli elementi:
a. Raggio atomico: metà della distanza internucleare tra due atomi dello stesso
elemento legati covalentemente. (unità di misura pm= 10-12 m o angstrom (10-10 m).
Aumenta nei gruppi dall’alto verso il basso (aumenta il numero quantico principale e
quindi l’energia degli elettroni di valenza). Diminuisce nei periodi andando da
sinistra a destra (aumento del numero di protoni: gli elettroni di valenza sono più
attratti effetto di contrazione)
b. Potenziale di prima ionizzazione: energia necessaria a estrarre un elettrone (e-) da
un atomo di un elemento (X + E X+ + e-, X+ = catione monovalente).
Diminuisce nei gruppi dall’alto verso il basso (aumento dell’energia degli elettroni di
valenza più svincolabili dal nucleo). Aumenta nell’ambito di un periodo da sinistra a
destra (aumento dei protoni maggiore attrazione del nucleo).
c. Affinità elettronica: energia prodotta dal processo mediante il quale un atomo
acquista un elettrone formando un anione monovalente (X + e- X- + E).
Diminuisce nell’ambito di un gruppo dall’alto verso il basso. Aumenta nell’ambito di
un periodo da sinistra a destra.
18) Definizione di differenza di elettronegatività: l’elettronegatività (χ) associata ad un
elemento è una grandezza misurabile sperimentalmente (diverse scale tra le quali quella
di Pauling è la più utilizzata).
19) Polarità di legame: legame covalente polarizzato e percentuale di carattere ionico del
legame in base a χ.
20) Momento di dipolo associato alla separazione di cariche parziale (richiamo al
concetto di vettore).
21) Legame ionico: Es.: formazione di Na+Cl-.
22) Il sodio Na tende a cedere l’unico elettrone 3s arrivando alla configurazione elettronica
di Ar, particolarmente stabile perché ha l’ottetto completo. Il cloro (Cl) tende ad
acquistare l’elettrone dal sodio raggiungendo la configurazione elettronica di Ar altro
gas nobile. Ione sodio (Na+) e ione cloruro (Cl-) saranno particolarmente stabili.
23) Completa separazione di cariche: interazione puramente elettrostatica (forza di
Coulomb).
Glossario:
Omonucleare: in riferimento ad una molecola indica che quest’ultima è costituita da atomi della
stessa specie chimica (es.: H2, N2, O2).
Eteronucleare: in riferimento ad una molecola indica che quest’ultima è costituita da atomi di
specie chimiche (elementi) diverse (es. HCl, CH4).
Legame dativo: particolare tipo di legame covalente nel quale la coppia elettronica di legame viene
fornita da un solo atomo tra quelli coinvolti nel legame. Tale atomo viene definito atomo donatore.
L’altro atomo viene definito atomo accettore e dovrà avere un orbitale vuoto nel quale accogliere
gli elettroni.
Polarità: è una proprietà di alcune molecole che presentano una parziale carica positiva (+) su una
parte della molecola ed una parziale carica negativa (-) su un'altra parte opposta alla molecola (es.
acqua). Esistono molecole che non presentano il fenomeno della polarità sono dette apolari o non
polari.
Catione: è uno ione carico positivamente, un atomo o molecola che possiede una o più cariche
positive in quanto ha ceduto uno o più elettroni.
Anione: è uno ione carico negativamente, un atomo o molecola che possiede una o più cariche
negative in quanto ha acquistato uno o più elettroni.
Monovalente: se riferito a specie ioniche indica ioni caratterizzati da una sola carica.
Divalente: se riferito a specie ioniche indica ioni caratterizzati da due cariche.
Energia di dissociazione: energia necessaria alla rottura di un legame chimico
Elettrostatico: relativo all’elettrostatica.
Elettrostatica: parte dell’elettrologia che studia i fenomeni dell’elettricità statica ovvero fenomeni
riconducibili all’effetto sullo spazio circostante di cariche in quiete (non in movimento).
Grandezze scalari: grandezze caratterizzate da un numero nell'unità di misura utilizzata
Grandezze vettoriali: grandezze definite da un’intensità o modulo che corrisponde al valore
numero espresso nell’unità di misura considerata, da una direzione e da un verso.
Lezione del 20-11-12 (3h-diapositive 32-37 file: lezione 1)
1) Definizione di numero di ossidazione: carica formale che l'elemento coinvolto in uno o più
legami con atomi diversi assume ipotizzando che gli elettroni di legame siano attratti dall'elemento
più elettronegativo.
2) Regole per il calcolo del numero di ossidazione: tranne che nel caso di rare eccezioni
all’idrogeno (H) viene attribuita carica formale +1, all’ossigeno (O) carica formale -2, al fluoro F
carica formale -1, ai metalli alcalini del primo gruppo carica formale +1, ai metalli alcalino terrosi
del secondo gruppo carica formale +2.
3) Calcolo del numero di ossidazione del carbonio in suoi composti: il numero di ossidazione del
carbonio può assumere tutti i valori compresi tra -4 (nel metano, CH4) e +4 (nell'anidride
carbonica, CO2).
4) Perché il numero di ossidazione di un elemento può variare in una trasformazione chimica?
Definizione di reazione di ossidazione e di riduzione (esempi: identificazione dell'atomo che
cambia numero d'ossidazione e calcolo di quest'ultimo in due processi: una riduzione dell'acido
alfa-cheto propanoico (piruvato) ad acido alfa-idrossi propanoico (lattato) ed un'ossidazione di
etanolo ad acido acetico)
5) Calcolo della polarità complessiva di una molecola: somma vettoriale dei momenti di dipolo
associati ai singoli legami polarizzati (Es. confronto tra H2O e CO2).
6) Polarità ed interazioni tra molecole: molecole a polarità simile possono interagire tra loro mentre
molecole a polarità antitetica non interagiscono tra loro ==> SIMILE SCIOGLIE SIMILE
(perché CO2 non è solubile in acqua mentre l'etanolo (C2H6O) lo è?).
7) Solubilità: definizione di soluzione (sistema omogeneo a due o più componenti. Un sistema
può essere definito binario se costituito da due componenti, ternario se costituito da 3 componenti
e via di seguito).
8) Definizione di solvente (componente presente in maggiore concentrazione nel sistema) e soluti
(componenti presenti in minore concentrazione rispetto al solvente).
9) Definizione di idrofilia e lipofilia.
10) Introduzione ai legami deboli: interazioni intermolecolari e forze di Van der Waals.
Glossario:
Ossidante: specie chimica (reagente) che in un processo ossido-riduttivo acquista elettroni.
Riducente: specie chimica (reagente) che in un processo ossido-riduttivo cede elettroni.
Ossidato: specie chimica (prodotto) generata dalla cessione di elettroni da parte di una specie
riducente.
Ridotto: specie chimica (prodotto) generata dall’acquisto di elettroni da parte di una specie
ossidante.
Ossidrile: è un gruppo funzionale costituito da un atomo Idrogeno legato ad un atomo di Ossigeno,
(formula –OH) legato ad altri atomi o insiemi di atomi.
Metile: è un gruppo funzionale costituito da un atomo di Carbonio legato a tre atomi di idrogeno (
formula -CH3) legato ad un altro atomo o molecola.
Ossidazione: è un processo chimico che comporta una perdita di elettroni da parte di un reagente
che si trasforma nella corrispettiva forma ossidata.
Riduzione: è un processo chimico complementare all’ossidazione che comporta un acquisto di
elettroni da parte di un reagente che si trasforma nella corrispettiva forma ridotta.
Sistema omogeneo: l’oggetto di studio che presenta le stesse proprietà, chimiche e fisiche, in ogni
punto.
Sistema eterogeneo: l’oggetto di studio che presenta caratteristiche fisiche e chimiche diverse da
punto a punto.
Concentrazione: la concentrazione di un componente in una miscela è una grandezza che esprime
la quantità del componente rispetto alla quantità totale di tutti i componenti nella miscela.
Idrofilia: proprietà fisica di materiali o di singole specie chimiche (ad esempio molecole) a
interagire o legarsi con l'acqua, formando ponti idrogeno, interazioni dipolo-dipolo o ione-dipolo.
Lipofilia: proprietà fisica di specie chimiche che possono interagire con molecole apolari.
Idrofobo: proprietà di una sostanza che presenta repellenza per l’acqua.
Intramolecolare: processo o caratteristica limitato all'interno della struttura di una
singola molecola.
Intermolecolare: processo che esercita la sua azione tra due o più molecole.
Lezione del 22-11-12 (2h-diapositive 37-41_file: lezione 1)
4) Forze di Van der Waals: interazioni intermolecolari caratterizzate da un’energia
di dissociazione inferiore rispetto a quella necessaria alla rottura di legami covalenti
puri o polari e di legami ionici legami deboli.
5) Tra le forze intercorrono tra molecole neutre, sono di natura puramente
elettrostatica e sono sostanzialmente di 3 tipi:
a) interazione tra due dipoli: coinvolge due molecole con ≠
b) interazione tra dipolo e dipolo indotto (coinvolge una molecola polare (≠ed
una molecola non apolare (=nella quale viene indotta una separazione parziale di
cariche conseguente all’avvicinamento della molecola polare. (Le molecole devono
essere visualizzate come corpi a volume definito. La parte interna del volume è
occupata dai nuclei degli atomi legati tra loro a formare la molecola mentre la parte
esterna sarà occupata dagli elettroni descritti dagli orbitali molecolari (nube
elettronica) e sarà, quindi, carica negativamente. L’avvicinamento del dipolo
associato alla molecola polare alla nube elettronica della molecola apolare indurrà la
repulsione degli elettroni di quest’ultima generando una parziale separazione di
cariche e quindi un momento di dipolo indotto. Lo stesso meccanismo è alla base del
terzo tipo di interazione debole classificata tra le forze di van der Waals e descritta in
seguito.
c) Interazione tra dipolo indotto istantaneo e dipolo indotto istantaneo (forze di
dispersione di London): interazione tra due molecole a momento di dipolo nullo.
3. Tra le interazioni deboli può essere annoverato il legame d’idrogeno, caso
particolare dell’interazione tra dipoli permanenti.
4. Requisito affinchè una molecola possa formare legami d’idrogeno è che contenga un
atomo d’idrogeno legato covalentemente ad un elemento più elettronegativo (N, O;
gruppo donatore di legame d’idrogeno) ed un atomo elettronegativo dotato di
doppietto elettronico non condiviso (gruppo accettore di legame d’idrogeno).
L’interazione è elettrostatica.
5. L’interazione di legame d’idrogeno può essere anche intramolecolare come nel caso
di macromolecole biologiche (es.: proteine)
6. La forza di un legame d’drogeno è variabile e dipende dalla natura ed
elettronegatività dell’atomo accettore e donatore ma l’energia di dissociazione è
maggiore rispetto a quella corrispondente alle forze di Van der Waals.
7. Ogni molecola d’acqua può formare 4 legami d’idrogeno. La presenza di legami
d’idrogeno rende ragione del fatto che l’acqua, nonstante il basso peso molecolare,
sia liquida a T ambiente e P atmosferica ed è responsabile dell’elevato punto di
ebollizione. Affinchè le molecole d’acqua passino in fase gas è necessario conferire
energia al sistema in modo da rompere le interazioni di legame d’idrogeno.
Ricordare che la formazione di un legame intra o intermolecolare è sempre associata
ad un minimo d’energia del sistema.
8. Gli idrocarburi, al contrario, non formano legami d’idrogeno.
9. L’acqua può fungere da solvente per molecole polari (≠0) interagendo con queste
ultime mediante formazione di legami dipolo-dipolo o legame d’idrogeno.
10. L’acqua può intergire e quindi sciogliere inoltre composti ionici mediante il processo
definito di solvatazione. Gli ioni (cationi e anioni) generati dalla dissociazione di un
composto ionico (definito elettrolita) possono interagire con l’acqua mediante
formazione di legami ione-dipolo. L’energia guadagnata dal sistema nella
formazione di tali legami deve compensare l’energia necessaria alla rimozione delle
interazioni ioniche nel reticolo cristallino (Es. NaCl). Se le forze che vincolano gli
ioni nel reticolo sono più grandi rispetto a quelle corrispondenti agli ioni solvatati, il
composto ionico mostrerà una ridotta solubilità in acqua.
Glossario
Chimica supramolecolare: chimica degli aggregati molecolari (sistemi multi molecolari) di elevata
complessità risultanti dall’associazione di due o più specie molecolari unite da interazioni
intermolecolari
Metilene: è un gruppo funzionale costituito da un atomo di Carbonio legato a due atomi di idrogeno
( formula –CH2-) legato ad un altri due atomi (l’atomo di C deve essere tetravalente).
Elettrolita:sostanze che in soluzione si dissociano in ioni. Acidi, basi e sali sono ad esempio
elettroliti.
Anfifilico: molecola contenente sia gruppi idrofili che gruppi idrofobi.
Anfipatico: sinonimo di anfifilico.
Solvatazione: interazione tra soluto e solvente a livello molecolare.
Lezione del 26-11-12 (2h-diapositive 1-7_file: lezione 2)
1) Introduzione ai gruppi funzionali caratterizzanti le molecole organiche. Un
gruppo funzionale è un insieme di atomi che presentano legami specifici
orientati nello spazio in modo univoco. Il gruppo funzionale conferisce
specifiche proprietà chimico-fisiche al composto.
2) Idrocarburi alifatici: composti costituiti da C e H contenenti legami semplici
carbonio-carbonio (alcani), legami doppi carbonio-carbonio (alcheni), legami
tripli carbonio-carbonio (alchini). Nomenclatura di alcani, alcheni alchini.
3) Ibridazione del carbonio:
a) ibridazione sp3: ibridazione dell’orbitale 2s con i tre orbitali 2p. Tale
processo genera 4 orbitali ibridi sp3 degeneri e ad energia intermedia rispetto
agli orbitali 2s e 2p originari. E’ importante ipotizzare l’ibridazione del
carbonio per giustificare l’equivalenza dei legami in molecole come il
metano, primo membro della serie omologa degli alcani. Infatti la
configurazione 2s2 2p2 di C potrebbe generare per eccitazione di uno degli
elettroni 2s ad un orbitale p la configurazione 2s1 2p3 giustificando la
tetravalenza del carbonio (4 elettroni spaiati). Però i legami formati in tal
modo non sarebbero tra loro equivalenti poiché gli elettroni di C sono
descritti da orbitali diversi e corrispondenti a livelli energetici differenti
(E2s<E2p), generando in tal modo legami energeticamente non equivalenti.
L’ibridazione sp3 porta invece ad avere 4 elettroni spaiati energeticamente
equivalenti nei 4 orbitali ibridi degeneri. Tali elettroni potranno essere
condivisi con 4 atomi di H generando l’idruro di carbonio che presenta
legami energeticamente uguali. L’ibridazione sp3 induce una geometria
tetraedrica della molecola a livello dell’atomo di carbonio caratterizzato da
tale tipo di ibridazione.
b) Ibridazione sp2: coinvolge l’orbitale 2s e due dei 3 orbitali 2p di C e genera
tre orbitali sp2 che possono essere occupati da 3 dei 4 elettroni di valenza di
C. tali elettroni sono disaccoppiati e possono essere condivisi nella
formazione di 3 legami equivalenti. L’ultimo elettrone di valenza di C occupa
l’unico orbitale p non coinvolto nell’ibridazione e può essere condiviso nella
formazione di un secondo legame tra l’atomo di C ibridato sp2 e un altro
atomo (C, O). Tale secondo legame dà origine al doppio legame ed è meno
stabile del legame formato dalla sovrapposizione di due orbitali ibridi sp2 o
sp3 di due atomi di carbonio diversi. Questo ci dice che un doppio legame è
costituito in realtà da due legami singoli energeticamente diversi. Non
fraintendere quest’ultimo aspetto trascurando la maggiore stabilità di un
doppio legame rispetto ad un legame singolo. Ovviamente l’energia di
dissociazione di un doppio legame è maggiore rispetto a quella di un legame
singolo. Il doppio legame carbonio carbonio è il gruppo funzionale tipico
degli alcheni. L’ibridazione sp2 induce planarità nella molecola. Quando in
una molecola si può osservare un doppio legame non solo tra C e C ma anche
tra C e O o C e N si può affermare che quella specifica regione della
molecola è planare.
c) Ibridazione sp:Alchini (Triplo legame) e geometria lineare.
4) La reattività degli idrocarburi alifatici aumenta passando da alcani ad alcheni
e ad alchini. Per tale motivo gli alchini, estremamente reattivi sono poco comuni
in biochimica ed i tripli legami compaiono poco frequentemente tra i gruppi
funzionali caratterizzanti le biomolecole.
5) Proprietà fisiche e chimiche degli idrocarburi alifatici: di solito presentano
punti di fusione (p.f.) e punti di ebollizione (p.e.) inferiori rispetto ai composti
polari possibilità di formazione di interazioni inter-molecolari più deboli
(dipolo istantaneo-dipolo istantaneo o frze di London) rispetto alle interazioni
che si instaurano tra molecole polari. Inoltre gli idrocarburi sono immiscibili
ovvero insolubili in acqua molecole lipofile e idrofile.
6) Idrocarburi aromatici benzene. Molecole planari contenenti un numero
definito di doppi legami (atomi di carbonio ibridati sp2).
7) Risonanza: delocalizzazione degli elettroni che stabilizza il sistema. Il fenomeno
della risonanza caratterizza non solo molecole aromatiche ma anche altri gruppi
funzionali caratterizzati da tale fenomeno.
8) Molte biomolecole sono aromatiche: alcuni amminoacidi (fenilalanina,
triptofano) costituenti delle proteine, le basi puriniche (adenina e guanina) e
pirimidiniche (citosina, timina e uracile) componenti di acidi nucleici.
9) Alcoli: composti caratterizzati dalla presenza di un gruppo funzionale C-O-H
L’atomo di carbonio legato all’ossigeno è legato a 3 altri SOSTITUENTI. In
generale la formula di un alcool può essere quindi espressa mediante la formula
X3-C-O-H dove X= H o R (sostituente alchilico). Gli alcoli possono essere
classificati in alcoli primari (RCH2-O-H), secondari (R2CH-O-H) o terziari
(R3C-O-H). La maggiore o minore sostituzione con gruppi alchilici ed il
differente intorno chimico che ne consegue incidono sulla reattività degli alcoli.
Nomenclatura: prefisso che indica la lunghezza della catena e suffisso –olo.
10) Gli alcoli possono formare legami d’idrogeno e presentano p.e. e p.f. maggiore
rispetto agli idrocarburi. Per lo stesso motivo sono spesso solubili in acqua.
11) Tioli: composti organici caratterizzati dalla presenza del gruppo funzionale C-SH. Anche nel caso dei tioli, che presentano notevoli analogie con gli alcoli la
formula generale può essere scritta come X3-C-S-H.
12) I tioli così come gli alcooli possono formare legami d’idrogeno. Essendo S
meno elettronegativo di O tali legami saranno più deboli (maggiore volatilità dei
tioli rispetto agli alcoli. La formazione di legami d’idrogeno rende i tioli spesso
solubili in acqua.
13) Ammine: composti organici caratterizzati dalla presenza di un legame C-NX2
dove X=H, R. Le ammine possono essere considerate composti ottenuti per
sostituzione di atomi d’idrogeno nell’ammoniaca (NH3) con gruppi alchilici.
Come gli alcoli le ammine possono essere classificate in ammine primarie (RNH2), secondarie (R2NH) e terziarie (R3N). Anche in tal caso l’intorno chimico
dell’azoto condiziona la reattività delle ammine ed in particolare la loro basicità
e la tendenza alla formazione di un legame dativo dovute al doppietto non
condiviso sull’atomo di azoto.
14) Le ammine possono formare legami d’idrogeno e per questo sono spesso solubili
in acqua. La forza di tali legame d’idrogeno è ridotta rispetto a quella dei legami
formati dagli alcoli (N meno elettronegativo di O). Quindi le ammine sono
spesso più volatili degli alcoli.
15) Composti carbonilici: aldeidi e chetoni sono caratterizzati dalla presenza di un
gruppo carbonilico (C=O). La formula generale è X2C=O dove se X=H e R la
formula generale corrisponderà a quella di un’aldeide, se X=R’ e R’’ la formula
generale corrisponderà ad un chetone. Nomenclatura: prefisso numerico relativo
alla lunghezza della catena e suffissi –ale per le aldeidi e –one per i chetoni.
16) L’atomo di C presenta un’ibridazione sp2 planarità. L’elevata elettronegatività
dell’ossigeno rispetto a C determina la presenza di + su C (carattere elettrofilo
che determina la reattività di aldeidi e chetoni che tendono a reagire con sostanze
nucleofile). Aldeidi e chetoni possono essere solo accettori di legame
d’idrogeno solubilità in acqua ma elevata volatilità rispetto ai composti
precedentemente trattati.
Glossario.
Chimica inorganica: branca della chimica che studia gli elementi, la sintesi e la caratterizzazione
di composti inorganici. I composti inorganici sono tutti i composti chimici che non contengono
atomi di carbonio.
Chimica organica: branca della chimica che descrive le caratteristiche chimiche e fisiche delle
molecole organiche. Vengono definite molecole organiche i composti del carbonio con eccezione
degli ossidi di questo elemento (monossido di carbonio, CO; diossido di carbonio o anidride
carbonica, CO2) ed i sali idrogeno-carbonato (denominato anche bicarbonato, HCO3-) e carbonato
(CO32-) ottenuti per reazione del teorico acido carbonico, formato dalla reazione dell’anidride
carbonica con acqua (CO2 + H2O = H2CO3) con composti basici.
Idrocarburi: composti costituiti da C e H.
Ibridazione: combinazione matematica di orbitali ad energia poco diversa (di solito coinvolge
orbitali di valenza)
Serie omologa: in chimica una serie omologa è una serie di composti organici che presentano
stessa formula generale, stesse proprietà chimiche conferite dalla presenza degli stessi gruppi
funzionali e da proprietà fisiche che variano al variare del peso molecolare.
Tetraedro: poliedro a 4 facce triangolari caratterizzato da 4 vertici e 6 spigoli.
Poliedro: solido delimitato da un numero finito di facce piane poligonali.
Planarità: è la condizione caratterizzante una superficie i cui punti appartengano tutti ad un unico
piano.
Linearità: in ambito geometrico una linea è un isieme infinita di punti adimensionati che possied
una sola dimensione la lunghezza e manca di larghezza e profondità.
Punto di fusione: temperatura alla quale il sistema passa dallo stato solido allo stato liquido.
Punto di ebollizione: temperatura alla quale il sistema passa dallo stato liquido allo stato gassoso.
Volatilità: proprietà chimico-fisica che rappresenta la tendenza di un solido o di un liquido
rispettivamente a sublimare o evaporare.
Sostituente: in chimica organica indica un atomo o un gruppo di atomi che sostituiscono un atomo
di idrogeno legato ad untomo di carbonio tetravalente.
Alchilico: un gruppo alchilico è un gruppo ostituente contenente carbonio. Viene indicato con il
simbole generico R.
Intorno chimico: atomi o molecole direttamente interagenti con un atomo o parte di esso o con una
molecola o parte di essa mediante legami chimici o interazioni deboli.
Nucleofilo: in chimica, un nucleofilo è una specie che partecipa ad una trasformazione donando un
doppietto elettronico e legandosi alla specie accettrice definita elettrofilo.
Lezione del 27-11-12 (3h-diapositive 7-12_file: lezione 2)
1)
Acidi carbossilici: gli acidi carbossilici sono caratterizzati dalla presenza di
un gruppo funzionale carbossile (-COOH) contenente un atomo di carbonio con
ibridazione sp2 (planarità).
2)
La nomenclatura degli acidi carbossilici prevede l’utilizzo dei prefissi
utilizzati per gli idrocarburi, che indicano la lunghezza della catena di atomi di
carbonio ed il suffisso –oico (acido metanoico, acido etanoico, acido propanoico).
3)
Il gruppo carbossilico può essere sia donatore che accettore di legame
d’idrogeno. Questo determina la minore volatilità rispetto ad aldeidi e chetoni che
contengono il gruppo carbonilico potenzialmente accettore ma non donatore di
legame d’idrogeno.
4)
Riprenderemo in lezioni successive il concetto di acidità degli acidi
carbossilici: la dissociazione acida in acqua di un acido carbossilico genera ioni
idronio (H3O+) e l’anione monovalente carbossilato (-COO-). L’aumento della
concentrazione di ioni H3O+ determina una riduzione del pH delle soluzioni acquose
di acidi carbossilici.
5)
Derivati degli acidi carbossilici:
a) Alogenuri acilici: negli alogenuri acilici (R-COX, X=F, Cl, Br, I) il gruppo
ossidrilico legato all’atomo di C con ibridazione sp2 viene sotituito da un
alogeno. A causa dell’elevata elettronegatività degli alogeni, tali composti sono
estremamente reattivi (il carbonio con ibridazione sp2 presenta elevata + a causa
dell’effetto elettronattrattore sinergico di O e X) e poco rilevanti in biochimica.
b) Anidiridi: le anidridi(termine mutuato dalla chimica inorganica dove con il
termine anidride si indica un composto binario costituito da un non metallo e
ossigeno definito anche ossido acido che in acqua genera un ossoacido del non
metallo) degli acidi carbossilici possono essere ottenute per condensazione di due
molecole di acido carbossilico con formazione di una molecola d’acqua RCOOH + R’-COOH : H2O + (R-CO)-O-(OC-R’), dove il simbolo : indica la
reversibilità del processo. La reversibilità della reazione indica che le anidridi in
acqua possono generare due molecole di acido carbossilico mediante una
reazione di idrolisi. Le anidridi di acidi carbossilici ma soprattutto dell’acido
fosforico (vedi i punti successivi) caratterizzano diverse molecole importanti dal
punto di vista biochimico e sono un gruppo funzionale associato a molecole
piuttosto reattive che vengono definite per questo molecole ad alta energia e sono
coinvolte nella produzione di energia nella cellula. Tali molecole non hanno
funzione strutturale o plastica.
c) Esteri: gli esteri sono il risultato della condensazione di una moelcola di acido
carbossilico e una molecola di alcool R-COOH + R’-OH : H2O + R-COOR’). Tale reazione analogamente alla condensazione di due moelcole di acido
carbossilico precedentemente descritta è reversibile. Infatti in acqua l’estere può
dissociarsi generando acido carbossilico e acool. Tale processo è però meno
favorito rispetto all’idrolisi di un’anidride ovvero gli esteri sono meno reattivi
delle anidridi. Alcune molecole contenenti legami esterei come i fosfolipidi
possono avere funzione strutturale.
d) Ammidi: le ammidi possono essere ottenute dalla condensazione di un acido
carbossilico con ammoniaca o ammine primarie o secondarie R-COOH +
NHX2 : R-CO-NX2 + H2O; X=H, R. Anche tale processo è reversibile e le
ammidi possono idrolizzare generando acido carbossilico e ammina primaria o
secondaria (o ammoniaca) anche se in tale processo è meno favorito rispetto ad
anidridi e esteri. L’ammide costituisce il gruppo funzionale caratteristico delle
proteine (oligopeptidi e peptidi) che hanno spesso funzione strutturale e devono
essere caratterizzate da stabilità, conferita seppur parzialmente dalla bassa
6)
a)
b)
c)
reattività del legame ammidico.
e) La particolare stabilità delle ammidi è dovuta alla possibile risonanza del
doppietto non condiviso dell’atomo di azoto. Tale formula di risonanza
conferisce parziale carattere di doppio legame al legame C-N del gruppo
ammidico determinando l’elevata stabilità delle ammidi. L’idrolisi delle ammidi è
infatti possibile a T elevate e richiede spesso catalisi
f) La reattività dei derivati degli acidi carbossilici decresce quindi secondo l’ordine
seguente: alogenuri acilici > anidridi > esteri > ammidi.
Così come gli acidi carbossilici, sono noti anche importanti derivati dell’acido
fosforico (H3PO4). L’acido fosforico è un composto inorganico a carattere acido che
a pH fisiologico è presenta sotto forma di anione divalente e che può generare:
Fosfoanidridi: composti risultanti dalla condensazione con produzione di acqua di
due molecole di fosfato inorganico o di gruppi fosfato legati a gruppi funzionali
organici. Le fosfoanidridi sono molto reattive e sono contenute nei cosiddetti
composti ad alta energia come adenosina 5’-trifosfato (ATP). L’idrolisi di un
legame fosfoanidridico è esoergonica.
Anidridi miste: composti ottenuti dalla condensazione di acido fosforico o composti
organici contenenti un gruppo fosfato e acidi carbossilici. Come nel caso delle altre
condensazioni la reazione avviene con produzione di acqua. Come le fosfoanidridi,
le anidridi miste possono idrolizzare in processi altamente esoergonici e sono quindi
contenute in molecole reattive come alcuni intermedi della glicolisi.
Fosfoesteri: composti ottenuti dalla condensazione di un alcool con acido fosforico
o con il gruppo fosfato legato ad una molecola organica. In analogia con quanto
accade per i derivati degli acidi carbossilici, i fosfoesteri sono meno reattivi (più
stabili) rispetto alle fosfoanidridi o alle anidridi miste. Il gruppo fosfoestereo è un
gruppo funzionale caratteristico di molte biomolecole (nucleosidi, fosfolipidi,
intermedi della glicolisi, ATP, adensoina 5’-difosfato (ADP), adenosina 5’monofosfato (AMP)),
Glossario.
Elementi metallici: gli elementi metallici sono caratterizzati da bassa affinità elettronica e basso
potenziale di prima ionizzazione. Essi sono inoltre conduttori di calore ed elettricità. Gli elementi
metallici sono localizzati a sinistra e nella zona di transizione centrale della tavola periodica e sono:
gli elementi del I e del II gruppo, Ag, Al, Fe, Cu, Au, Zn, Pt, Pb, Sn, Ti, Hg,
Elementi non metallici: gli elementi non metallici sono cattivi conduttori di calore ed elettricità e
sono caratterizzati da elevata affinità elettronica ed elevato potenziale di prima ionizzazione rispetto
agli elementi metallici. Tra gli elementi non metallici, localizzati in alto a destra del sistema
periodico con l’eccezione di H considerato un non metallo, sono B, C, N, O, F, P, S, Cl, Se, Br, I.
Elementi semimetallici: elementi con caratteristiche intermedie tra metalli e non metalli. Tra questi
possono essere annoverati Si e As.
Anidridi: ossidi acidi generati da un non metallo e ossigeno. Tali ossidi generano in acqua acidi
ternari o ossoacidi. Es: SO3 (anidride solforica) + H2O H2SO4 (acido solforico).
Ossidi basici: composti binari costituiti da un metallo e ossigeno. Tali composti, reagendo con
l’acqua generano idrossidi caratterizzati dal legame tra l’elemento metallico e gruppi ossidrilici. Gli
idrossidi sono composti basici.
Idrolisi: con il termine idrolisi si indicano diverse reazioni chimiche in cui molecole vengono scisse
in due o più parti per effetto dell’acqua. Può essere considerata la reazione inversa dellea
condensazione.
Condensazione: reazione tra molecole diverse o diverse funzioni nella stessa molecola in cui le
parti reagenti si uniscono di solito con eliminazione di acqua.
Nucleoside: i nucleosidi sono composti costituiti da un monosaccaride (D-ribosio) e da basi azotate.
Per approfondimenti degli argomenti trattati:
Capitoli 1 e 2 del testo “Biochimica per le Scienze Motorie” di Antonio Di Giulio, Amelia
Fiorilli e Claudio Stefanelli, Casa Editrice Ambrosiana, 2011.
I riferimenti ai testi “Chimica, Biochimica e Biologia Applicata” di Massimo Stefani e Niccolò
Taddei indicati nelle diapositive sono altrettanto validi.