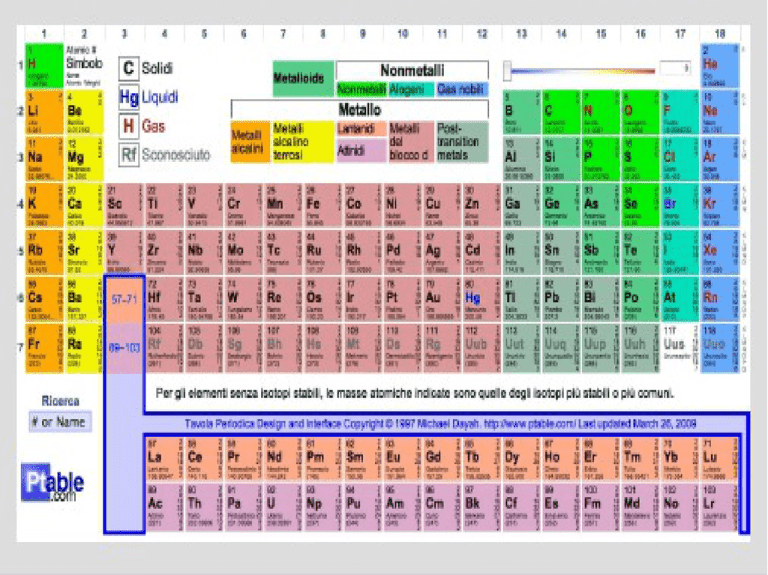
LA TAVOLA PERIODICA DEGLI
ELEMENTI
Proprietà periodiche degli elementi:
●
RAGGIO ATOMICO
●
POTENZIALE DI IONIZZAZIONE
●
AFFINITA' ELETTRONICA
●
ELETTRONEGATIVITA' *
Cella elementare nel cristallo di
NaCl
Simbolismo di Lewis
●
●
●
Disegnare la molecola o lo ione poliatomico con gli
atomi legati da legami singoli;
Sommare il numero di e- di valenza su ciascun
atomo nella molecola per trovare il numero totale di
e- di valenza; Si aggiunge un elettrone per ogni
caricanegativa presente (se si tratta di un anione)
oppure si sottrae un elettrone per ogni carica
positiva presente (se si tratta di un catione).;
Dividere il numero totale di e- di valenza per 2, per
ottenere i doppietti elettronici;
●
●
Sottrarre il numero di doppietti che occorrono
per formare legami singoli tra gli atomi e usare i
rimanenti per completare l'ottetto attorno a
ciascun atomo (che saranno rappresentati
attraverso 2 puntini);
Se qualche atomo ha ancora l'ottetto incompleto
convertire i doppietti non leganti in leganti
(formazione di legami doppi o tripli)
Es: CO2; BF3 (eccezione), H2O; NO3-; NH3;
PCl5
LEGAMI INTERMOLECOLARI
Con
il
termine
generico
di
legami
intermolecolari si intendono le forze attrattive
tra molecole.
●
●
Allo stato gassoso molto rarefatto, le molecole
sono dotate di elevata energia cinetica e sono
indipendenti le une dalle altre.
Allo stato liquido e allo stato solido la
situazione è diversa: la maggior compattezza e
la minor mobilità delle molecole sono da
imputarsi a interazioni tra esse. Tali interazioni
riguardano sia molecole polari che molecole
non polari.
CLATRATO: sistema formato dalla occlusione di atomi o
piccole molecole (gas nobili, anidride solforosa, anidride
carbonica, idracidi, metanolo ecc.) nelle cavità interstiziali
presenti nei reticoli cristallini di composti ospitanti che
possono essere organici (idrochinone, urea ecc.) o
inorganici (zeoliti cristalline, acqua).












