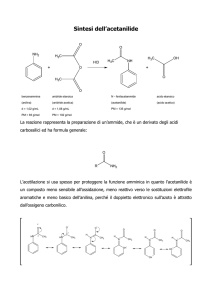
Reazioni di radicali
Reazioni di propagazione
Reazioni di terminazione
Reazioni di propagazione
{
Processi di trasferimento di radicali
z
coinvolgono un radicale ed una molecola di
substrato e portano alla formazione di un
nuovo radicale
Sostituzione o Estrazione
R1 + A R2
{
R1
A
+ R2
Il processo più comune di questo tipo è
l’estrazione di un atomo di idrogeno o di
alogeno da parte di un radicale su una
molecola
Cl
+ H CH3
CH3 + Cl
CCl3
HO + H R
H Cl + CH3
H3C Cl + CCl3
HO H + R
Clorurazione del metano
{
Un esempio di tali reazioni sono entrambe le
reazioni di propagazione della catena di
clorurazione del metano
Cl2
hν o Δ
Cl + H CH3
Cl
+
iniziazione
H + CH3
propagazione
CH3 + Cl2
Cl 2 Cl Cl
CH3 + Cl Cl CH3 + Cl CH3 + CH3
Cl2
Cl
CH3
H3C CH3
terminazione
Idrogeno Estrazione
{
Le reazioni di estrazione avvengono
comunemente e il motore della reazione è dato
dalla differenza di energia tra il legame che si
rompe e quello che si forma. La reazione infatti
è termodinamicamente favorita se la BDE del
legame che si rompe è minore della BDE del
legame che si forma.
HO + H R
BDE(Kcal/mol)
95
HO H + R
119
Idrogeno Estrazione
{
La reazione sarà quindi abbastanza selettiva se il
radicale che reagisce è un radicale poco reattivo e cioè la
BDE del legame che andrà a formare per estrazione sarà
non molto elevata:
z
in questo caso esso riuscirà a strappare solamente quegli
atomi legati debolmente e se si troverà di fronte molecole
che possiedono atomi di idrogeno diversi (legati cioè ad
intorni diversi) strapperà quegli atomi di idrogeno la cui
BDE è più bassa.
COOH
ROO
- ROO-H
H
H
76
96
88
COOH
BDE(Kcal/mol)
BDE
COOH
COOH
ROO
- ROOH
{
La stabilità del radicale è
correlata alla BDE del suo
legame con un atomo di
idrogeno.
CH
H
BDE (kcal mol-1)
76
CH
H
85
Legame
R CH
CH
R CH
R CH
CH
CH
R
ROO H
H3C S H
R
CH
H
R
H H
H3C H
H
HO H
88
91.8
96.3
104.2
104.3
111
119.3
Idrogeno Estrazione
{
{
Al contrario se il radicale è molto reattivo, come
ad esempio l’idrossi-radicale (BDE=119
Kcal/mol), esso strappa tutti gli atomi di
idrogeno che si trova davanti e la reazione è
poco selettiva.
In ogni caso la reazione porterà alla formazione
del radicale più stabile che di solito è quello più
stabilizzato per risonanza.
radicale
allilico
H
H
RO O
+ H C C CH2
H2
85
110
ROO H + C C CH2
H
H
H
H
C C C
H
H
H
ROO H + CH3 C CH2
88
radicale
vinilico
BDE(Kcal/mol)
Autossidazione
X
X H + L
+ H L
L + O O
LO O
LO OH + L LO O + L H
2 LO O
LO OL
2 L
LO O
L
+ L
iniziazione
+
propagazione
O2 (1O2)
terminazione
L
LO OL
Addizione
{
L’addizione di un radicale ad un composto
insaturo, generalmente un alchene ma anche
un acetilene o un composto carbonilico, di solito
porta alla formazione di un altro radicale più
stabile.
R
+
C C
R C C
Addizione di HBr agli alcheni
{
Un esempio di reazione che prevede degli stadi
di addizione radicalica è la reazione di
addizione di acido bromidrico ad un alchene
catalizzata da perossidi.
H Br +
H
CH3
H
H
propene
ROOR
Br CH3
H
anti-Markownikov
H
H H
1-bromopropano
Meccanismo
2R O
ROOR
iniziazione
RO H + Br
R O + H Br
Br
propagazione
+
H
CH3
H
H
H CH3
Br
C
H H
H CH3
Br
C
H H
radicale secondario
H CH3
+ H Br
Br
H
H H
1-bromopropano
+ Br
Addizione di HBr agli alcheni
{
La peculiarità di questa reazione è che porta
alla formazione di prodotti anti-Markownikov in
quanto il primo stadio di propagazione prevede
l’addizione dell’alogeno con formazione del
radicale più stabile.
Br
Br
+
+
H
CH3
H
H
H
CH3
H
H
H CH3
Br
C
radicale secondario
H H
H CH3
C
H H
Br
radicale primario
Addizione
{
Se un radicale iniziatore si forma in
presenza di un alchene privo di atomi di
idrogeno facilmente estraibili (vinile), il
radicale che si forma dal primo processo di
addizione si trova di fronte solamente altre
molecole viniliche e l’unico modo che ha per
stabilizzarsi propagando la catena è quello
di addizionarsi ad un’altra molecola di
substrato insaturo (vinile).
Addizione
{
{
Tale processo avviene ripetutamente portando alla formazione di
molecole sempre più grandi (telomeri) formate da diverse unità di
substrato (monomero) unite tra di loro.
Ulteriori ripetute addizioni, che possono eventualmente consumare
centinaia o migliaia unità di substrato, sono anche possibili e
portano ad un processo di polimerizzazione.
In +
Ph
H
H
H
H Ph
In
H Ph H Ph
+ stirene
H H H H
H H
stirene
+ n CH2CHPh
Polimero
(molte unità di monomero)
In
Telomero
(poche unità di monomero)
In (CH2CHPh)n CH2 CHPh Addizione all’Ossigeno
R + O O
ROO
Autossidazione
X
X H + L
+ H L
L + O O
LO O
LO OH + L LO O + L H
2 LO O
LO OL
2 L
LO O
L
+ L
iniziazione
+
propagazione
O2 (1O2)
terminazione
L
LO OL
Frammentazione
{
{
Sono un processo durante il quale un radicale
rompe un legame in β al centro radicalico
(legame tra l’atomo adiacente all’atomo su cui si
trova l’elettrone spaiato e l’atomo ancora
successivo) per formare un radicale più piccolo
e più stabile e una molecola insatura (doppio
legame).
Esso può essere visto come il processo inverso
dell’addizione.
CH3
H3C
O
CH3
H3C +
H3C
H3C
O
Frammentazione
{
{
{
Alcuni esempi di un tale processo sono: la
frammentazione degli alcossi radicali terziari che porta
alla formazione di un alchil radicale e di un composto
carbonilico
Nel caso in cui i gruppi attaccati al carbonio in α al centro
radicalico siano diversi si rompe il legame più debole e si
forma quindi il radicale più stabile.
Non si ha mai la rottura di un legame C-H o C-Ph in
quanto troppo forti.
primario
H3C
H2C
CH3
C
O
H3C H CH
3
secondario
metilico
CH3
H3C CH +
CH3
H2C
H3C
O
Frammentazione
{
La frammentazione di radicali al carbonio
che abbiano attaccato al carbonio
radicalico un gruppo alcossilico (-OR),
porta ugualmente alla formazione di un
chetone e di un alchil radicale
CH3
H3C C O CH3
H3C +
H3C
H3C
O
Frammentazione
{
La frammentazione di un acil radicale porta alla
formazione di un radicale al carbonio e di ossido di
carbonio
R
R + C O
O
{
{
La frammentazione di un acilossi radicale porta alla
formazione di un radicale al carbonio e di anidride
carbonica.
Questo processo viene anche detto
decarbossilazione ed è un buon metodo per produrre
radicali al carbonio.
Gli aroilossi radicali hanno un tempo di vita più lundo
degli acilossiradicali e quindi decarbossilano più
lentamente.
O
O
R +
R
O
CO2
Ph +
Ph
O
CO2
Riarrangiamento
{
Le reazioni di trasferimento di radicale
(estrazione, addizione e frammentazione)
possono avvenire anche all’interno della
stessa molecola portando ad un
riarrangiamento della molecola stessa.
Trasferimento intramolecolare di un
atomo
{
Un alcossi radicale a catena lunga può
dare una reazione di idrogeno estrazione
intramolecolare attraverso la formazione
di uno stato di transizione ciclico a 5 o a
6 termini.
H
O H
6
5
7
2
4
3
1
4-metil-3-epten-2-ossi radicale
H
OH
C
Riarrangiamento
Decomposizione di aloammine per la sintesi di pirrolidine
H
+
N
R
H H
hν
R
R
N
H
+ Cl
H
H
+
N
H
Cl
NaOH
+
N
R
Cl
H
+
+
R
+
+
R
H
Cl
H
H
N
N
+
R
N
Addizione intramolecolare di un atomo
{
In modo simile si può avere addizione
intramolecolare se l’atomo che porta
l’elettrone spaiato si trova in posizione
1,5 o 1,6 rispetto ad una atomo di
carbonio insaturo.
5
1O
2
3
O
4
4-metil-4-epten-2-ossi radicale
C
Riarrangiamento
COOH
X
COOH
COOH
COOH
O
Sintesi di prostaglandine dall’acido arachidonico
COOH
O
O
COOH
O
HO
COOH
O
O
HO
OH
COOH
Frammentazione intramolecolare
{
Avvengono facilmente quando un alcossi
radicale porta attaccati due gruppi
alchilici facenti parte di un sistema
cicloalchilico in quanto porta ad una
apertura di anello.
HO
R
HO
O
C
R
=
H2C
H2C
HO
O
C
C
H2
CH2
CH2
O
HO
O
C
=
Terminazione
{
Processi di combinazione di radicali
z
coinvolgono due radicali e portano a prodotti
non radicalici nei quali tutti gli elettroni sono
accoppiati
Combinazione o accoppiamento
R1
{
{
R2
Processo non molto importante
Radicali relativamente stabili e quindi
poco reattivi
z
{
R1
Processo energeticamente favorevole
Concentrazione bassa dei radicali
z
{
+ R2
Benzil radicale
Favorevole nella gabbia di solvente
Disproporzionamento
{
{
Il trasferimento di un β-idrogeno (atomo
di idrogeno attaccato all’atomo adiacente
al centro radicalico) da un radicale ad un
altro per dare prodotti non radicalici
Processo energeticamente favorevole
H C C + H C C
H C C H +
C C
Disproporzionamento
{
Affinché un tale processo possa avvenire deve
però essere presente un atomo di idrogeno
estraibile sull’atomo adiacente al centro
radicalico, o in posizione coniugata.
H3C H
H3C C C
+
H3C C C H + H2C C C
H3C C C
H3C H
H3C H
H3C H
H3C H
H3C H
H3C H
H3C H
2,2,dimetil-propilradicale
O +
H
fenossi-radicale
O
O H + C
O
non coniugato
Disproporzionamento
{
Affinché possa avvenire deve essere
presente un atomo di idrogeno estraibile
sull’atomo adiacente al centro radicalico
o in posizione coniugata.
H
H
H
O
+ H
H
H
H
H
H
O H +
H
O
C
H
O
H2C
O
Reazioni Redox
{
Come un radicale si può formare attraverso una
reazione
di
trasferimento
elettronico
(trasferimento di un elettrone da una specie ad
un’altra), allo stesso modo esso si può
distruggere. La riduzione di radicali per mezzo
di ioni di metalli di transizione porta alla
formazione di anioni mentre l’ossidazione porta
alla formazione di cationi.
HO + Fe
Ar
(II)
HO-
(II)
Ar+
+ Cu
+ Fe
(III)
+ Cu
(I)