i g t c
unità c3
obiettivo
Scoprire che la periodicità
degli elementi dipende
dal numero atomico
e non dalla massa
x÷
–+
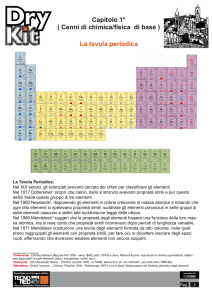
La tavola periodica
degli elementi
L tavola di Mendeleev
1 La
e la scoperta della periodicità
Dopo alcuni tentativi di classificazione degli elementi fino ad allora noti, sulla base
delle scarse conoscenze delle loro proprietà chimiche e fisiche, Mendeleev in Russia
e, indipendentemente, L. Meyer in Germania, scoprirono che le proprietà degli
elementi sono “periodiche”, cioè si ripetono a intervalli regolari quando gli
elementi vengono ordinati in funzione delle loro masse atomiche crescenti.
Sulla base di questa scoperta nel 1869 Mendeleev mise a punto la sua tavola periodica dove collocò tutti gli elementi allora noti, ordinandoli in funzione della massa
atomica crescente. Ottenne così otto colonne, in ognuna delle quali venivano a
trovarsi elementi che presentavano spiccate analogie nelle loro proprietà.
Quando l’ordine sembrava interrotto, dovette lasciare spazi vuoti nell’attesa che
altri elementi venissero scoperti per riempirli. Mendeleev riuscì addirittura a predire la massa atomica di elementi ancora ignoti e anche le loro proprietà in base
alla posizione che avrebbero dovuto occupare nella tavola.
Egli chiamò ekaboro, ekalluminio ed ekasilicio tre elementi, le cui proprietà coincidevano perfettamente con quelle dello scandio, del gallio e del germanio, scoperti sei anni più tardi. La sorprendente corrispondenza tra le previsioni fatte e le
caratteristiche trovate per gli elementi mancanti costituì una formidabile conferma della periodicità delle proprietà chimiche degli elementi.
KXY%(<c\d\ek`gi\m`jk`[XD\e[\c\\m
ekaboro
massa atomica = 44
ekalluminio
=`^%( CXkXmfcXg\i`f[`ZX
[`D\e[\c\\m%
ekasilicio
densità *ossido = 3,50
massa atomica = 68
densità = 6
massa atomica = 72
densità = 5,50
<c\d\ek`jZfg\ik``ej\^l`kf
massa atomica = 44,96
densità ossido = 3,86
gallio
massa atomica = 69,72
densità = 5,96
germanio
massa atomica = 72,60
densità = 5,47
scandio
* la densità è espressa in g/cm3
La scoperta di Mendeleev non riusciva però a spiegare alcune apparenti anomalie. Il cobalto, per esempio, pur avendo massa atomica maggiore di quella del nichel, possiede delle proprietà che nella tavola periodica porterebbero a collocarlo
prima di questo elemento.
(''
modulo
c
i g t c
La struttura della materia
x÷
–+
Quasi mezzo secolo più tardi Moseley, con i suoi esperimenti sull’emissione di
raggi X da parte degli elementi sottoposti a radiazioni ad alta energia, scoprì che
la carica nucleare degli atomi cresce di un’unità passando da un elemento al successivo nella tavola periodica.
Per spiegare il ripetersi periodico delle proprietà degli elementi, Moseley suggerì
che questi andassero sistemati in funzione della carica nucleare crescente anziché della massa atomica, come aveva ipotizzato Mendeleev. In tal modo la posizione corretta del cobalto (Z = 27) è proprio quella che precede il nichel (Z = 28),
dal quale, appunto, differisce per una unità di numero atomico.
Pertanto, la legge periodica stabilisce che:
c\gifgi`\k~[\^c`\c\d\ek`i`Zfiifefg\i`f[`ZXd\ek\hlXe[f
^c`\c\d\ek`m\e^feffi[`eXk`j\Zfe[f`ccfifeld\ifXkfd`Zf
Zi\jZ\ek\%
Clicca qui per eseguire
il test interattivo
-.!*ÊÊÍgÄÍÊ^ÊSÍÀ
Stabilisci
Stabilis
isci se le seguenti
nti affe
affermazioni sono vere(V) o false(F).
1. Secondo Mendeleev, le proprietà degli elementi
ricorrono periodicamente quando vengono
ordinati in funzione delle loro masse atomiche
crescenti.
obiettivo
Conoscere la periodicità
delle proprietà degli
elementi correlata alla loro
configurazione elettronica
esterna
2. Moseley suggerì che gli elementi
V F
nella tavola periodica andassero
sistemati in funzione del numero
atomico crescente.
V F
2 LLa tavola periodica moderna
Esaminando la configurazione elettronica dei primi 20 elementi, secondo il modello di Bohr, scopriamo una caratteristica assai importante: la periodica distribuzione degli elettroni nel livello più esterno. Infatti, se confrontiamo le configurazioni elettroniche dell’idrogeno (H), del litio (Li), del sodio (Na) e del potassio
(K) riportate nello schema qui sotto, possiamo notare che tutti e quattro gli elementi hanno in comune il fatto di avere un solo elettrone nel livello più esterno.
H
3 Li
11 Na
19 K
1
1s1
1s2
1s2
1s2
2s1
2s22p6 3s1
2s22p6 3s23p6 4s1
Analogamente, se confrontiamo le configurazioni elettroniche del berillio (Be), del
magnesio (Mg) e del calcio (Ca), scopriamo che questi elementi possiedono due
elettroni nel loro ultimo livello energetico, mentre, se confrontiamo la configurazione elettronica del boro (B) con quella dell’alluminio (Al), notiamo che entrambe presentano tre elettroni nel livello esterno.
Be
12 Mg
20 Ca
1s2
1s2
1s2
2s2
2s22p6 3s2
2s22p6 3s23p6 4s2
B
13 Al
1s2
1s2
2s22p1
2s22p6 3s23p1
4
5
Questa caratteristica è valida anche per gli elementi che presentano configurazioni elettroniche esterne con quattro, cinque, sei, sette e otto elettroni e per tutti gli
altri elementi oltre il ventesimo.
i g t c
unità c3 La tavola periodica degli elementi
x÷
–+
Da quanto osservato scaturisce che:
c\jkilkkli\\c\kkife`Z_\\jk\ie\[\^c`\c\d\ek`j`i`g\kfef
g\i`f[`ZXd\ek\f^e`hlXcmfckXj`ZfeZcl[\`ci`\dg`d\ekf
[`lec`m\ccfg\i`e`q`Xie\leXckif%
Di conseguenza possiamo dedurre che la causa della periodicità degli elementi va
attribuita proprio alle strutture elettroniche più esterne dei loro atomi che, come
abbiamo visto, si ripetono periodicamente. Pertanto:
m`\e\Z_`XdXkf^ljZ`f[`mXc\eqX`cc`m\ccfg`\jk\ief[`\e\i^`X\#
XeXcf^Xd\ek\#\c\kkife`[`mXc\eqX^c`\c\kkife``e\jjfZfek\elk`%
I gruppo
1
VIII gruppo
2
H
He
1 Periodo
1o strato
II gruppo
3
Li
4
III gruppo
IV gruppo
Be
5
B
6
Mg
13
Al 14
C
V gruppo
7
VI gruppo
VII gruppo
N 8
O 9
P 16
S 17
F 10
Ne
Cl 18
Ar
2 Periodo
2o strato
11
Na 12
Si 15
3 Periodo
3o strato
1 elettrone
di valenza
2 elettroni
di valenza
3 elettroni
di valenza
4 elettroni
di valenza
5 elettroni
di valenza
6 elettroni
di valenza
7 elettroni
di valenza
8 elettroni
di valenza
(eccetto He)
I periodi
Sulla base del nuovo criterio di classificazione gli elementi vengono collocati in
ordine di numero atomico crescente, incasellati in file orizzontali dette periodi, il
cui numero progressivo corrisponde al livello di riempimento.
Ogni nuovo periodo inizia con un elemento che ha un solo elettrone in un nuovo
livello principale di energia. Pertanto l’idrogeno H inizia il primo periodo, il litio
Li inizia il secondo periodo, il sodio Na inizia il terzo periodo e così via fino al settimo periodo, essendo sette i livelli energetici disponibili.
Tenendo conto del numero massimo di elettroni che ogni livello può ospitare,
possiamo così costruire la tavola periodica:
il primo periodo conterrà soltanto due elementi, l’idrogeno, H, e l’elio, He,
perché due al massimo sono gli elettroni appartenenti al primo livello;
il secondo periodo conterrà otto elementi, dal litio, Li, al neon, Ne, perché
otto sono al massimo gli elettroni permessi nel secondo livello;
il terzo periodo dovrebbe contenere diciotto elementi, essendo diciotto gli
elettroni che al massimo possono disporsi nel terzo livello. Come si è visto, però,
il sottolivello 3d segue il 4s nel diagramma energetico per cui nel terzo periodo
avremo soltanto otto elementi, corrispondenti al riempimento dei sottolivelli 3s
e 3p. I dieci elementi, dallo scandio, Sc, allo zinco, Zn, corrispondenti al riempimento del sottolivello 3d, si trovano invece nel quarto periodo.
Gli elementi che riempiono il sottolivello 3d, ma anche quelli che riempiono il 4d
e il 5d, sono detti elementi o metalli di transizione e si distinguono, rispettivamente, in elementi della prima serie di transizione (3d ), della seconda serie (4d )
e della terza serie (5d ).
('(
(')
modulo
c
i g t c
La struttura della materia
x÷
–+
Analogamente, gli elementi che utilizzano i sottolivelli 4f e 5f costituiscono due
serie di 14 elementi ciascuna, che vengono denominate rispettivamente serie dei
lantanidi e degli attinidi.
Queste due file, per comodità, nella tavola vengono rappresentate in basso.
I gruppi
Dopo aver disposto gli elementi lungo i periodi e aver collocato i periodi uno sotto
l’altro, si ottengono otto colonne verticali dette gruppi, al cui interno troviamo
elementi che possiedono uguale numero di elettroni nel livello più esterno.
Questi elementi presentano analoghe proprietà chimiche e pertanto si dice che appartengono alla stessa “famiglia chimica” e fanno parte dello stesso gruppo.
Così, per esempio, al primo gruppo appartengono gli elementi che hanno un solo
elettrone nel livello esterno. Essi costituiscono la famiglia dei metalli alcalini, ad
eccezione dell’idrogeno che presenta proprietà chimiche nettamente diverse, dal
momento che nel primo livello, a differenza degli altri, possono stare al massimo
due elettroni.
Al secondo gruppo troviamo gli elementi con 2 elettroni esterni che fanno
parte della famiglia dei metalli alcalino-terrosi.
Analogamente, nel terzo gruppo troviamo gli elementi con 3 elettroni nel
livello di valenza e così fino ad arrivare al settimo gruppo, dove troviamo
gli elementi appartenenti alla famiglia
degli alogeni che hanno 7 elettroni
nell’ultimo livello.
Nell’ottavo gruppo, infine, troviamo i
gas nobili, gli elementi cioè che hanno la configurazione esterna completa.
=`^%) :cfif#Yifdf\`f[`f
XggXik\e^fefXc^ilggf[\^c`Xcf^\e`%
Le notazioni di Lewis
Per evidenziare gli elettroni appartenenti al livello di valenza, G.N. Lewis ha proposto una semplice e comoda rappresentazione che utilizza il simbolo chimico
dell’elemento circondato da “puntini” corrispondenti agli elettroni di valenza.
Utilizzando le notazioni di Lewis per atomi che hanno soltanto elettroni negli
orbitali s e p dell’ultimo livello, possiamo notare che il numero di “puntini” corrisponde proprio al gruppo di appartenenza della tavola periodica, con la sola
eccezione dell’elio che, pur avendo soltanto due elettroni nell’ultimo livello, viene
collocato nell’ottavo gruppo in quanto, come il neon e l’argon, ha completato il
suo livello esterno con la sua configurazione elettronica 1s2.
KXY%)EfkXq`fe`[`C\n`j[\`gi`d`(/\c\d\ek`
Gruppo
I
II
III
IV
V
VI
VII
VIII
primo periodo
H
He
secondo periodo
Li
Be
B
C
N
O
F
Ne
terzo periodo
Na
Mg
Al
Si
P
S
Cl
Ar
Na
Mg
Ca
21
Sc
44,9559
3
22
Ti
47,90*
4
Idrogeno
0,30
313
2,1
H
1,0079
elettronegatività
(secondo Pauling)
simbolo
23
V
50,9414*
5
24
Cr
51,996
6
25
Mn
54,9380
7
26
Fe
55,847*
8
27
Co
58,9332
9
28
29
Cu
63,546*
11
non metalli
semimetalli
metalli
58,70
Ni
10
ELEMENTI DI TRANSIZIONE
energia di
ionizzazione
in kcal/mole
raggio atomico
in Å
1
massa
atomica
30
Zn
12
6
C
12,011
7
N
14,0067
V
15
VII
17
567
Elio
0,93
O
F
Ne
8 15,9994* 9 18,99840 10 20,179*
VI
16
Si
P
S
Cl
Ar
Ga
Ge
As
Se
Br
Kr
Alluminio
Silicio
Fosforo
Zolfo
Cloro
Argon
0,98
1,10
1,04
0,99
1,43
1,17
138
1,5 188
1,8 254
2,1 239
2,5 300
3,0 363
65,38 31
69,72 32 72,59* 33 74,9216 34 78,96* 35 79,904 36
83,80
Al
Boro
0,88
B
10,81
IV
14
He
4,00260
VIII
Carbonio
Azoto
Ossigeno
Fluoro
Neon
0,77
0,70
0,71
0,66
0,64
191
2,0 260
2,5 335
3,0 314
3,5 402
4,0 497
13 26,98154 14 28,086* 15 30,97376 16 32,06 17 35,453 18 39,948*
5
III
13
2
18
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
90
0,7
Ra
Radio
2,20
Fr
Francio
2,70
87
*La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Classificazione dei gruppi
comunemente usata.
0,9
1,1
*
ATTINIDI
**
LANTANIDI
Attinio
2,00
**Ac
140,12
Pr
Nd
59 140,9077 60 144,24* 61
1,3
1,5
Pa
Protoattinio
Th
Torio
1,65
Cerio
1,65
Ce
[145]
Pm
62
150,4
Sm
63
151,96
Eu
U
Uranio
1,42
1,7
Np
1,3
Nettunio
Pu
1,3
Plutonio
Am
1,3
Americio
Po
Polonio
1,40
2,0
At
Astato
1,40
Gd
Tb
Dy
Curio
Cm
Bk
Berkelio
Cf
Californio
Es
1,2
[254]
Einsteinio
99
Olmio
1,58
Ho
1,2
Fm
Fermio
Md
Mendelevio
174,97
Lu
Nobelio
No
Laurenzio
Lr
Lutezio
1,56
1,1 115
1,2
[259] 103 [260]
Itterbio
Yb
1,2 143
[258] 102
Tulio
1,56
Tm
100 [257] 101
Erbio
1,57
Er
Rn
Radon
2,2 248
64 157,25* 65 158,9254 66 162,50* 67 164,9304 68 167,26* 69 168,9342 70 173,04* 71
Praseodimio
Neodimio
Promezio
Samario
Europio
Gadolinio
Terbio
Disprosio
1,65
1,64
1,62
1,85
1,61
1,59
1,59
1,1 133
1,1 145
1,2 133
1,2 131
1,1 155
1,2 157
159
129
142
[251]
90 232,0381 91 231,0359 92 238,029 93 237,0482 94 [244] 95 [243] 96 [247] 97 [247] 98
58
Tungsteno
Afnio
Tantalio
Renio
Osmio
Iridio
Platino
Oro
Mercurio
Tallio
Piombo
Bismuto
Lantanio
(Wolframio)
1,57
1,43
1,37
1,37
1,34
1,35
1,38
1,44
1,50
1,71
1,75
1,46
1,88
0,7 120
0,9 129
1,3 138
1,5 184
1,7 182
1,9 201
2,2 212
2,2 207
2,2 213
2,4 241
1,9 141
1,8 171
1,8 185
1,9
1,1 127
[227]
[223] 88 226,0254 89
Ba
Bario
2,17
Cs
Cesio
2,62
Stronzio
Ittrio
Zirconio
Niobio
Molibdeno
Tecnezio
Rutenio
Rodio
Palladio
Argento
Cadmio
Indio
Stagno
Antimonio
Tellurio
Iodio
Xenon
1,31
1,41
1,37
1,33
2,15
1,80
1,57
1,41
1,36
1,32
1,33
1,34
1,38
1,44
1,49
1,62
1,40
0,8 131
1,0 152
1,2 160
1,4 156
1,6 166
1,8 167
1,9 173
2,2 178
2,2 192
2,2 175
1,9 207
1,7 133
1,7 169
1,8 199
1,9 208
2,1 241
2,5 280
96
[209] 85
[210] 86
[222]
55 132,9054 56 137,34* 57 138,9055* 72 178,49* 73 180,9479* 74 183,85* 75 186,207 76 190,2 77 192,22* 78 195,09* 79 196,9665 80 200,59* 81 204,37* 82 207,2 83 208,9804 84
Rubidio
2,44
Rb
Manganese
Potassio
Calcio
Scandio
Titanio
Vanadio
Cromo
Ferro
Cobalto
Nichel
Rame
Zinco
Gallio
Germanio
Arsenico
Selenio
Bromo
Kripton
1,12
1,21
1,17
1,14
2,31
1,97
1,60
1,46
1,31
1,25
1,26
1,25
1,24
1,28
1,33
1,22
1,22
1,29
100
0,8 141
1,0 151
1,3 158
1,5 156
1,6 156
1,6 171
1,5 182
1,8 181
1,8 176
1,8 178
1,9 216
1,6 138
1,6 187
1,8 231
2,0 225
2,4 273
2,8 323
[99] 44 101,07* 45 102,9055 46
106,4 47 107,868 48 112,40 49 114,82 50 118,69* 51 121,75* 52 127,60* 53 126,9045 54 131,30
37 85,4678* 38 87,62 39 88,9059 40 91,22 41 92,9064 42 95,94* 43
K
Sodio
Magnesio
1,86
1,60
117
0,9 177
1,2
19 39,098* 20 40,08
Classificazione dei gruppi
secondo la IUPAC
(1986) che suggerisce
la numerazione progressiva
da 1 a 18.
7
6
Be
9,01218
Berillio
1,11
124
1,0 215
1,5
11 22,98977 12 24,305
Litio
1,52
Li
4
II
2
numero
atomico
TAVOLA PERIODICA DEGLI ELEMENTI
x÷
–+
5
4
3
2
H
1,0079
I
ss
Idrogeno
0,30
313
2,1
3 6,941*
gruppi
periodi 1
1s
i g t c
unità c3 La tavola periodica degli elementi
('*
('+
modulo
c
i g t c
La struttura della materia
x÷
–+
La tavola in blocchi
Come è facile osservare, la tavola periodica è una sorta di mappa che permette
di ricavare la configurazione elettronica degli elementi. Essa può essere anche
suddivisa in blocchi, ognuno dei quali fa riferimento al riempimento di un particolare sottolivello. Così al blocco s corrispondono i primi due gruppi, al blocco p
i gruppi che vanno dal III all’VIII, mentre al blocco d e al blocco f corrispondono rispettivamente gli elementi di transizione (1a, 2a e 3a serie) e i lantanidi e gli
attinidi. Per una più immediata lettura, tali blocchi vengono rappresentati con
colori diversi.
I
1
H
s
II
p
He
III
IV
V
VI VII VIII
B
C
N
O
F
Ne
Al
Si
P
S
Cl
Ar
2
Li
Be
3
Na
Mg
4
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
5 Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
6
Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
At
Rn
7
Fr
Ra
Ac
Ku
Ha
d
f
=`^%* CXkXmfcXg\i`f[`ZX
jl[[`m`jX`eYcfZZ_`%
Ce
Pr
Nd
Pm Sm
Eu
Gd
Tb
Dy
Ho
Er
Tm
Yb
Lu
Th
Pa
U
Np
Am Cm
Bk
Cf
Es
Fm Md
No
Lr
Pu
Clicca qui per eseguire
il test interattivo
-.!*ÊÊÍgÄÍÊ^ÊSÍÀ
Stabilisci se le seguenti affermazioni sono
vere(V) o false(F).
Completa le frasi inserendo le parole
mancanti.
1. Gli elementi appartenenti allo stesso periodo
5. La tavola periodica moderna è organizzata in ……........…..
hanno lo stesso numero di elettroni esterni.
2. Gli elementi dei metalli alcalini posseggono
un elettrone nel livello più esterno.
3. Il neon è un gas nobile che possiede
8 elettroni nel livello più esterno.
4. Il terzo periodo della tavola periodica va
dal potassio allo zinco.
obiettivo
V F
V F
V F
verticali chiamate
e righe orizzontali
chiamate …….......................…...
6 La periodicità degli elementi è dovuta alle strutture
elettroniche
V F
…….......................…..
……...............................…..
…….......................…..
degli atomi che si
periodicamente.
3 LL’energia di ionizzazione
Conoscere l’esistenza dei
livelli energetici attraverso
l’andamento dei valori
dell’energia di ionizzazione
e i livelli energetici
In condizioni normali, come si è detto, l’atomo di ogni elemento è elettricamente
neutro in quanto il numero dei protoni contenuti nel nucleo è uguale a quello degli elettroni. È possibile tuttavia, fornendo una certa quantità di energia, vincere
l’attrazione elettrostatica del nucleo e allontanare uno o più elettroni. In tal modo
nel nucleo rimarranno uno o più protoni in eccesso che conferiranno all’atomo
una o più cariche positive.
Un atomo elettricamente carico viene definito ione; in questo caso, ione positivo o catione. Indicando con A un generico atomo e con A+ il suo corrispondente
ione positivo, il processo può essere così schematizzato:
A + energia –––––> A+ + e–
i g t c
unità c3 La tavola periodica degli elementi
x÷
–+
Nel caso del litio (Z = 3), lo schema può essere così rappresentato:
Li(g) +
Li+(g) +
energia
e-
Quando l’elettrone viene estratto dall’atomo neutro si parla di energia di prima
ionizzazione:
j`[\]`e`jZ\\e\i^`X[`gi`dX`fe`qqXq`fe\[`leXkfdfcË\e\i^`X
i`Z_`\jkXg\i\jkiXii\cË\c\kkife\g`\jk\ief[Xhl\ccËXkfdfXccf
jkXkf^Xjjfjf%
Se proviamo però a estrarre un secondo elettrone dallo ione prima ottenuto,
l’energia richiesta viene denominata energia di seconda ionizzazione:
A+ + energia –––––> A2+ + e–
Analogamente chiameremo energia di terza ionizzazione, quarta ionizzazione e
così via l’energia richiesta per rimuovere il terzo e il quarto elettrone rispettivamente.
Se rappresentiamo in un istogramma i valori dell’energia di prima ionizzazione,
relativa ai primi 20 elementi, cioè dall’idrogeno (Z = 1) al calcio (Z = 20) (Fig. 3),
possiamo trarre importanti considerazioni:
energia di ionizzazione
tra i primi due elementi, H (Z = 1) e He (Z = 2), si ha un notevole salto dei valori di energia di ionizzazione;
dal terzo elemento, Li (Z = 3), l’energia di ionizzazione cresce gradualmente
fino a raggiungere un valor massimo per il Ne (Z = 10);
per il sodio, Na (Z = 11), si osserva un valore di energia paragonabile a quello
del litio;
dal sodio in poi si ha ancora un graduale aumento dell’energia di ionizzazione,
fino a raggiungere un valore massimo per l’Ar (Z = 18), paragonabile a quello
del Ne (Z = 10);
per il K (Z = 19) e il Ca (Z = 20), i valori dell’energia di ionizzazione sono paragonabili a quelli di Na (Z = 11) e di Mg (Z = 12).
He
Ne
F
N
H
C
Be
Ar
O
Cl
P
Si
Mg
B
Li
S
Ca
Na
Al
K
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
19
20
numero atomico
=`^%+ @jkf^iXddX[\cc\
\e\i^`\[`gi`dX`fe`qqXq`fe\[\`
gi`d`)'\c\d\ek`%
L’andamento dei valori dell’energia, o potenziale, di prima ionizzazione, ci permette di ordinare i 20 elementi in tre blocchi ben distinti:
1° blocco che va dall’H all’He;
2° blocco che va dal Li al Ne;
3° blocco che va dal Na all’Ar.
(',
('-
modulo
c
i g t c
La struttura della materia
x÷
–+
È importante osservare come ciascun blocco inizia con un elemento a bassa energia di ionizzazione e si conclude con un gas nobile che presenta sempre un valore
massimo di energia di ionizzazione. Si osservi inoltre che ciascun blocco è costituito da otto elementi, a eccezione del primo che, invece, è costituito soltanto da due
elementi. Non è difficile scoprire allora che gli elementi di ciascun blocco sono
proprio quelli che nella tavola periodica appartengono a un periodo: il primo con
due elementi, il secondo e il terzo con otto elementi. L’analogia dei valori tra
elementi che si trovano nelle stesse posizioni nei vari blocchi (Li, Na, K; Be, Mg,
Ca ecc.) ci porta a scoprire i gruppi dove sono collocati gli elementi che hanno
proprietà chimiche analoghe.
Se estendiamo le misure delle energie di ionizzazione relative al 2°, al 3°, al 4°
e così via fino ad arrivare all’ultimo elettrone di uno stesso elemento, si possono
ottenere altre importanti informazioni. Esaminiamo, per esempio, le energie di
ionizzazione di tutti gli elettroni del sodio, così come riportato nella Tabella 3.
KXY%*<e\i^`\[``fe`qqXq`fe\[\cjf[`fbA&dfc
1ª
2ª
3ª
4ª
5ª
6ª
7ª
8ª
9ª
500
4600
6900
9500
13 300
16 600
20 100
25 500
28900
=`^%, ;`X^iXddX[\cc\
\e\i^`\[``fe`qqXq`fe\[\cjf[`f%
livello più
esterno
158 800
Energia
di ionizzazione
(kJ/mol)
141 300
28 900
4600
500
1a
2a
3a
4a
10ª
11ª
141 300 158800
Come si vede, tali energie presentano un andamento crescente in accordo con
il fatto che togliere successivamente elettroni da uno stesso atomo è sempre più
difficile, in quanto lo ione si va caricando sempre più positivamente.
Ciò che sorprende, però, è il notevole salto che si ha quando si passa dalla 1a alla
2a ionizzazione, e anche dalla 9a alla 10a, e questo è una conferma della disposizione a strati degli elettroni all’interno dell’atomo.
Scopriamo così che l’atomo di sodio organizza i suoi elettroni in tre livelli
(Fig. 5): quello più esterno contenente un solo elettrone (a cui compete una
energia di ionizzazione E.I. = 500 kJ/mol), quello intermedio che ne contiene
8 (con E.I. comprese tra 4600 e 28900 kJ/mol) e infine quello più prossimo al
nucleo, che ne contiene 2 (con E.I. dell’ordine di 150000 kJ/mol).
Il modello atomico a livelli appena descritto
livello
livello più
intermedio
interno
per il sodio può assumere validità generale
se misuriamo le E.I. di tutti gli elettroni appartenenti a tutti gli elementi. In tal modo è
possibile “contare” direttamente quanti elettroni si trovano attorno al nucleo e in che
modo sono distribuiti nei vari livelli.
Da tutte queste considerazioni possiamo
concludere che il modello atomico che Bohr
aveva ipotizzato è in perfetto accordo con i
dati dell’analisi delle energie di ionizzazione, che ne costituiscono una valida conferma sperimentale.
5a
6a
7a
8a
9a
10a 11a
Numero di ionizzazione
Clicca qui per eseguire
il test interattivo
-.!*ÊÊÍgÄÍÊ^ÊSÍÀ
Stabilisci
Stabilis
isci se le seguenti
nti affe
affermazioni sono vere(V) o false(F).
1. Il valore dell’energia di prima
ionizzazione è superiore a quello di seconda
ionizzazione.
2. L’energia di prima ionizzazione
si riferisce a un atomo neutro.
3. Il sodio possiede un valore di energia
V F
V F
di prima ionizzazione paragonabile a quella
dell’alluminio.
4. L’argon possiede un basso valore di energia
di ionizzazione.
V F
V F
i g t c
x÷
–+
obiettivo
4 LLe proprietà periodiche
Conoscere le proprietà
periodiche degli elementi
e prevederne l’andamento
sulla base della loro posizione
nella tavola periodica
unità c3 La tavola periodica degli elementi
Conosciamo ora alcune proprietà caratteristiche degli atomi, correlate direttamente alle loro configurazioni elettroniche esterne che, come abbiamo visto, si
ripetono periodicamente.
Raggio atomico e volume atomico
Con una certa approssimazione, come si è visto, gli atomi possono essere assimilati a delle minuscole sfere le cui dimensioni possono essere espresse in termini di
raggio atomico e, di conseguenza, di volume atomico. Il raggio atomico esprime la distanza tra il nucleo e l’elettrone più esterno ed è misurato in nanometri o in ångström (Å). Nella tavola periodica le dimensioni di un atomo variano
lungo un gruppo e lungo un periodo.
Scendendo lungo un gruppo, aumenta il numero quantico principale e di conseguenza il numero di livelli occupati dagli elettroni. In tal modo, gli elettroni del
livello più esterno si trovano sempre più distanti dal nucleo e sempre più schermati per la presenza dei livelli intermedi, e di conseguenza saranno meno attratti dal
nucleo. Pertanto:
`ciX^^`fXkfd`Zf#\[`Zfej\^l\eqX`cmfcld\#Xld\ekXefcle^fle
^ilggfgifZ\[\e[f[XccËXckfm\ijf`cYXjjf%
Lungo un periodo, invece, si ha un aumento del numero atomico, cioè del numero
di protoni, e quindi un aumento della carica positiva del nucleo. Gli elettroni che
via via si aggiungono hanno però lo stesso numero quantico principale e pertanto
si collocano nello stesso livello di energia. L’effetto che ne deriva è un aumento
dell’attrazione degli elettroni da parte del nucleo con conseguente riduzione del
raggio e contrazione del volume:
`ciX^^`fXkfd`Zf#\[`Zfej\^l\eqX`cmfcld\#[`d`el`jZfefcle^f
leg\i`f[fgifZ\[\e[f[Xj`e`jkiXm\ijf[\jkiX%
Decrescente
I
Crescente
H
=`^%- 8e[Xd\ekf
[\ccXmXi`Xq`fe\[\c
iX^^`fXkfd`Zf`ew
XccË`ek\ief[\`^ilgg`
\XccË`ek\ief[\`
g\i`f[`%
0,3
II
III
IV
V
VI
VII
Li
Be
B
C
N
O
F
1,52
1,11
0,88
0,77
0,70
0,66
0,64
Na
Mg
Al
Si
P
S
Cl
1,86
1,60
1,43
1,17
1,10
1,04
0,99
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
2,31
1,97
1,60
1,46
1,31
1,25
1,29
1,26
1,25
1,24
1,28
1,33
1,22
1,22
1,21
1,17
1,14
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
2,44
2,15
1,80
1,57
1,41
1,36
1,32
1,33
1,34
1,38
1,44
1,49
1,62
1,40
1,41
1,37
1,33
Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
At
2,62
2,17
1,88
1,57
1,43
1,37
1,37
1,34
1,35
1,38
1,44
1,50
1,71
1,75
1,46
1,4
1,4
Fr
Ra
Ac
2,7
2,20
2,0
Elementi di transizione
('.
modulo
c
i g t c
La struttura della materia
x÷
–+
Andamento dell’energia di ionizzazione
L’energia di ionizzazione è una proprietà periodica particolarmente importante
in quanto, come si è detto, è strettamente legata alla configurazione elettronica.
Vediamo qual è il suo andamento nella tavola periodica.
Scendendo lungo un gruppo, l’elettrone da rimuovere si trova su livelli di energia
sempre più esterni e quindi sarà sempre meno attratto dal nucleo.
Pertanto:
cË\e\i^`X[``fe`qqXq`fe\[`d`el`jZ\cle^fle^ilggfgifZ\[\e[f
[XccËXckfm\ijf`cYXjjf%
All’interno di un periodo, invece, procedendo da sinistra verso destra, l’elettrone
da rimuovere sarà sempre più attratto dal nucleo perché, con l’aumentare del
numero atomico, aumenta la carica nucleare.
Pertanto:
cË\e\i^`X[``fe`qqXq`fe\Xld\ekXcle^fleg\i`f[fgifZ\[\e[f
[Xj`e`jkiXm\ijf[\jkiX%
crescente
H
decrescente
('/
=`^%. 8e[Xd\ekf[\ccË\e\i^`X
[``fe`qqXq`fe\%
He
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
At
Rn
Fr
Ra
Ac
Th
Pa
U
Np-Lr
Affinità elettronica e suo andamento
Abbiamo visto che per allontanare uno o più elettroni da un atomo neutro è
necessario fornire energia. Si avrà invece cessione di energia quando un atomo
acquista uno o più elettroni.
Tale processo può essere così schematizzato:
A + e– –––––> A– + energia
dove con A– è indicato lo ione negativo o anione.
Pertanto:
j`[\]`e`jZ\X]]`e`k~\c\kkife`ZXcXhlXek`k~[`\e\i^`XZ\[lkX
hlXe[fleXkfdfe\lkifXccfjkXkf^XjjfjfXZhl`jkXle\c\kkife\%
Analogamente al catione, l’anione è un atomo elettricamente carico, ma di carica
negativa. Il nuovo elettrone, infatti, non potendo essere neutralizzato da un corrispondente protone del nucleo, conferisce all’intero atomo una carica unitaria
negativa.
Anche per l’affinità elettronica valgono le stesse considerazioni fatte per il potenziale di ionizzazione. L’elettrone acquistato, infatti, va a collocarsi sempre nel
livello più esterno e quindi lungo un gruppo, allontanandosi dal nucleo, sarà sempre meno attratto, mentre lungo un periodo, con l’aumento della carica nucleare,
sarà sempre più attratto.
i g t c
unità c3 La tavola periodica degli elementi
x÷
–+
Pertanto:
cËX]]`e`k~\c\kkife`ZX[`d`el`jZ\cle^fle^ilggfgifZ\[\e[f
[XccËXckfm\ijf`cYXjjf#d\eki\Xld\ekXcle^fleg\i`f[f#
gifZ\[\e[f[Xj`e`jkiXm\ijf[\jkiX%
crescente
decrescente
H
=`^%/ 8e[Xd\ekf[\ccËX]]`e`k~
\c\kkife`ZX%
He
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
At
Rn
Fr
Ra
Ac
Th
Pa
U
Np-Lr
Andamento dell’elettronegatività
L’energia di ionizzazione e l’affinità elettronica sono, come si è visto, grandezze
che indicano la tendenza che ha ogni atomo a perdere o acquistare elettroni e
da esse si può prevedere il comportamento chimico degli elementi che, come si è
detto più volte, dipende dagli elettroni esterni.
Tali proprietà, per una più immediata lettura della tavola periodica, sono state
correlate insieme in un’unica proprietà molto usata in chimica: l’elettronegatività.
Per la sua misura L. Pauling ha proposto una scala arbitraria che assegna il valore
più elevato (4) al fluoro, e quello più basso (0,7) al francio e valori intermedi a tutti
gli altri elementi. Tali valori indicano la capacità che ha l’atomo di un elemento
di attrarre gli elettroni che condivide con l’atomo di un altro elemento quando si
trovano legati.
Una più completa comprensione di tale proprietà si avrà dopo aver studiato il
legame chimico, nel prossimo modulo.
Anche l’elettronegatività è ovviamente una proprietà periodica che, come il potenziale di ionizzazione e l’affinità elettronica, diminuisce lungo un gruppo e
cresce lungo un periodo.
crescente
H
He
2,1
decrescente
=`^%0 8e[Xd\ekf
[\ccË\c\kkife\^Xk`m`k~%
-
Be
B
C
N
O
F
1,0
1,5
2,0
2,5
3,0
3,5
4,0
-
Na
Mg
Al
Si
P
S
Cl
Ar
Li
0,9
1,2
K
Ca
Sc
Ti
0,8
1,0
1,3
1,5
Rb
Sr
Y
Zr
Cr
Mn
1,6
1,6
1,5
1,8
1,8
1,8
Nb
Mo
Tc
Ru
Rh
Pd
V
Fe
Co
Ni
Ne
1,5
1,8
2,1
2,5
3,0
-
Zn
Ga
Ge
As
Se
Br
Kr
1,9
1,6
1,6
1,8
2,0
2,4
2,8
-
Ag
Cd
In
Sn
Sb
Te
I
Xe
Cu
0,8
1,0
1,2
1,4
1,6
1,8
1,9
2,2
2,2
2,2
1,9
1,7
1,7
1,8
1,9
2,1
2,5
-
Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
At
Rn
0,7
0,9
1,1-1,2
1,3
1,5
1,7
1,9
2,2
2,2
2,2
2,4
1,9
1,8
1,8
1,9
2,0
2,2
-
Fr
Ra
Ac
Th
Pa
U
Np-Lr
0,7
0,9
1,1
1,3
1,5
1,7
1,3
('0
modulo
o
c
i g t c
La struttura della materia
x÷
–+
Metalli e non metalli
Un primo tentativo di classificazione degli elementi è stato già descritto precedentemente. Esso si basava fondamentalmente sulle caratteristiche fisiche.
Dopo aver studiato la struttura elettronica possiamo notare che gli elementi denominati metalli sono quelli che posseggono basse energie di ionizzazione, basse
affinità elettroniche e di conseguenza basse elettronegatività, e che quindi presentano spiccata tendenza a cedere elettroni. Essi sono normalmente localizzati nella
parte sinistra o in basso della tavola periodica.
I non metalli, viceversa, sono quelli che
presentano spiccata tendenza ad acquistare
elettroni, cioè quelli che hanno alta affinità
elettronica e alto potenziale di ionizzazione, e di conseguenza alto valore di elettronegatività; essi sono collocati a destra della
tavola periodica.
I semimetalli, infine, sono ovviamente gli
elementi che presentano valori intermedi di
tali grandezze e, di conseguenza, caratteristiche intermedie.
=`^%(' :i`jkXccf[`qfc]f
eXk`mf#leefed\kXccf%
crescente
proprietà metalliche
Li
Be
B
C
N
O
F
Ne
Na
Mg
Al
Si
P
S
Cl
Ar
K
Ca
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
Ga
Ge
As
Se
Br
Kr
Rb
Sr
Y
Zr
Nb
Mo
Tc
Ru
Rh
Pd
Ag
Cd
In
Sn
Sb
Te
I
Xe
Cs
Ba
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
Tl
Pb
Bi
Po
At
Rn
Fr
Ra
Ac
Th
Pa
U
=`^%(( 8e[Xd\ekf[\cc\
gifgi`\k~d\kXcc`Z_\\efe
d\kXcc`Z_\%
Np-Lr
crescente
proprietà non metalliche
-.!*ÊÊÍgÄÍÊ^ÊSÍÀ
Completa le frasi inserendo le parole mancanti.
1. Procedendo lungo un periodo il raggio atomico, e di
3. L’energia di ionizzazione
…….............................…..
lungo
conseguenza il
…….................
atomico,
…….........................
un gruppo procedendo dall’ …….............................….. verso
a causa della
…….......…....................…..
attrazione degli
il ……....................…...
elettroni da parte del nucleo.
2. L’elettronegatività ……....................….. lungo un gruppo e
……....................…..
lungo un periodo.
4. L’affinità elettronica è la quantità di energia ……...............
quando un atomo neutro gassoso …….............................…..
un elettrone.
Clicca qui per aprire
la sintesi dei concetti
principali
crescente
He
proprietà non metalliche
crescente
H
proprietà metalliche
(('