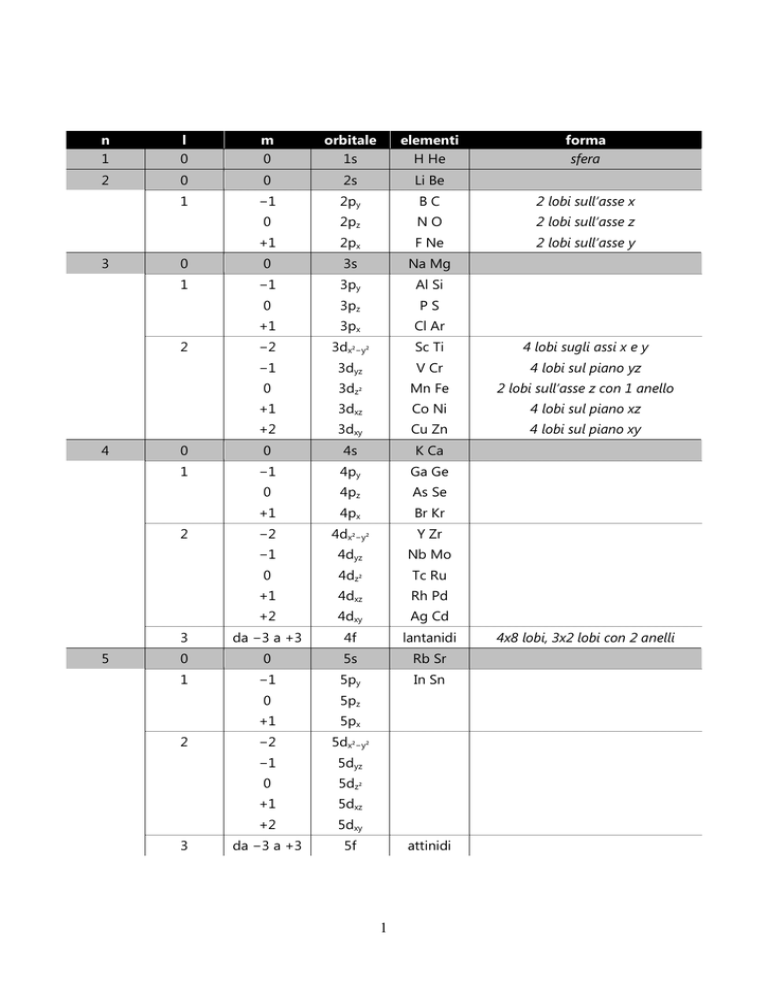
n
1
l
0
m
0
orbitale
1s
elementi
H He
2
0
0
2s
Li Be
1
−1
2py
BC
2 lobi sull’asse x
0
2pz
NO
2 lobi sull’asse z
+1
2px
F Ne
2 lobi sull’asse y
0
0
3s
Na Mg
1
−1
3py
Al Si
0
3pz
PS
+1
3px
Cl Ar
−2
3dx²−y²
Sc Ti
4 lobi sugli assi x e y
−1
3dyz
V Cr
4 lobi sul piano yz
0
3dz²
Mn Fe
2 lobi sull’asse z con 1 anello
+1
3dxz
Co Ni
4 lobi sul piano xz
+2
3dxy
Cu Zn
4 lobi sul piano xy
0
0
4s
K Ca
1
−1
4py
Ga Ge
0
4pz
As Se
+1
4px
Br Kr
−2
4dx²−y²
Y Zr
−1
4dyz
Nb Mo
0
4dz²
Tc Ru
+1
4dxz
Rh Pd
+2
4dxy
Ag Cd
3
da −3 a +3
4f
lantanidi
0
0
5s
Rb Sr
1
−1
5py
In Sn
0
5pz
+1
5px
−2
5dx²−y²
−1
5dyz
0
5dz²
+1
5dxz
+2
5dxy
da −3 a +3
5f
3
2
4
2
5
2
3
attinidi
1
forma
sfera
4x8 lobi, 3x2 lobi con 2 anelli
Nomenclatura inorganica
Nome tradizionale
Composto da
Esempi
ossido basico (ossido)
ossido di
MeO
Na2O, Fe2O3, MgO
perossido
perossido di
MeO2
CaO2, H2O2, Na2O2
idruro
idruro di
MeH
KH, NH3, CaH2, FeH2
idrossido
idrossido di
Me(OH)
KOH, Fe(OH)3, Mg(OH)2, CaOH
sale basico
-uro basico di
Me(OH)X
Ca(OH)Cl, Na2(OH)Cl, Bi(OH)Cl2
ossido acido (anidride)
anidride -osa/-ica
XO
N2O5, SO3, CO2, P2O5
idracido
acido -idrico
HX
HCl, H2S, HF
ossoacido
acido -oso/-ico
HXO
H3PO4, H2CO3, H2Cr2O7, H2SO3
da ossoacido
-ato/-ito di
Me(XO)
Na2SO4, Na3PO4, Fe(NO2)2
da idracido
-uro di
MeX
NaCl, CaF2, MgS, NH4Cl
sale acido
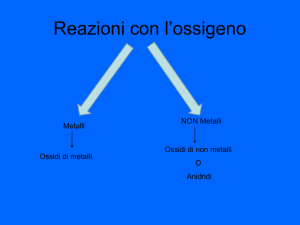
metallo + O2 → ossido + H2O → idrossido → ione -oso/-ico + non metallo → sale basico + H2O
non metallo + O2 → anidride + H2O → ossoacido → ione -ato/-ito + metallo → sale acido + H2O
idracido + metallo → sale acido → ione -uro
Elemento
O
F
C
Si
Sn
Pb
N° ossidaz.
−2
−1
Composti
−1
HF (acido fluoridrico)
+2
+4
+4
+2
+4
+2
+4
CO (ossido di carbonio)
CO2 (anidride carbonica)
SiO2 (silice)
SnO (ossido stannoso)
SnO2 (ossido stannico)
PbO (ossido piomboso)
PbO2 (ossido piombico)
Elemento
H
perossidi
Fe
Cu
Zn
P
S
2
N° ossidaz.
+1
−1
Composti
+2
+3
+1
+2
+2
+3
+5
+4
+6
FeO (ossido ferroso)
Fe2O3 (ossido ferrico)
Cu2O (ossido rameoso)
CuO (ossido rameico)
ZnO (ossido di zinco)
P4O6 (anidride fosforosa)
P2O5 (anidride fosforica)
SO2 (anidride solforosa)
SO3 (anidride solforica)
idruri
Elemento
N
Cr
Mn
Li, Na, K (gruppo 1)
Be, Mg, Ca (gruppo 2)
B, Al (gruppo 3)
Cl, Br, I (gruppo 7)
Numeri di ossidazione
+1
+2
+4
+4
+3
+5
+2
+3
+6
+2
+3
+4
+6
+7
+1
+2
+3
−1
+1
+3
+5
+7
Composti
ossidi
anidridi
ossidi
anidridi
ossidi
anidridi
anidridi
3
Esempi
N2O (protossido di azoto)
NO (monossido di azoto)
NO2 (diossido di azoto)
N2O4 (ipoazotide)
N2O3 (anidride nitrosa)
N2O5 (anidride nitrica)
CrO (ossido cromoso)
Cr2O3 (ossido cromico)
CrO3 (anidride cromica)
MnO (ossido manganoso)
Mn2O3 (ossido manganico)
MnO2 (diossido di manganese)
MnO3 (anidride manganica)
Mn2O7 (anidride permanganica)
Cl2O (anidride ipoclorosa)
Cl2O3 (anidride clorosa)
Cl2O5 (anidride clorica)
Cl2O7 (anidride perclorica)
Solidi metallici (ioni positivi con nuvola elettronica)
Raggio
Numero di
Numero di
atomico
coordinazione
atomi per cella
Tipo di cella
elementare
cubica primitiva
cubica a corpo centrato
cubica a
facce centrate
compatta
cubica primitiva
1
52%
Po
√
8
2
68%
Fe-α, Cr, Na
√
12
4
12
6
cubica a
facce centrate
Solidi ionici (ioni negativi e positivi)
Disposizione
Numero di
coordinazione
cationi (+, più piccoli)
anioni (−, più grandi)
8 anioni ai vertici
4 anioni ai vertici,
6 anioni al centro
delle facce
Esempi di
solidi metallici
6
esagonale (prisma)
Tipo di cella
elementare
Coefficiente di
impaccamento
1 catione al centro
8
13 cationi negli
interstizi ottaedrici
6
8 cationi negli
interstizi tetraedrici
4 anione-cationi,
8 catione-anioni (?)
4 cationi alternati negli
interstizi tetraedrici
74%
Fe-γ (900° C),
Ag, Al, Cu
Ti, Mg, Be
Numero di
atomi per cella
1 anione
4 anioni
Esempi di
solidi ionici
1 catione
CsCl → Cs+ + Cl−
4 cationi
NaCl → Na+ + Cl−
Ca2F → Ca++ + F−
ZnS → Zn++ + S−−
4
Celle voltaiche
Soluzione
Reazioni
accumulatore alcalino al ferro-nichel
accumulatore alcalino al nichel-cadmio
ΔV
Fe(s) + 2NiOOH(s) + 2H2O ↔ Fe(OH)2 + 2Ni(OH)2
KOH
(−) Fe(s) + 2OH− ↔ Fe(OH)2 + 2e−
(+) 2NiOOH(s) + 2H2O + 2e− ↔ 2Ni(OH)2 + 2OH−
1,3 V
Pb(s) + PbO2 + 2H2SO4 ↔ 2PbSO4(s) + 2H2O
accumulatore acido al piombo
pila Leclanché zinco-carbone
H2SO4
(−) Pb(s) + HSO4− ↔ PbSO4(s) + H+ + 2e−
(+) PbO2 + 3H+ + HSO4− + 2e− ↔ PbSO4(s) + 2H2O
KOH
Zn(s) + 2MnO2 + 2H2O → Zn(OH)2 + 2MnOOH
NH4Cl
(−) Zn(s) → Zn2+ + 2e−
(+) 2MnO2 + 2H2O + 2e− → 2MnOOH + 2OH−
batteria al litio
2,2 V
1,55 V
3V
5