I nomi dei composti chimici
La valenza indica il numero di legami chimici
che un elemento è capace di formare
(oppure il numero di atomi di H che un
atomo può legare).
• Il numero di ossidazione (n.o.)
• Il numero di ossidazione di un atomo in un
composto indica la carica che l’atomo
assumerebbe se gli elettroni di legame fossero
assegnati all’atomo più elettronegativo.
• Il n.o. varia da +8 (Os e Ru; RuO4 e OsO4)
a –4 (C; CH4).
• Il n.o. di un elemento non supera mai il
numero del gruppo a cui appartiene, fanno
eccezione Cu, Ag e Au.
• Regole per assegnare il numero di
ossidazione
• Gli atomi nelle sostanze allo stato elementare
(cioè non legati con atomi diversi), siano esse
mono-, bi-, o poliatomiche, hanno n.o. zero
(es. He, Ca,
O2, Cl2, P4).
• L'ossigeno nei composti ha n.o.=−2.
Fanno eccezione i perossidi (per es. H2O2)
dove l'ossigeno ha n.o.= −1.
• L'idrogeno nei composti ha n.o.=+1.
Fanno eccezione gli idruri metallici (per
esempio, LiH, CaH2) nei quali l'idrogeno
assume n.o. = −1.
• Il fluoro in tutti i composti ha n.o. = −1.
• Gli elementi del gruppo I A; II A e III A nei loro
composti hanno rispettivamente n.o. = +1, +2
e +3.
• Il numero di ossidazione di altri elementi
presenti in un composto si calcola ricordando
che la somma algebrica dei n.o. di tutti gli
atomi in una molecola deve essere zero,
oppure, se si tratta di uno ione, deve essere
uguale alla sua carica.
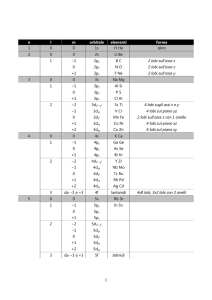
• COMPOSTI BINARI CON OSSIGENO
• Gli ossidi (o ossidi basici) sono composti binari
ottenuti facendo reagire un metallo con O2:
Me + O2 Ossidi
4 Na
+
+1 -2
O2 2 Na2O1
Nome Tradizionale: Ossido di sodio
Nome IUPAC:
Ossido di sodio
La nomenclatura tradizionale
• è basata sulla distinzione tra metalli e non
metalli, da cui derivano gli ossidi e le anidridi,
denominati medianti prefissi e suffissi che
tengono conto dello stato di ossidazione
dell’elemento. Differentemente dalle regole
IUPAC per scrivere la formula dei composti
nella nomenclatura tradizionale occorre
ricordare il n.o. degli elementi.
Nomenclatura IUPAC
• Il nome secondo la nomenclatura IUPAC (o
sistemica attuale) fa distinzione se il
composto è ionico o covalente.
Per i composti covalenti.
• La nomenclatura IUPAC indica come ossidi i
composti binari ottenuti combinando
elementi metallici o non metallici con
l'ossigeno. In questi composti l'ossigeno ha
sempre n. o. = -2. Il nome si ottiene facendo
seguire all’espressione “ossido di” il nome
dell’elemento legato all’ossigeno.
• Il numero di atomi di ciascun elemento
presente nella formula è indicato con dei
prefissi.
Numero di
atomi
1
2
3
4
5
Prefisso
mono
di
tri
tetra
penta
Numero di
atomi
(si può omettere)
6
7
8
9
10
Prefisso
esa
epta
otta
nona
deca
Simbolo
Nome
Elemento
Radice del
nome
Simbolo
Nome
Elemento
Radice del
nome
S
Zolfo
solf-
F
Fluoro
fluor-
H
Idrogeno
idr-
Cl
Cloro
clor-
C
Carbonio
carb-
P
fosforo
fosf-
I
Iodio
iod-
Au
Oro
aur-
brom-
Sn
Stagno
Br
Bromo
stann-
• Se il composto è ionico si segue il metodo
Stock.
• il nome si ricava scrivendo prima la radice del
nome dell’elemento più elettronegativo, con
la desinenza –uro, facendo seguire al nome
del metallo, senza spaziatura, un numero
romano che ne indichi lo stato di ossidazione.
2 Ca +
O2 2 CaO
Nome tradizione:
Nome IUPAC:
+2 -2
Ossido di Calcio
Ossido di Calcio
+3 -2
4 Al + 3 O2 2 Al2 O 3
Nome tradizione:
Nome IUPAC:
Ossido di Alluminio
Ossido di Alluminio
2 Fe +
O2 2 FeO
Nome tradizione:
Nome IUPAC:
+2 -2
Ossido Ferroso
Ossido di Ferro(II)
+3 -2
4 Fe + 3 O2 2 Fe2 O3
Nome tradizione:
Nome IUPAC:
Ossido ferrico
Ossido di Ferro(III)
+2 -2
O2 2 CuO
2 Cu +
Nome tradizione:
Nome IUPAC:
Ossido Rameico
Ossido di Rame(II)
+1 -2
4 Cu +
O2 2 Cu2 O
Nome tradizione:
Nome IUPAC:
Ossido Rameoso
Ossido di Rame(I)
Le anidridi (o ossidi acidi)
• Si ottengono facendo reagire un non metallo
con l’ossigeno.
nonMe + O2 Anidridi
• Per i nomi delle anidride valgono le seguenti
regole:
• 1) se il non metallo ha un solo n.o., il nome
anidride è seguito dalla radice del nome del
non metallo con la desinenza ica;
• 2) Se il non metallo forma più anidridi con un
diverso n.o. si utilizzano le denominazioni
elencate nella tabella.
n. o.
+1
Nome
Anidride ipo-(radice del nome del nonmetallo)-osa
+3 o +4 Anidride (radice del nome del non-metallo)osa
+5 o +6 Anidride (radice del nome del non-metallo)ica
+7
Anidride per-(radice del nome del nonmetallo)-ica
S +
O2
Nome tradizione:
Nome IUPAC:
Nome IUPAC:
S2 O242
Anidride Solforosa
Diossido di zolfo
2 S + 3 O2
Nome tradizione:
+4 -2
+6 -2
2 S O3
Anidride Solforica
Triossido di Zolfo
+5 -2
4 P + 5 O2 2 P2 O5
Nome tradizione:
Nome IUPAC:
Anidride Fosforica
Pentossido di difosforo
4 P + 3 O2
Nome tradizione:
Nome IUPAC:
+3 -2
2 P2 O3
Anidride Fosforosa
Triossido di difosforo
• Nei composti dell’azoto in cui esso presenta
n.o. = +1, +2, +3, +4, +5, vengono
rispettivamente indicati:
• protossido di azoto (N2O),
• ossido di azoto (NO),
• anidride nitrosa (N2O3),
• ipoazotide (N2O4),
• anidride nitrica (N2O5).
• Inoltre alcuni elementi come il cromo e il
manganese, si comportano come metalli nei
composti in cui hanno il numero di
ossidazione più basso (+2, +3) (carattere
ionico), e come non-metalli in cui il n. o. è più
alto (+6, +7) (carattere covalente).
2 Cl2 +
+1 -2
O2 2 Cl2O
Anidride ipoclorosa
Ossido di dicloro
+3 -2
Anidride ipoclorosa
Triossido di dicloro
+5 -2
Anidride ipoclorosa
Pentossido di dicloro
+7 -2
Anidride ipoclorosa
Eptossido di dicloro
2 Cl2 + 3 O2 2 Cl2O3
2 Cl2 + 5 O2 2 Cl2O5
2 Cl2 + 7 O2 2 Cl2O7
MnO
Mn2O3
MnO2
MnO3
Mn2O7
Nome
tradizionale
Nome sistematico
attuale
Ossido
manganoso
Ossido
Manganico
Biossido di
manganese
Anidride
manganica
Anidride
permanganica
Ossido di
manganese(II)
Ossido di
manganese(III)
Ossidodi
manganese(IV)
Triossido di
manganese
Eptaossido di
dimanganese