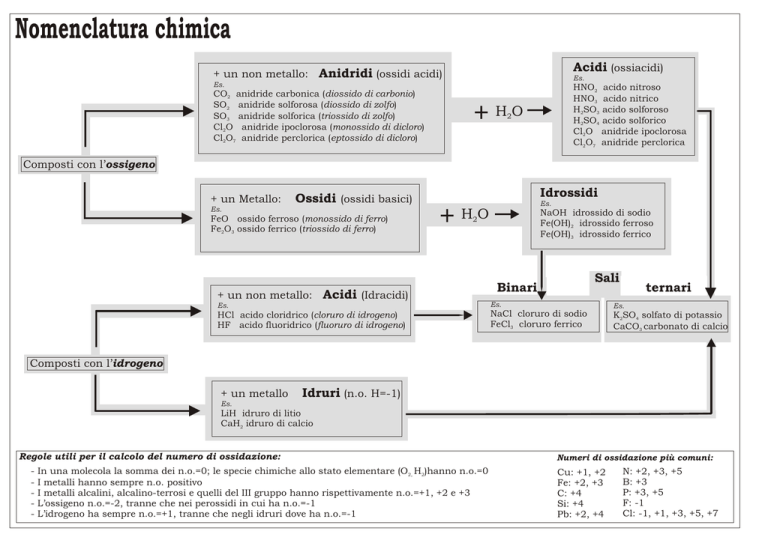
Nomenclatura chimica
Acidi (ossiacidi)
+ un non metallo: Anidridi (ossidi acidi)
Es.
Es.
CO2 anidride carbonica (diossido di carbonio)
SO2 anidride solforosa (diossido di zolfo)
SO3 anidride solforica (triossido di zolfo)
Cl2O anidride ipoclorosa (monossido di dicloro)
Cl2O7 anidride perclorica (eptossido di dicloro)
HNO2 acido nitroso
HNO3 acido nitrico
H2SO3 acido solforoso
H2SO4 acido solforico
Cl2O anidride ipoclorosa
Cl2O7 anidride perclorica
+HO
2
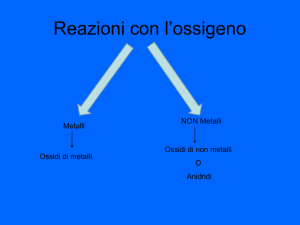
Composti con l’ossigeno
+ un Metallo:
Idrossidi
Ossidi (ossidi basici)
Es.
FeO ossido ferroso (monossido di ferro)
Fe2O3 ossido ferrico (triossido di ferro)
Es.
+HO
NaOH idrossido di sodio
Fe(OH)2 idrossido ferroso
Fe(OH)3 idrossido ferrico
2
+ un non metallo: Acidi (Idracidi)
Sali
Binari
ternari
Es.
Es.
Es.
HCl acido cloridrico (cloruro di idrogeno)
HF acido fluoridrico (fluoruro di idrogeno)
NaCl cloruro di sodio
FeCl3 cloruro ferrico
K2SO4 solfato di potassio
CaCO3 carbonato di calcio
Composti con l’idrogeno
+ un metallo
Idruri (n.o. H=-1)
Es.
LiH idruro di litio
CaH2 idruro di calcio
Regole utili per il calcolo del numero di ossidazione:
-
In una molecola la somma dei n.o.=0; le specie chimiche allo stato elementare (O2, H2)hanno n.o.=0
I metalli hanno sempre n.o. positivo
I metalli alcalini, alcalino-terrosi e quelli del III gruppo hanno rispettivamente n.o.=+1, +2 e +3
L’ossigeno n.o.=-2, tranne che nei perossidi in cui ha n.o.=-1
L’idrogeno ha sempre n.o.=+1, tranne che negli idruri dove ha n.o.=-1
Numeri di ossidazione più comuni:
Cu: +1, +2
Fe: +2, +3
C: +4
Si: +4
Pb: +2, +4
N: +2, +3, +5
B: +3
P: +3, +5
F: -1
Cl: -1, +1, +3, +5, +7