NOMENCLATURA E REAZIONI
Gli elementi chimici si dividono in:
METALLI e NON METALLI
I METALLI, perdendo elettroni, originano IONI POSITIVI
(o CATIONI)
I NON METALLI, acquistando elettroni, originano IONI
NEGATIVI (o ANIONI)
OSSIDI XmOn
a) OSSIDI BASICI ( X = METALLO )
b) OSSIDI ACIDI = ANIDRIDI ( X = non METALLO )
Esempi di ossidi basici
Na2O
BaO
Al2O3
TiO2
Cu2O
CuO
FeO
Fe2O3
SnO
SnO2
MnO
MnO2
Cr2O3
Ossido di Sodio (Na +1)
Ossido di Bario (Ba +2)
Ossido di Alluminio (Al +3)
Ossido di Titanio (Ti +4)
Ossido Rameoso (Cu +1)
Ossido Rameico (Cu +2)
Ossido Ferroso (Fe +2)
Ossido Ferrico (Fe +3)
Ossido Stannoso (Sn +2)
Ossido Stannico (Sn +4)
Ossido Manganoso (Mn +2)
Ossido Manganico (Mn +4)
Ossido Cromico (Cr +3)
Esempi di ossidi acidi
CO2
B2O3
SO2
SO3
N2O3
N2O5
P2O3
P2O5
Cl2O
Cl2O3
Cl2O5
Cl2O7
CrO3
MnO3
Mn2O7
Anidride Carbonica (C +4)
Anidride Borica (B +3)
Anidride Solforosa (S +4)
Anidride Solforica (S +6)
Anidride Nitrosa (N +3)
Anidride Nitrica (N +5)
Anidride Fosforosa (P +3)
Anidride Fosforica (P +5)
Anidride Ipoclorosa (Cl +1)
Anidride Clorosa (Cl +3)
Anidride Clorica (Cl +5)
Anidride Perclorica (Cl +7)
Anidride Cromica (Cr +6)
Anidride Manganica (Mn +6)
Anidride Permanganica (Mn +7)
NOMENCLATURA I.U.P.A.C.
ClO2
ClO3
N2O
NO
NO2
Cu2O
CuO
CrO
Cr2O3
CrO2
MnO
MnO2
CrO3
MnO3
Mn2O7
Diossido di Cloro (Cl +4)
Triossido di Cloro (Cl +6)
Ossido di diAzoto (N +1)
Ossido di Azoto (N +2)
Diossido di Azoto (N +4)
Ossido di diRame (Cu +1)
Ossido di Rame (Cu +2)
Ossido di Cromo (Cr +2)
Triossido di diCromo (Cr +3)
Diossido di Cromo (Cr +4)
Ossido di Manganese (Mn +2)
Diossido di Manganese (Mn +4)
Triossido di Cromo (Cr +6)
Triossido di Manganese (Mn +6)
Eptossido di diManganese (Mn +7)
PEROSSIDI XmOn
(-O-O-)
X = METALLO
Esempi di perossidi
H2O2
Na2O2
BaO2
Perossido di Idrogeno (H +1)
Perossido di Sodio (Na +1)
Perossido di Bario (Ba +2)
IDROSSIDI o BASI X(OH)m
X = METALLO
OH = OSSIDRILE (n.o.-1)
OSSIDO BASICO + H2O IDROSSIDO
Esempi di idrossidi
KOH
Ca(OH)2
NH4OH
Al(OH)3
Fe(OH)2
Fe(OH)3
Cr(OH)3
Mn(OH)2
Idrossido di Potassio (K +1)
Idrossido di Calcio (Ca +2)
Idrossido di Ammonio (NH4+)
Idrossido di Alluminio (Al +3)
Idrossido Ferroso (Fe +2)
Idrossido Ferrico (Fe +3)
Idrossido Cromico (Cr +3)
Idrossido Manganoso (Mn +2)
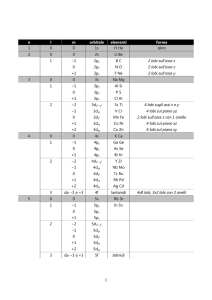
ACIDI
a) IDRACIDI
b) OSSIACIDI
HmXn
HmXnOz
X = non metallo
m = 1 = acido monoprotico
se m > 1 = acido poliprotico
tutti gli H sono sostituibili da metalli
ANIDRIDE + H2O OSSIACIDO
Esempi di ossiacidi
CO2
N2O3
N2O5
SO2
SO3
Cl2O
Cl2O3
Cl2O5
Cl2O7
B2O3
P2O5
CrO3
CrO3
MnO3
Mn2O7
H2CO3
HNO2
HNO3
H2SO3
H2SO4
HClO
HClO2
HClO3
HClO4
H3BO3
H3PO4
H2CrO4
H2Cr2O7
H2MnO4
HMnO4
(C +4)
(N +3)
(N +5)
(S +4)
(S +6)
(Cl +1)
(Cl +3)
(Cl +5)
(Cl +7)
(B +3)
(P +5)
(Cr +6)
(Cr +6)
(Mn +6)
(Mn +7)
Esempi di idracidi
HF
HCl
HBr
HI
H2S
HCN
Acido Fluoridrico (F -1)
Acido Cloridrico (Cl -1)
Acido Bromidrico (Br -1)
Acido Iodidrico (I -1)
Acido Solfidrico (S -2)
Acido Cianidrico (CN-)
A. Carbonico
A. Nitroso
A. Nitrico
A. Solforoso
A. Solforico
A. Ipocloroso
A. Cloroso
A. Clorico
A. Perclorico
A. Borico
A. Fosforico
A. Cromico
A. Dicromico
A. Manganico
A. Permanganico
SALI
a)
b)
c)
d)
e)
MemXn
MemXnOz
NEUTRI
ACIDI (contenenti nella formula atomi di H acido)
BASICI (contenenti nella formula gruppi OH)
DOPPI (contenenti nella formula più di un Me)
IDRATI (contenenti nella formula molecole di H2O)
Suffisso ACIDO
Suffisso SALE
-OSO
-ICO
-IDRICO
-ITO
-ATO
-URO
Esempi di sali neutri
KClO
CaSO3
Ba(ClO3)2
Na2SO4
Fe(NO3)3
AlPO4
Cu2CO3
Li3BO3
Fe(ClO2)2
NaCl
SnBr2
Cu(CN)2
ZnS
NH4F
Fe2S3
Na2MnO4
KMnO4
K2CrO4
Na2Cr2O7
Ipoclorito di Potassio (Cl +1)
Solfito di Calcio (S +4)
Clorato di Bario (Cl +5)
Solfato di Sodio (S +6)
Nitrato Ferrico (N +5, Fe +3)
Fosfato di Alluminio (P +5)
Carbonato Rameoso (C +4, Cu +1)
Borato di Litio (B +3)
Clorito Ferroso (Cl +3, Fe +2)
Cloruro di Sodio (Cl -1)
Bromuro Stannoso (Br –1, Sn +2)
Cianuro Rameico (CN-, Cu +2)
Solfuro di Zinco (S -2)
Fluoruro di Ammonio (F -1)
Solfuro Ferrico (S –2, Fe +3)
Manganato di Sodio (Mn +6)
Permanganato di Potassio (Mn +7)
Cromato di Potassio (Cr +6)
Dicromato di Sodio (Cr +6)
Esempi di sali acidi
NaHSO4
K2HPO4
KH2PO4
Ba(HCO3)2
NH4HS
Solfato ACIDO di Sodio (S +6)
Fosfato MONOACIDO di Potassio (P +5)
Fosfato BIACIDO di Potassio (P +5)
Carbonato ACIDO di Bario (C +4)
Solfuro ACIDO di Ammonio (S -2)
Esempi di sali basici
Bi(OH)(NO3)2
Pb2(OH)2SO3
Cu2(OH)2CO3
Zn2(OH)PO4
Bi(OH)S
Nitrato BASICO di Bismuto (N +5, Bi +3)
Solfito BIBASICO di Piombo (S +4, Pb +2)
Carbonato BIBASICO di Rame (C +4, Cu +2)
Fosfato BASICO di Zinco (P +5)
Solfuro BASICO di Bismuto (S –2, Bi +3)
Esempi di sali doppi
K(NH4)SO4
Na2Ca(CO3)2
LiMgPO4
NaKS
Solfato di Potassio e Ammonio (S +6)
Carbonato di Sodio e Calcio (C +4)
Fosfato di Litio e Magnesio (P +5)
Solfuro di Sodio e Potassio (S -2)
Esempi di sali idrati
AlPO4 2H2O
MgCO3 3H2O
Ca(NO3)2 4H2O
CuSO4 5H2O
Fosfato di Alluminio BIIDRATO
Carbonato di Magnesio TRIIDRATO
Nitrato di Calcio TETRAIDRATO
Solfato Rameico PENTAIDRATO
REAZIONI NON DI OSSIDORIDUZIONE
Esempio di bilanciamento
BaCl2 + Al2(SO4)3 BaSO4 + AlCl3
a) BaCl2 + Al2(SO4)3 BaSO4 +
2
b)
3
BaCl2 + Al2(SO4)3 BaSO4 +
c)
3
BaCl2 + Al2(SO4)3
3
AlCl3
2
BaSO4 +
AlCl3
2
AlCl3
3 BaCl2 + Al2(SO4)3 3 BaSO4 + 2 AlCl3
REAZIONI DI OSSIDORIDUZIONE
Le REAZIONI DI OSSIDORIDUZIONE (reazioni redox)
sono reazioni che avvengono tra elementi che variano il proprio
numero di ossidazione.
OSSIDAZIONE : aumento del n.o. perdita di elettroni
A2+ A3+ + e-
reazione di ossidazione
RIDUZIONE : diminuzione del n.o. acquisto di elettroni
A3+ + e- A+2
reazione di riduzione
A+2 <==> A3+ + eriducente
ossidante
“Il numero di e- ceduti dal riducente (che si ossida) deve
essere uguale al numero di e- acquistati dall’ossidante
(che si riduce)”
ESEMPI DI SEMPLICI REAZIONI REDOX
0 0
+4 -2
C + O2 CO2
+4-2
0
+2-2 +1-2
CO2 + H2 CO + H2O
0
+1-2+1
+1-1 +1+1-2 +1-2
Cl2 + 2 KOH KCl + KClO + H2O
BILANCIAMENTO REAZIONI REDOX
(in forma molecolare)
Individuare gli atomi che cambiano il loro n.o. e valutare
tale variazione
Bilanciamento elettronico (numero di e- ceduti = numero eacquistati)
Bilanciamento finale della massa
(ESEMPIO A)
0
+5
+2 +5
+2
Cu + HNO3 Cu(NO3)2 + NO + H2O
+5
+2
N + 3e N
riduzione
= 3
0
+2
Cu Cu + 2 e-
ossidazione
= 2
Bilanciamento elettronico:
3 Cu + 2 HNO3 3 Cu(NO3)2 + 2 NO + H2O
Bilanciamento della massa:
3 Cu + 8 HNO3 3 Cu(NO3)2 + 2 NO + 4 H2O
(ESEMPIO B)
+7
+2
+2
+3
KMnO4 + FeSO4 + H2SO4 K2SO4 + MnSO4 + Fe2(SO4)3 + H2O
+7
+2
Mn + 5 e Mn
riduzione
= 5 x 2 = 10
+2
+3
Fe Fe + 1 e-
ossidazione
= 1 x 2 = 2
Bilanciamento elettronico:
2 KMnO4 + 10 FeSO4 + H2SO4 K2SO4 + 2 MnSO4 +
5 Fe2(SO4)3 + H2O
Bilanciamento della massa:
2 KMnO4 + 10 FeSO4 + 8 H2SO4 K2SO4 + 2 MnSO4 +
5 Fe2(SO4)3 + 8 H2O
(ESEMPIO C)
Reazione di dismutazione
+1
+5
-1
KClO KClO3 + KCl
+1
-1
Cl + 2 e Cl-
riduzione
+1
+5
Cl Cl + 4 e-
ossidazione = 4 : 2 = 2
= 2 : 2 = 1
____
3
3 KClO KClO3 + 2 KCl