ANTIDEPRESSIVI E DEMENZA DI ALZHEIMER : POTENZIALITA’ TERAPEUTICHE
Roberto Rissotto, Luisa Bosia, Grazia Mauro, Carlo Serrati
U.O. NEUROLOGIA CON CENTRO ICTUS – IRCCS Azienda Ospedaliera San Martino – IST - GENOVA
Introduzione
2 – FORMAZIONE DI b-AMILOIDE
Alcuni aspetti di anatomia funzionale possono suggerire una possibile sovrapposizione fisiopatologica tra Depressione e Demenza tipo Alzheimer [AD]; in
particolare, l’Ippocampo è un’ “area non omogenea”, che comprende:
parte DORSALE, destinata a memoria, apprendimento, orientamento spaziale;
parte VENTRALE, responsabile di comportamento, emozione, regolazione dello stress (attraverso l’asse neuroendocrino)
Gli SSRI esercitano, fra l’altro, un’azione uguale sulla Neurogenesi d’entrambe le parti, analogamente all’esercizio fisico.
Scopo del nostro lavoro è stato quello di analizzare, mediante ricerca bibliografica (PubMed), l’azione degli SSRI sulla demenza, in modelli di laboratorio e
nell’uomo.
Mentre nell’ambito di Neurogenesi e Neuroprotezione l’SSRI di gran lunga più documentato è la Fluoxetina, riguardo alla possibilità
che gli SSRI possano ridurre la formazione di placche di β-Amiloide [Ab] vi sono molti dati interessanti anche su altri SSRI, s.t. sulla
Paroxetina.
Materiali e metodi
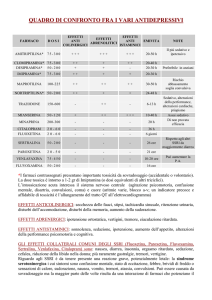
Sono stati presi in considerazione 122 articoli, in gran parte del periodo 1. 1. 2009 – 31. 1. 2014, riguardanti gli effetti di SSRI ed altri antidepressivi,
selezionati specificamente.
- In essi, l’SSRI più citato è la Fluoxetina, in 59 articoli.
- Le citazioni sugli altri SSRI sono 49 (Sertralina = 14; Paroxetina = 12; Fluvoxamina = 9; Citalopram = 8; Escitalopram = 6).
- 33 articoli si occupano dei Triciclici, s.t. dell’Imipramina (16 citazioni).
- 8 citazioni sugli altri antidepressivi e 2 sul Litio.
- 10 articoli, infine, si occupano di Antidepressivi o di SSRI in generale, senza approfondimenti singoli.
I dati preclinici riguardano due meccanismi d’azione, apparentemente diversi ma spesso in connessione fra loro:
1 – NEUROGENESI E NEUROPROTEZIONE
2 – FORMAZIONE DI b-AMILOIDE
Alcuni dati di laboratorio:
nelle cavie, la stimolazione dei recettori 5HT (2A) e 5HT (2C), dopo iniezione intraperitoneale di Dexnorfenfluramina, agonista per
questi recettori 5HT, favorirebbe, attraverso l’incrementata espressione della porzione esterna della Proteina-precursore dell’Amiloide
[APP+, la formazione di β-Amiloide “innocua” *Arjona, 2002], presumibilmente grazie alla diminuzione del livello intracellulare di Aboligomeri ed all’aumento di quello di Ab-monomeri; la Paroxetina è in grado di stimolare l’espressione della porzione esterna dell’APP
[Payton, 2003], mentre altri SSRI sarebbero in tal senso inattivi [Morse, 2004].
nei topi gli SSRI provocano diminuzione (25%) di β-Amiloide nel liquido interstiziale cerebrale; l’infusione diretta di Serotonina
nell’Ippocampo ha medesimo effetto; il trattamento cronico con Citalopram produce una riduzione del “carico lesionale”, ossia delle
placche, in topi transgenici (APP/PS1) sia di 3 mesi sia di 6 mesi, quindi “adulti”, peraltro senza diminuire l’entità delle placche
preesistenti [Cirrito, 2011; Sheline, 2014] – Queste osservazioni sono, in buona parte, speculari a quelle, meno recenti [Tohgi, 1995],
d’un diminuito contenuto liquorale di Serotonina nell’AD, contenuto che raddoppiava (pur senza raggiungere la normalità) dopo
somministrazione di Citalopram.
Fluoxetina e Paroxetina portano alla diminuzione del livello intracellulare di Ab-oligomeri ed all’aumento del livello intracellulare dei
meno tossici Ab-monomeri, mentre Imipramina (Triciclico) e Maprotillina (antidepressivo “atipico” della prima generazione)
favoriscono solo l’aumento dei monomeri, senza influenzare il livello degli oligomeri *Aboukhatwa e Luo, 2011].
La Paroxetina, somministrata a lungo termine (5 mesi) nei topi, riduce in maniera significativa i livelli di Ab 1-40 nella corteccia
cerebrale e nell’Ippocampo; analoga azione sui livelli di Tau nell’Ippocampo e nell’Amigdala. Somministrata, poi, in via profilattica agli
stessi animali per 5 mesi prima del trattamento inducente la malattia, la Paroxetina ne migliorerebbe le prestazioni cognitive; sul
versante istologico, i livelli di Aβ ed il numero di neuroni Aβ-immunoreattivi nell’Ippocampo risultano significativamente ridotti rispetto
ai controlli. Da ciò un ipotetico effetto profilattico anche sull’uomo *Nelson, 2007].
1 – NEUROGENESI E NEUROPROTEZIONE
Si tratta di due azioni nettamente distinte, accomunate peraltro, oltre che dal “bersaglio” (il Neurone), da buona parte dei meccanismi d’azione, tanto che gli
effetti di farmaci su Neurogenesi e Neuroprotezione non possono venire chiaramente disgiunti fra loro.
Tra gli SSRI, il maggior numero di dati sperimentali su Neurogenesi e Neuroprotezione riguarda la Fluoxetina.
Dati sperimentali - NEUROGENESI
La Fluoxetina agisce principalmente sulla Zona Subgranulare (SGL) del Giro Dentato dell’Ippocampo, che svolge un ruolo importante nell’apprendimento e
nella memoria.
La riduzione della Neurogenesi nello SGL è correlata al deterioramento cognitivo associato al processo d’invecchiamento ed all’AD, di cui può influenzare
notevolmente la progressione [Aboukhatwa, 2010+; è, fra l’altro, implicata in sintomi iniziali di AD quali deficit dell’acquisizione di nuove informazioni *Verret,
2007].
Alcuni effetti della Fluoxetina negli animali da esperimento.
Topi adulti, (9 settimane d’età) processo di “dematurazione” = capovolgimento della maturazione fenotipica delle Cellule Granulari adulte: più piccole,
meno sensibili agli stimoli rispetto alle cellule mature e meno ricche di sinapsi; in compenso, ripristino d’un numero adeguato di neuroni e d’una comunque
maggiore plasticità sinaptica [Kobayashi, 2010]
Topo transgenico A53T, modello animale di Sinucleinopatia (Parkinson – Lewy Bodies – MSA) dopo “trattamento cronico” con Fluoxetina, nel Giro
Dentato dell’Ippocampo = Neurogenesi 3 volte superiore ai controlli, sia da aumentata proliferazione di NSCs, sia da rallentamento del processo di
differenziazione in neuroni maturi [Kohl, 2012]
Modello animale della Sindrome di Down [T565Dn] aumentata Neurogenesi nello Strato Granulare dell’Ippocampo sia in topi neonati, trattati dal 3° al
15° giorno, sia in topi “adulti”, di 2 – 5 mesi d’età, trattati per oltre 3 settimane *Clark, 2006] – inoltre, ripristino della connettività funzionale fra Giro Dentato e
CA3 (= del circuito trisinaptico ippocampale: DG – CA3 – CA1), la cui deconnessione caratterizza la Sindrome di Down [Stagni, 2013] e della Neuroproliferazione
anche in tutte le altre strutture in cui essa è diminuita: oltre al Giro Dentato dell’Ippocampo, in Zona Subventricolare, Striato e Cortex;
Ratti antagonizzazione degli effetti negativi sulla “working memory” del 5-Fluorouracile, citostatico che attraversa facilmente la Barriera Emato-Encefalica;
tuttavia, nessun effetto sul numero di cellule proliferanti e sul comportamento [El Beltagy, 2010];
Primati aumentata Neurogenesi nel Giro Dentato, sia anteriore (= comportamento) sia posteriore (= memoria spaziale) [Perera, 2011].
Dati sperimentali - NEUROPROTEZIONE
EAE (encefalomielite allergica sperimentale, modello animale di SM) dopo pretrattamento (2 settimane) con Fluoxetina per os prima dell’induzione, 1)
diminuzione di lesioni infiammatorie e grado di demielinizzazione nel Midollo Spinale; 2) diminuzione del γ-Ifn, proinfiammatorio [Yuan, 2012]
Cellule mesencefaliche, sia neuronali sia gliali, di embrioni di topo effetto neuroprotettivo sulla neurotossicità della Microglia, attivata da
Lipopolisaccaride infiammatorio / LPS [Zhang, 2012]
Topi sottoposti ad Acido 3-nitropropionico, ad effetto ipossico trattamento con Fluoxetina nei 7 giorni precedenti all’ipossia e nei 5 giorni successivi =
effetto neuroprotettivo soprattutto con 5 mg/die [Zhu, 2012].
Altri SSRI:
- Paroxetina s.c. per 30 giorni, aumenta d’oltre il 100% la produzione di NSCs nell’Ippocampo *Lee, 2011]; nel modello animale di HAND [disordini
neurocognitivi associati ad HIV] [Okamoto, 2007], aumenta la generazione di nuovi neuroni; favorisce sia la proliferazione sia la differenziazione di NSCs in
neuroni (serotoninergici), anziché in cellule gliali [Peng, 2013].
- Sertralina non ha effetto sulla proliferazione delle NSCs dell’Ippocampo, ma stimola anch’essa le NSCs a differenziarsi in neuroni serotoninergici piuttosto
che in cellule gliali [Peng, 2012]; come la Fluoxetina, protegge i NSCs contro il danno cellulare da LPS [Zhang, 2012].
Nell’uomo…
Sinora, pochi dati interessanti:
- modello sperimentale umano in vitro (cellule staminali mesenchimali / MSC) trattamento continuo con Fluoxetina = aumentata percentuale di
sopravvivenza delle MSC; s.t., in uno di questi tipi di cellule (hEnSCs = cellule staminali endometriali umane), in presenza di Fluoxetina, differenziazione in
neuroni, apparentemente “completi” *Rahmani, 2013];
- studio post-mortem [Boldrini, 2009] in pazienti di Depressione Endogena trattati con SSRI e Triciclici = nel Giro Dentato, aumento del numero di cellule
progenitrici neurali maggiore rispetto ai non trattati: quindi, effetto positivo di SSRI e Triciclici sulla Neurogenesi, effetto ridotto dall’aumento dell’età,
- la Fluoxetina previene l’azione dell’Ecstasy (MDMA) [Azmitia, 1990], che provoca neurotossicità a livello delle vie serotoninergica e dopaminergica, con
diminuzione di Serotonina in Ippocampo e Corteccia Frontale.
MECCANISMI D’AZIONE
Il meccanismo d’azione degli antidepressivi (in particolare degli SSRI) su Neurogenesi e Neuroprotezione dell’Ippocampo non è stato ancora chiarito, anche perchè, con molta
probabilità, molteplice.
Principale meccanismo, la “cascata” che porta all’aumentata produzione del BDNF [Brain derivated Neurotrophic Factor]: stimolazione dei Recettori 5HT4, notevolmente
presenti nel Giro Dentato aumento della regolazione di AMP ciclico [Kobayashi, 2010] attivazione di due “percorsi di trasduzione di segnale”, MAPK/ERK e Wnt/GSK
[Hunsberger, 2009+ mediante l’inibizione di MPK-1, inibitore di MAPK/ERK [Duric, 2010] aumento del BDNF [Deltheil, 2009] effetto neuroprotettivo, mediato, a sua volta, dal
pCREB, versione fosforilata del CREB [Cyclic AMP Response Element].
Sia nei topi sia nell’uomo, la fosforilazione del CREB nell’Ippocampo è favorita, tra l’altro, da Fluoxetina e Sertralina, (Li, 2009); quindi, in questa “cascata” la Fluoxetina agisce sulla
Neurogenesi in almeno due punti, favorendo prima la produzione di BDNF e poi la fosforilazione del CREB [Liu, 2011].
L’azione della Fluoxetina sull’espressione del BDNF, come pure l’azione dello stesso BDNF, richiede un normale ritmo circadiano di Glucocorticoidi [Sairanen, 2005; Pinnock e
Herbert, 2008]; d’altronde, un’ipercortisolemia (p. es. da “stress”) inibisce la proliferazione neuronale nel Giro Dentato [Pinnock, 2009].
Altri meccanismi d’azione degli SSRI su Neurogenesi e Neuroprotezione nell’Ippocampo:
Inibizione della proteina p21, la quale, contrastando le Chinasi Ciclina-dipendenti, inibisce la Neurogenesi nella Zona Subgranulare del Giro Dentato [Pechnick, 2011]
Azione sulla Proteina d’Adesione PSA-NCAM, forma polisialata di NCAM, implicata nella plasticità neuronale [Guirado, 2012]: rimodellamento dei neuroni e Neurogenesi in
Ippocampo, Amigdala e Corteccia Prefrontale Mediale.
Inibizione dei Canali del Na [Mike e Lukacs, 2010];
Preservazione di HSP-70 [Heat shock Protein – 70 kD, gruppo di “proteine dello shock termico”, attive contro il c.d. stress cellulare+ e di Bcl-2 [B-cell lymphoma 2, proteina
antiapoptotica], osservata [Duan, 2008] nel modello animale della Chorea di Huntington, sottoposto a Sertralina e Fluoxetina;
Attivazione degli isoenzimi I e II dell’Anidrasi Carbonica, con produzione di HCO³ (da H²O e CO²), con effetto trofico (neurogenetico) sullo sviluppo di interneuroni GABAergici
stimolanti la risposta eccitatoria nelle cellule piramidali dell’Ippocampo e conseguente miglioramento di memoria ed abilità visuospaziali [Sun e Alkon, 2001].
Blocco selettivo dei recettori NMDA extrasinaptici (GluN2B), con conseguente Neuroprotezione, documentato per la Fluoxetina [Vizi, 2013]
Inoltre, nella Corteccia Prefrontale, “crocevia” di umore e cognitività, gli SSRI, analogamente a tutti gli altri antidepressivi, stimolerebbero, in una sorta di “via finale comune”,
plasticità neuronale e neurogenesi attraverso l’attivazione dei recettori dopaminergici D1 *Lavergne e Jay, 2010]
Limiti
Alcuni dati sperimentali (tutti sulla Fluoxetina, e tutti nei topi di laboratorio) sembrano ridimensionare l’ottimismo indotto dai risultati sopra riportati.
- L’effetto della Fluoxetina sarebbe dose-dipendente, sia sulla Neurogenesi [Boldrini, 2009]; sia sulla Neuroprotezione nella morte neuronale da ischemia nella regione CA1
dell’Ippocampo *Kim Do, 2007+, analogamente all’ Escitalopram [Lee, 2011].
- Dato ancora più importante nell’ottica d’un’eventuale applicazione terapeutica: l’effetto della Fluoxetina sulla Neurogenesi diminuisce chiaramente con l’età [Boldrini, 2009] ed è
significativa solo in animali giovani; nell’ischemia del Giro Dentato del ratto adulto, la Fluoxetina non favorisce la Neurogenesi ippocampale [Choi, 2007]; e nei ratti adulti
proliferazione neuronale e sopravvivenza/differenziazione neuronale nella Zona Subgranulare del Giro Dentato non sono influenzati dalla Fluoxetina, il cui effetto, quindi, sarebbe etàdipendente [Guirado, 2012].
- Dato clinicamente importante, gli effetti della Fluoxetina sulla sopravvivenza di cellule neuronali neonatali (sempre nei roditori) verrebbero completamente bloccati dalla
contemporanea somministrazione di Benzodiazepine [Wu e Castren, 2009].
Altri antidepressivi
Gli effetti su Neurogenesi e Neuroprotezione dell’Ippocampo non sono esclusivi degli SSRI, ma possono venire osservati anche da parte di Triciclici, MAO-I e NaRI (= Reboxetina)
[Malberg, 2000]. La maggior parte dei dati riguarda i Triciclici, e fra questi soprattutto l’Imipramina.
In particolare, all’Imipramina molti dati sperimentali attribuiscono [Peng, 2008], un effetto 1) neuroprotettivo, 2) antiinfiammatorio, 3) prodifferenziatorio dei NSCs (=
neurogenetico); anch’essa attiverebbe MAPK/ERK , con conseguente aumentata espressione del BDNF *Lauterbach, 2012]
Recettori Σ-1
Questi recettori, localizzati s.t. in regioni del SNC implicate nella Depressione e nei processi cognitivi (Corteccia ed Ippocampo), contribuiscono sia alla mediazione di effetti
antidepressivi, sia ai processi di apprendimento e memoria: vedi l’aumento dei livelli extracellulari di Acetilcolina in Ippocampo e Corteccia ad opera degli Agonisti dei Σ-1 [Monnet,
1990; 2003]. Tra gli SSRI, la Fluvoxamina presenta la maggior affinità per i Σ-1, con questi effetti:
- potenzia lo sviluppo, ad opera del NGF, di neuriti in cellule PC 12 [Nishimura, 2008+, inibito da antagonisti dei Σ-1;
- somministrata “cronicamente” in modelli animali di Schizofrenia, migliora il deficit cognitivo indotto dalla Fenciclidina (antagonista dei NMDA); quindi, potenziale efficacia della
Fluvoxamina sul deficit cognitivo nella Schizofrenia [Hashimoto, 2007+; in un’osservazione singola nell’uomo, inoltre, evidente miglioramento cognitivo in un paziente con Schizofrenia
[Iyo, 2008];
- sempre nell’uomo, si sarebbe dimostrata efficace sul “delirium” in 5 pazienti in terapia intensiva post-operatoria [Wengel, 1998; 1999], efficacia attribuita [Furuse ed Hashimoto,
2010+ alla sua affinità per i Recettori Σ-1.
Queste ultime due azioni cliniche sono state osservate anche con il Donepezil, parimenti agonista dei Σ-1.
Mancano ancora, al momento attuale, risultati specifici sulle demenze.
Anche i Triciclici avrebbero un’azione positiva sull’Aβ, attraverso un meccanismo d’azione diverso da quello degli SSRI, ossia come
antinfiammatorî. L’Imipramina, di cui si è già visto l’effetto neuroprotettivo proprio su base antinfiammatoria, somministrata nei topi,
per 13 giorni a partire dal giorno successivo all’iniezione di Aβ25-35, 1) previene significativamente i deficit mnesici da essa causati e
2) riduce gli elevati livelli di Aβ nella corteccia frontale e nell’Ippocampo *Chavant, 2010]. Inoltre, i Triciclici (nella fattispecie,
Clomipramina ed Imipramina) dimostrano, in colture di cellule gliali, di possedere un’azione antinfiammatoria e neuroprotettiva nel
Sistema Nervoso Centrale modulando l’attivazione gliale, s.t. diminuendo la produzione di Acido Nitrico e di TNF-α *Hwang, 2008].
3 – CONFRONTO SSRI / TRICICLICI
Confrontando gli studi sui Triciclici [p. es., Chavant, 2010; Hwang, 2008] con i più numerosi dati riguardanti gli SSRI, si scorge, pur
nell’incertezza delle ipotesi patogenetiche, una differenza di meccanismo d’azione: i Triciclici agirebbero come antinfiammatori, quindi
“ a monte”, mentre gli SSRI agirebbero “ a valle”, con altri meccanismi, p. es. la neurorigenerazione [vedi Duan, 2008; Suda, 2010] e la
riduzione di β-Amiloide [vedi Keowkase, 2010, riguardo alla Fluoxetina; Payton, 2003, e Nelson, 2007, riguardo alla Paroxetina]. A
riprova di questa differenza, in un’ampia statistica danese *Kessing, 2011] su 37.658 pazienti con depressione, 2007 (5,3%)
svilupparono, in un secondo tempo, una demenza; nei pazienti trattati con antidepressivi di prima generazione (s.t. Triciclici, quindi), la
percentuale di nuovi casi di AD (non quella d’altre forme di demenza) era ridotta rispetto alla media generale, ciò che non avveniva,
invece, nei pazienti trattati con SSRI.
4 – CLINICA
Dalla statistica danese [Kessing, 2011+ risulterebbe la mancanza d’un’azione preventiva degli SSRI sull’AD; altri studi affermano il
contrario, prospettando un effetto preventivo degli SSRI [p. es., riguardo alla Paroxetina, Nelson, 2007], partendo, però, dalle solite
osservazioni sugli animali da laboratorio.
Dai primi studi non risultarono differenze sui deficit cognitivi fra SSRI (Citalopram – Nyth e Gottfries, 1990; Sertralina – Lyketsos,
2003) e placebo.
Da ribadire, peraltro, lo studio [Tohgi, 1995+ sull’aumento del contenuto liquorale di Serotonina nell’AD, dopo somministrazione di
Citalopram, su questi pazienti, purtroppo, mancano dati neuropsicologici (cognitivi e depressivi).
Con l’avvento degli inibitori della Colinesterasi *AChE-I], vennero svolti alcuni studi clinici associando questi farmaci agli
antidepressivi. Uno di questi, in doppio cieco [Finkel et al., 2004+, non trovò miglioramenti del MMSE dopo l’aggiunta di Sertralina al
Donepezil, benchè l’impressione esterna (Clinician’s Global Impression) fosse lievemente migliorata nei pazienti trattati con
quest’associazione.
Solo negli ultimi anni si è cercato di stabilire l’eventuale azione diretta degli antidepressivi sul deterioramento nell’AD, prescindendo
dall’azione indiretta derivante dai loro effetti sul tono dell’umore.
Anzitutto, due studi retrospettivi.
- In 58 pazienti trattati, oltre che con AChE-I, anche con SSRI (s.t. Sertralina e Citalopram) per almeno 9 mesi, nessun’apparente azione
(positiva o negativa) sul declino cognitivo [Caballero, 2006].
- 338 pazienti con “probabile” AD, trattati con AChE-I per 9 mesi e suddivisi in 3 categorie: non depressi non trattati, depressi trattati
con SSRI e depressi non trattati – In questi ultimi, peggioramento maggiore delle prestazioni cognitive rispetto agli altri due gruppi
[Rozzini, 2010+. Trattandosi d’uno studio retrospettivo, manca la categoria più interessante, ossia i deteriorati non depressi trattati con
SSRI.
Quindi, alcuni studi “ex novo”.
- Su 122 pazienti con AD suddivisi in 3 gruppi (1 = Rivastigmina + Fluoxetina; 2 = Rivastigmina sola; 3 = placebo), i due gruppi di
pazienti trattati mostrano risultati migliori rispetto a quello del placebo, ma nessuna significativa differenza fra loro riguardo alle
funzioni cognitive; unico dato a favore della terapia combinata di Rivastigmina + Fluoxetina, i suoi maggiori effetti sulla vita quotidiana
e sull’efficienza globale, beneficio per il quale, tuttavia, potrebbe svolgere un ruolo l’azione antidepressiva *Mowla, 2007].
Sul decadimento cognitivo di grado lieve [MCI]: in 44 pazienti affetti da MCI senza depressione, trattati per 8 settimane con
Fluoxetina o placebo, si osserva, nel gruppo con Fluoxetina, un miglioramento del MMSE e dei test di memoria logica, sia immediata
sia differita, al contrario dell’assenza di variazioni nel gruppo del placebo *Mowla, 2010].
In 131 Pazienti con AD, di cui 40% anche con Depressione maggiore, trattati con Sertralina (67) o Placebo (64) per 24 settimane:
nessuna differenza cognitiva tra i due gruppi, sia dopo 12 settimane sia dopo 24 settimane [Munro et al., 2012]
Interessanti i dati, d’uno stesso gruppo, sui “biomarcatori”. La FDG-PET retrospettiva in 186 soggetti cognitivamente normali, trattati
o no con antidepressivi in generale (quasi tutti con SSRI, in maggioranza con Sertralina) mostra nei primi una diminuzione del carico
lesionale rispetto ai pazienti non trattati [Cirrito, 2011]; recentemente [Sheline, 2014+, su 23 volontari sani d’età inferiore ai 50 anni, la
somministrazione di 60 mg di Citalopram (in due dosi ravvicinate di 30 mg) sopprimeva del 37% la produzione di ß-Amiloide a 45 ore di
distanza. Molte domande rimangono aperte, a cominciare dalla dose (ben superiore a quella terapeutica) ed ai possibili effetti
collaterali di questo farmaco, tanto che gli autori pensano d’utilizzare un altro SSRI per futuri studi sull’uomo.
Sul versante anatomopatologico, oltre allo studio retrospettivo sulla PET in soggetti trattati o no con antidepressivi, da citare
un’osservazione su un singolo caso di depressione, che documenta un aumento di volume dell’Ippocampo in concomitanza col
trattamento combinato Donepezil + Sertralina [Suda, 2010].
Ritornando agli aspetti più propriamente clinici, considerando sia gli studi sull’uomo sia quelli sugli animali, notiamo che solo
quattro, tra i lavori precedentemente citati, studiano esplicitamente gli eventuali effetti degli antidepressivi sui deficit cognitivi: fra
questi, tre (Chavant, 2010 – Imipramina, nei topi; Nelson, 2007 – Paroxetina, nei topi; Mowla, 2010 – Fluoxetina, nell’AD)
attesterebbero, a vario titolo, l’efficacia procognitiva dei farmaci sperimentati, mentre il 4° (Caballero, 2006 – Sertralina e Citalopram,
nell’AD) la escluderebbe.
Riepilogando, a tutt’oggi non vi sono studi clinici che dimostrino con chiarezza gli effetti degli SSRI sui disturbi cognitivi, come pure
sui biomarcatori, con l’eccezione dei due studi sul Citalopram. Non è stato ancora possibile distinguere gli effetti procognitivi degli SSRI
(osservati in più d’un’occasione) da quelli più propriamente psichiatrici, ossia antidepressivi, anche se certi dati *Tohgi, 1995; Cirrito,
2011; Sheline, 2014] confermerebbero indirettamente la particolare responsività agli SSRI dei pazienti con AD.
5 – CONCLUSIONI
- Depressione e AD sembrano costituire spesso due aspetti d’una stessa malattia, localizzata
anatomicamente nell’Ippocampo e potenzialmente influenzabile dagli SSRI.
- A livello sperimentale, ossia in vitro e negli animali da laboratorio, l’efficacia degli SSRI, s.t. di Fluoxetina e
Paroxetina, sia a favore di Neurogenesi e Neuroprotezione, sia contro la produzione di ß-Amiloide, è un
dato sufficientemente consolidato. Scarseggiano, peraltro, dati attendibili su animali filogeneticamente più
evoluti.
- Gli effetti degli SSRI non sono specifici: molti altri farmaci, primi fra tutti i Triciclici, mostrano analoghe
azioni, anche se non sempre mediante gli stessi meccanismi
- Già negli animali quest’efficacia degli SSRI sembra età-dipendente, riducendosi col progredire dell’età.
- L’uso contemporaneo di Benzodiazepine antagonizzerebbe i possibili effetti terapeutici degli SSRI
- I dati sugli animali non sono facilmente trasferibili sull’uomo; in particolare, le dosi efficaci in laboratorio
corrispondono spesso a dosi per noi eccessive.
- Gli studi sinora compiuti sull’AD sono pochi e per lo più deludenti nei risultati; resta da stabilire, in
eventuali nuove sperimentazioni, pressochè tutto: oltre al farmaco (Fluoxetina o Paroxetina piuttosto che
gli altri SSRI?), dosi, modalità di somministrazione, durata del trattamento (illimitata?) e strumenti di
valutazione
- Sarà necessario, nei futuri studi, includere stabilmente, accanto ai test neuropsicologici, i biomarcatori, sia
strumentali (PET) sia liquorali
- Si ha l’impressione d’un campo di ricerca molto promettente dove, tuttavia, nessuno si è ancora
addentrato a fondo, come dimostra lo scarso numero di studi controllati attualmente disponibili, di fronte a
dati di laboratorio il cui inizio data ormai dall’ultimo decennio del secolo scorso.
Bibliografia elencata a parte (vedi gli allegati)
575