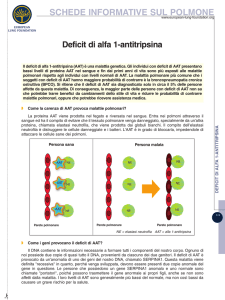
Carenza congenita di Alfa-1-Antitripsina
ALTA FREQUENZA IN EUROPA E NEGLI USA
PRINCIPALE CAUSA GENETICA DI ENFISEMA E DI EPATOPATIA
PRIMA CAUSA DI TRAPIANTO DI FEGATO IN ETA' PEDIATRICA
ALTO POLIMORFISMO DELLA PROTEINA (OLTRE 100 VARIANTI NORMALI E
PATOLOGICHE)
MALATTIA DA ACCUMULO PROTEICO E MALATTIA CONFORMAZIONALE
ASSOCIAZIONE MUTAZIONE/MALATTIA (solo l'8-20% degli omozigoti Z
sviluppa epatopatia)
Varianti dell‘alfa-1-antitripsina
Variante M
Variante S
Più comune variante “normale” della proteina
alfa-1-antitripsina
Livelli plasmatici di AAT leggermente ridotti
Rilevanza clinica minima
Malripiegamento della proteina che porta alla
polimerizzazione dell’AAT
Variante Z
Livelli plasmatici di AAT molto ridotti
Variante deficitaria più comune
Varianti Null
Portano alla mancanza di alfa-1-antitripsina circolante
(mancanza completa di sintesi)
Pi MM
Pi ZZ
Epatocita
+
M+
+
Normali livelli di
AAT
M+
Condizioni
basali
+++
Livelli sierici
M +++
+++
di AAT elevati
(fino a 5vv i v.n.)
Pi MZ
Condizioni basali
M+
Z+
+ 100%
Livelli sierici di
AAT intermedi
85-90%
Stimolazione clinica
M +++
Z +++
+++
Z+
Severo deficit di AAT
Z+
M +++
Stimolazione clinica
Condizioni basali
+++
Livelli sierici di AAT nella
norma
Stimolazione clinica
Z +++
+++
Z +++
+++
Severo deficit di AAT
Patologie
polmonari
Deficit di A1AT
Adulti
Epatopatie
Neonati
Bambini
Adulti
La causa più frequente di trapianti di fegato in età
pediatrica.
A1AT e patologie epatiche
L’epatopatia deriva dall’effetto tossico
della proteina mutata
DEFICIENT VARIANTS
Allele
Common:
-Z
-S
Rare:
-Mmalton/Cagliari
-M procida
- Mm springs
- M nichinan
- M-Siiyama
Z/Z
Mutation
Exon
Glu342GAG-LysAAG
Glu264GAA-ValGTA
V
III
deletion Phe52TTC
II
Leu41CTG-ProCCG
Gly67GGG-GluGAG
deletion Phe52TTC
Ser53TCC-PheTTC
II
II
II
II
and/or
Children’s Hospital of Pittsburgh
• Avete pazienti con deficit di A1AT?
• Carbamazepina (tegretol) fa regredire fibrosi e
favorisce eliminazione di A1AT accumulata in
epatociti
• Trial clinico: 12 mesi di tegeretol
• 001.855.428.2281
• [email protected]
• www.chp.edu/at_study
CONCLUSIONI
• I primi dati sulla carenza congenita di A1AT in
Sardegna suggeriscono che la mutazione MCagliari è frequente in Sardegna e che lo
stato di omozigosi e di eterozigosi devono
considerarsi come un importante fattore di
rischio per l’insorgenza di patologie epatiche
e polmonari.
10-15%
85-90%
Nessun segno o sintomo
Sintomi, ma non diagnosticati
Alfa-1-antitripsina:
Biologia molecolare
Gene inibitore delle proteasi (gene-Pi): codifica
l‘alfa-1-antitripsina
cromosoma 14 (12.2 kb)
Principale sito di espressione: epatociti; secrezione
addizionale nel rene, nel polmone e nell‘intestino
tenue
Figura gentilmente fornita dal
Prof. David Lomas, Cambridge, UK
Sono conosciuti oltre 100 alleli-Pi:
variante-M (normale)
varianti-S, -Z, -Null e altre
Alfa-1-Antitripsina (A1AT)
glicoproteina serica della fase acuta
prodotta principalmente dal fegato
Serpino antiproteasi
Elastasi (Serino Proteasi)
Centro reattivo
A1AT
Elastasi
Deficit di alfa 1 antitripsina (riduzione dell’85% 90%)
Enfisema polmonare
Cirrosi epatica, epatocarcinomi
Struttura di AAT e del suo substrato naturale
elastasi neutrofila (NE)
Sito attivo inibitorio Met358
Asn95
Alfa-1-antitripsina
Asn46
His41
Ser173
ILe356
Pro357
Met358
Asp88
Asn144
Ser359
ILe360
Pro361
Asn247
Elastasi neutrofila
Asn83
Modificato da Crystal et al., Chest 1989 (95)
IL GENE DELL’A1AT
1A
1B
1C
Esone 2
Esone3
Esone 4
Esone 5
Regione non trascritta
ATG
Sito d’inizio della trascrizione
TAA
Codone di Stop
LA SINTESI DELL’A1AT E’ CONTROLLATA DA UN GENE LOCALIZZATO SUL CROMOSOMA 14
IL GENE E’ ORGANIZZATO IN 7 ESONI E 7 INTRONI. E’ LUNGO 12,2 KB
I PRIMI 3 ESONI (IA, IB, IC) CONTROLLANO LA TRASCRIZIONE,
GLI ESONI 2,3,4 E 5 CODIFICANO LA PRODUZIONE DELLA PROTEINA.
IL GENE DELL’A1AT VIENE ESPRESSO DA.
EPATOCITI
MONOCITI
MACROFAGI ALVEOLARI
PANCREAS ESOCRINO
Il gene dell‘alfa-1-antitripsina (Pi)
Proteina AAT (394 aminoacidi)
La mutazione Z porta ad un cambiamento aminoacidico in posizione 342 (Glu > Lys)
La mutazione S porta ad un cambiamento aminoacidico in posizione 264 (Glu > Val)
Modificato da Crystal RG et al., Chest, 1989
Il gene dell’Alfa-1-Antitripsina
Proteina secreta
Accumulo intraepatico
394 aminoacidi
Precursore della
proteina
418 aminoacidi
1.75Kb mRNA
1A
1B
1C
Esone 2
Esone 3
Esone 4
Regione non tradotta
ATG
Sito d’inizio traduzione
Mutazione S
(Glu264GAA >ValGTA)
Esone 5
Mutazione Z
(Glu342GAG > LysAAG
TAA
Codone di Stop
NORMAL VARIANTS
Allele
Mutation
Exon
- M1 (Ala 213)
- M1 (Val 213)
Ala213GCG-ValGTG
III
- M3
Glu376GAA-AspGAC
V
-M2
Arg101CGT-HisCAT
II
-M4
Arg101CGT-His
II
M/M
NULL VARIANTS
Allele
Mutation
Exon
- Nbelling
Lys217AAG-Stop217TAG
III
- Ngran falls
Tyr160TAC-Cdel-Stop160
II
- Nmattawa
Leu353TTA-inserz.T-Stop376
V
- Nhong kong
Leu318CTC-delez.TC-Stop334
IV
- Nis procida
delez. 17Kb tra exon II-IV
II-IV
Null/Null
Cytosol
ER
Golgi
Ribosome
Glucosidase
I and II
EXIT
correctly
folded
CNX
Cytosol
ER
Serum
deficiency
Golgi
Ribosome
Glucosidase
I and II
EXIT
Polimerization
Abnormally
Ubiquitin
folded
CNX
Degradation
Proteasome
Uncorrectly
folded
Meccanismo nel deficit di alfa-1antitripsina
Delezione del gene
(codone di stop, mutazione „Null“)
Degradazione dell‘mRNA instabile
Aggregazione di molecole di AAT
(fenotipo PiZ)
Degradazione di polimeri AAT
AAT secreta
No AAT o AAT non-funzionale
Modificato da Crystal RG, Pulmonary Diseases and Disorders. New York: McGraw-Hill; 1992: 671-673
Multiple factors
?
Acool
HCV
A1ATD
Secretion
patway
Degradation
patway
Liver disease
M- like region
41 42
43 44
45 46
47 48 49 50 51 52
53
CTG GCA CAC CAG TCC AAC AGC ACC AAT ATC TTC TTC TCC
M-Siiyama mutation
M-Malton, M-Nichinan,
M-Palermo, M-Cagliari mutation (Ser53 Phe)
(Phe51 or 52 TTC delation)
M-Procida mutation
(Leu41CTG ProCCG)
S Mutation
(Glu264GAAValGTA)
1A
1B
1C
Untraslated regions
Exon 2
Exon 3
ATG
Translationalstart site
Exon 4
Z Mutation
(Glu342GAGLysAAG)
Exon 5
TAA
Stop codon
Shutter domain
di AAT (μM)
sierica[µM]
Concentratione
AAT serum level
Il livello sierico di alfa-1-antitripsina dipende dal
genotipo Pi
Soglia protettiva di
11 µM
Genotipo dell’alfa-1-antitripsina Pi
Rischio di enfisema
no
basso
basso
basso
medio
alto
alto
Rischio di epatopatia
no
no
no
si
si
si
no
Gene Pi: polimorfismo allelico
Varianti normali:
M1, M2 …
Varianti Deficitarie:
Z, S, MMalton …
Mutazioni Null:
QOIsola di procida …
Mutazioni disfunzionali:
Pittsburg, M Mineral Springs …
Sono conosciute oltre 100 varianti genetiche
Alcune di queste mutazioni causano il deficit di AAT
Alberi familiari di genotipi di AAT
MZ
MM
MZ
MS
MZ
MZ
ZZ
MM
Genitori
Figli
MZ
MZ
MS
SZ
Livelli sierici di alfa-1-antitripsina per i genotipi
Pi più comuni
PiMM
→
da 20 µM a 53 µM
PiSS
→
da 20 µM a 48 µM
PiMZ
→
da 15 µM a 42 µM
PiSZ
→
da 10 µM a 23 µM
PiZZ
→
da 3 µM a 7 µM
PiZ/Null
→
da 0 µM a 2.5 µM
PiNull/Null
→
AAT non rilevabile
Modificato da Brantly M et al., Am J Med 1988 (84)