Ciclo dell’acido citrico
Il metabolismo ossidativo dei
carburanti metabolici
I gruppi acetili derivati da carboidrati,
amminoacidi e acidi grassi entrano nel
ciclo dell’acido citrico dove vengono
ossidati a CO2
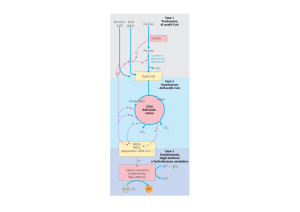
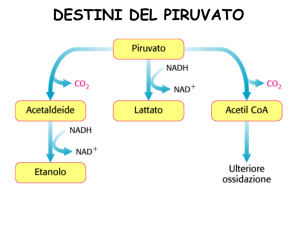
Il piruvato, derivato dal glucosio ad opera della
glicolisi
viene ossidato formando acetil CoA e CO2 per
azione di 3 enzimi organizzati nel
complesso della piruvato deidrogenasi, localizzato
nei mitocondri delle cellule eucariotiche.
Reazione complessiva catalizzata dal
complesso della piruvato deidrogenasi.
In questa reazione sono coinvolti
cinque coenzimi e tre enzimi.
•Reazione complessiva catalizzata dal complesso della
piruvato deidrogenasi:
•La decarbossilazione ossidativa
•Processo di ossidazione irreversibile:
•il gruppo carbossilico viene rimosso dal piruvato sotto
forma di una molecola di CO2
•i 2 atomi di carbonio che restano diventano il gruppo
acetilico legato al CoA.
La deidrogenazione e la decarbossilazione del piruvato ad Acetil CoA
coinvolgono l’azione sequenziale di
3 enzimi diversi:
piruvato deidrogenasi (E1),
diidrolipoil transacetilasi (E2)
diidrolipoil deidrogenasi (E3).
e di 5 gruppi prostetici o coenzimi: tiamina pirofosfato (TPP)
FAD
CoA
NAD
lipoato.
Ben 4 vitamine sono elementi essenziali di questo sistema:
•la tiamina per la TPP
•la riboflavina per il FAD,
•la niacina per il NAD
•il pantotenato per il CoA
E2= diidrolipoil
transacetilasi
(24)
E1= piruvato
deidrogenasi
(24)
Intero complesso
(60 subunità)
E3= diidrolipoil
Deidrogenasi
(12)
Organizzazione strutturale del complesso multienzimatico della
piruvato deidrogenasi
Regolazione del complesso multienzimatico
• l’attivazione avviene ad opera di una
fosfoproteina fosfatasi che defosforila il
cmplesso attraverso una reazione Mg2+
e Ca 2+ dipendente
•L’inattivazione del complesso si realizza
per azione di una proteina chinasi Mg 2+ATP-dipendente strettamente legata al
complesso multienzimatico
• l’acetil CoA e il NADH prodotti nella
reazione inibiscono la forma defosforilata
(attiva) dell’enzima, ma stimolano la
proteina chinasi, promuovendo
l’interconversione del complesso nella sua
forma inattiva
• il CoA libero inibisce la proteina chinasi e il NAD
• quando aumenta il rapporto NADH/NAD+mitocondriale o il
rapporto acetil-CoA/CoA come avviene durante la βossidazione degli acidi grassi, il complesso della piruvato
deidrogenasi è inattivato per azione della chinasi
• il piruvato è un potente inibitore della proteina
chinasi, quindi alti livelli di piruvato inibiscono la chinasi
e attivano il complesso
Modificazione covalente della piruvato deidrogenasi
negli eucarioti.
Funzione principale del Ciclo è quella
di generare equivalenti riducenti che
sono utilizzati per produrre energia,
cioè ATP, nel processo di trasporto
degli elettroni-fosforilazione
ossidativa
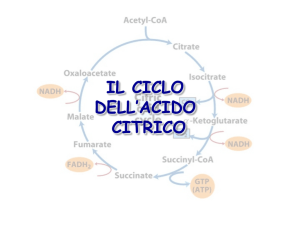
CICLO DELL’ACIDO CITRICO
Il ciclo dell’acido citirco ossida l’acetil CoA, il prodotto
comune della degradazione di:
• glucosio
• acidi grassi
• amminoacidi chetogenici
a CO2 e H2O con produzione di NADH e FADH2
• molti amminoacidi glucogenici possono essere ossidati attraverso
il ciclo dell’acido citrico grazie alla loro demolizione in uno dei suoi
intermedi
L’attività degli enzimi dell’acido citrico:
• citrato sintasi
• isocitrato deidrogenasi
• α-chetoglutarato deidrogenasi
• è controllata dalla disponibilità di substrato e dall’inibizione a
feedback da parte degli intermedi del ciclo
1a reazione: formazione di citrato
• l’enzima citrato sintasi è inibito da elevate concentrazioni di NADH(H),
ATP di succinil CoA e di acil-CoA che agiscono come effettori negativi
• il citrato a sua volta agisce come effettore negativo della
fosfofruttochinasi-1
L’intermedio citril-CoA non viene rilasciato dall’enzima durante la
reazionee si ritiene che rimanga legato al sito catalitico della citrato
sintasi
• la citrato sintasi è presente nella matrice mitocondriale ed ha un
peso molecolare di 100.000
2a reazione: formazione di isocitrato
• la reazione aconitasica è fortemente inibita da fluoroacetato ( CH2-FCOO- ) un composto presente in certe piante del Sud Africa
Centro ferro-zolfo dell’aconotasi
La reazione dell’aconitasi
non richiede cofattori ,
essa richiede la
partecipazione di ioni
ferroso che gli vengono
forniti dal centro ferrozolfo che è un componente
essenziale dell ’attività
idratasica dell’enzima
3a reazione:
decarbossilazione ssidativa dell’isocitrato per formare achetoglutarato.
Isocitrato deidrogenasi: NAD+ dip. (matrice mitocondriale, ciclo di Krebs)
NADP+ dip.(citosol, reazioni anaboliche)
• peso molecolare di 380.000
• è costituita da 8 sub unità identiche
• è stimolata da ADP e in alcuni casi da AMP
• è inibita da ATPe NADH+
4a reazione:
decarbossilazione ossidativa dell’ a-chetoglutarato in
succinil-CoA e CO2
• questo complesso è identico a quello della piruvato deidrogenasi ma non
è regolato da reazioni di fosforilazione e defosforilazione
• il complesso è inibito da ATP, GTP da NADH e succinil CoA
• sembra attivato da ioni calcio
5a reazione: Conversione del succinil-CoA a succinato
• fase intermedia in cui la molecola dell’enzima diventa fosforilata a livello di
un suo residuo di His presente nel sito attivo
• Il gruppo fosforico viene quindi trasferito all’ADP o al GTP per formare
ATP e GTP
E ‘ questa l’unica reazione metabolica in cui il GTP è preferito all’ ATP
• le cellule animali hanno 2 isozimi, uno per l’ADP e un altro per il GDP.
Reazione della succinil CoA sintetasi
Un gruppo fosforico sostituisce il CoA legato
all’enzima
formando un fosfato ad alta energia
Il succinil fosfato dona il gruppo fosforico a un
residuodi His dell’enzima formando un fosfoenzima
ad alta energia
Il gruppo fosforico viene trasferito dal residuo di His
al gruppo fosforico terminale del GDP
•La formazione di ATP o GTP a spese dell’energia
rilasciata dalla decarbossilazione ossidativa dell’ achetoglutarato è un esempio di fosforilazione a
livello del substrato
• Il GTP formato dalla succinil-CoA sintetasi può
donare il suo gruppo fosforico terminale all’ADP per
formare ATP, mediante l’azione reversibile della
nucleoside difosfato chinasi.
6a reazione: sintesi di fumarato
• la succinato deidrogenasi è fortementa
inibita da malonato e ossalacetato
• è attivata da ATP, fosfato inorganico e
succinato
• il malonato inibisce l’enzima in modo
competitivo, dovuto alla notevole somiglianza
strutturale col succinato
La succinato deidrogenasi
• è una flavoproteina che è inserita a differenza degli altri
enzimi, nelle membrana mitocondriale interna favorendo il
trasferimento diretto degli elettroni alla catena respiratoria
• è’ costituito da due subunità di 70.000 e 30.000 m.w.
rispettivamente
• la prima contiene il sito di legame per il substrato, il FAD
legato alla lisina e 4 atomi di ferro + 4 atomi di zolfo
• la seconda contiene solo ferro e zolfo
7a reazione: idratazione del fumarato per produrre
malato
• la fumarasi è un tetramero con M.W. Di 200.000
Ultima reazione: ossidazione del malato a ossalacetato
• in questa reazione con l’ossidazione del malato ad ossalacetato si
rigenera il prodotto di partenza che così può riprendere il ciclo
• l’ossalacetato può essere convertito anche in fosfoenol-piruvato
o transaminato ad aspartato
Le reazioni anaplerotiche riforniscono il ciclo di Krebs di intermedi.
In condizioni normali, esiste un bilanciamento quasi perfetto tra le reazioni che
rimuovono intermedi dal ciclo e quelle che invece lo riforniscono, e quindi la
concentrazione di questi composti resta costante.
CARENZA DI PIRUVATO DEIDROGENASI
• Deficienze dei differenti componenti catalitici o subunità
regolatrici
• I bambini con questo deficit presentano alti livelli di
lattato, piruvato e alanina che causano acidosi lattica
cronica .
.
Presentano inoltre gravi danni neurologici.
neurologici In molti casi
questa carenza comporta la morte dell’individuo
• La diagnosi viene fatta saggiando il complesso enzimatico e/o
le sue subunità enzimatiche in colture di fibroblasti di pelle
prelevata dal paziente
•In alcuni casi i pazienti rispondono a un regime dietetico di
tipo chetogenico con bassi livelli di carboidrati
DEFICIT DI FUMARASI
• Il deficit di enzimi del ciclo degli acidi ticarbossilici è raro,
tuttavia sono stati riportati alcuni casi in cui è presente un
grave deficit di fumarasi sia a livello mitocondriale che
citosolico
• È presente un grave danno neurologico con encefalopatia e
distonia che si manifestano precocementa dopo la nascita
• Le urine contengono quantità anomale di fumarato e di una
o più delle seguenti sostanze : succinato, α-chetoglutarato,
chetoglutarato
citrato e malato
• Entrambi i genitori presentano livelli di attività enzimatica
dimezzati rispetto al normale come si verifica nei disordini su
base autosomica recessiva
Una molecola di glucosio
può potenzialmente
promuovere la sintesi di
circa 38 ATP in condizioni
di aerobiosi, cioè quando
funziona il ciclo dell' acido
citrico.
Il ciclo dell’acido citrico è regolato a livello
delle sue tre tappe esoergoniche
Il flusso dei metaboliti attraverso il ciclo dell’acido citrico è sotto
stretto controllo. Tre fattori governano la velocità del flusso
attraverso il ciclo:
1. La disponibilità di substrato
2. l’inibizione da accumulo di prodotti
3. l’inibizione allosterica retroattiva (a feedback) dei primi enzimi del
ciclo da parte degli ultimi intermedi.
Vi sono 3 tappe fortemente esoergoniche nel ciclo:
1. reaz. catalizzata dalla citrato sintasi
2. reaz. catalizzata dalla isocitrato deidrogenasi
3. reaz. catalizzata dalla a-chetoglutarato deidrogenasi
In condizioni normali la velocità della glicolisi e del acido
citrico sono coordinate in modo che la quantità di
glucosio metabolizzato a piruvato sia soltanto quella che
poi entra nel ciclo dell’acido citrico sotto forma di
Acetil-CoA.
Piruvato, lattato e Acetil-CoA sono mantenuti a concentrazioni
stazionarie.
La velocità della glicolisi viene quindi adeguata a quella del ciclo
dell’acido citrico non soltanto dai livelli di ATP e di NADH, che sono
componenti della fase sia glicolitica sia respiratoria dell’ossidazione
del glucosio, ma anche dal citrato.
Il Citrato, prodotto della prima tappa del ciclo, è anche
un inibitore allosterico della fosforilazione del fruttosio
6-fosfato da parte della fosfofrutto chinasi-1 della via
glicolitica.
L‘ aconitasi funziona in condizioni vicine all' equilibrio,
per cui la velocità di consumo del citrato dipende
dall'attività:
1.dell'isocitrato deidrogenasi NAD+-dipendente, che in vitro
viene fortemente inibita dal suo prodotto NADH.
2. La citrato sintasi viene anche inibita dal NADH, ma è meno
sensibile dell'isocitrato deidrogenasi alle variazioni della [NADH].
La citrato sintasi è anche inibita e dal citrato che compete con
l'ossalacetato)
3. l'inibizione dell‘a-chetoglurarato deidrogenasi da parte del
NADH e del succinil-CoA. Il succinil-CoA compete anche con
l'acetil-CoA nella reazione della citrato sintasi (inibizione
retroattiva competitiva).
Questo sistema di inibizioni combinate aiuta a mantenere
regolato il ciclo dell' acido citrico in modo coordinato.
Altri meccanismi regolatori
Studi
in vitro riguardanti gli enzimi del ciclo dell'acido citrico
hanno permesso di identificare alcuni inibitori e attivatori
allosterici.
L’ADP
è un attivatore allosterico dell'isocitrato deidrogenasi,
mentre l'ATP inibisce questo enzima.
Il
Ca2+ oltre alle sue altre numerose funzioni cellulari, regola il
ciclo dell' acido citrico in diversi punti:
attiva la
piruvato deidrogenasi fosfatasi, che a sua volta attiva
il complesso della piruvato deidrogenasi per la produzione di acetilCoA.
Il
Ca2+, attiva anche l'isocitrato deidrogenasi e l‘a
chetoglutarato deidrogenasi
•Così il Ca2+, il segnale che stimola la contrazione muscolare,
stimola anche la produzione dell'ATP che andrà a supportarla
•Nel muscolo cardiaco, dove il ciclo dell' acido citrico è
attivo, il flusso dei metaboliti lungo il ciclo è proporzionale alla
velocità del consumo cellulare di ossigeno
Poiché il consumo di ossigeno, la riossidazione del NADH e la
produzione di ATP sono saldamente accoppiati, il ciclo dell'acido
citrico deve essere regolato da meccanismi retroattivi che
coordinino la produzione di NADH con il consumo di energia.
I più importanti regolatori del ciclo
dell'acido citrico sono i suoi substrati
l'acetil-CoA
l'ossalacetato
il
suo prodotto, NADH.
K = [ossalacetato][NADH]
[malato] [NAD+]
Sia l'acetil-CoA sia l’ ossalacetato sono presenti nei mitocondri a
una concentrazione che non è in grado di saturare la citrato sintasi.
Il flusso metabolico lungo questo enzima varia quindi in funzione
della concentrazione di substrato e viene controllato dalla
disponibilità di quest'ultimo.
La produzione di acetil-CoA a partire da piruvato viene regolata
dall' attività della piruvato deidrogenasi.
La concentrazione di ossalacetato, che è in equilibrio con il
malato, fluttua a seconda del rapporto [NADH]/[NAD+] seguendo
l'espressione all'equilibrio
K = [ossalacetato][NADH]
[malato] [NAD+]
Se aumenta il carico di lavoro del muscolo e la respirazione, nei
mitocondri la [NADH] diminuisce.
Il conseguente aumento della [ossalacetato] stimola l'attività della
citrato sintasi, che controlla la velocità di formazione del citrato.
Il ciclo del citrato come piattaforma girevole del metabolismo.
fine