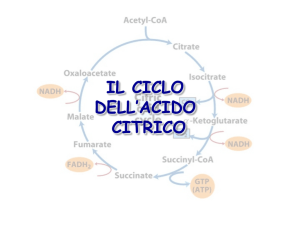
Il ciclo dell’acido citrico
Il catabolismo di proteine, grassi e
carboidrati avviene nelle tre fasi
della respirazione cellulare
Il piruvato viene ossidato ad acetil-CoA e CO2
La decarbossilazione ossidativa del piruvato per formare acetil-CoA, che avviene nei
mitocondri delle cellule eucariotiche, è il legame tra la glicolisi ed il ciclo dell’acido citrico.
La reazione è catalizzata dal complesso della piruvato deidrogenasi.
La deidrogenazione e la decarbossilazione del piruvato ad acetil-CoA coinvolgono l’azione
sequenziale di 3 enzimi diversi (ciascuno formato da più catene polipeptidiche) e di 5
coenzimi: tiamina pirofosfato (TPP), flavin adenin dinucleotide (FAD), coenzima A (CoA),
nicotinamide adenin dinucleotide (NAD) e lipoato
Struttura del coenzima A
Acido lipoico unito da un legame amidico alla catena laterale di
un residuo di Lys.
Tiamina pirofosfato
Fotografia al microscopio elettronico del complesso della
piruvato deidrogenasi di E. coli.
La conversione del piruvato in acetil CoA è costituita da tre tappe
Queste tappe devono essere accoppiate per conservare l’energia libera derivata
dalla tappa di decarbossilazione che rende possibile la formazione di NADH e di
acetil CoA.
1) Il piruvato si combina con il TPP e poi viene decarbossilato
Enzima: componente piruvato deidrogenasi (E1) del complesso multienzimatico.
L’atomo di C tra l’N e lo S dell’anello
tiazolico della TPP è più acido della
maggior parte dei gruppi =CH-
Questo gruppo si ionizza per formare
un carbanione, che si addiziona
facilmente al gruppo carbonilico del
piruvato.
1) Meccanismo della reazione di decarbossilazione di E1, il componente
piruvato deidrogenasi del complesso della piruvato deidrogenasi
1) Il carbanione del TPP si addiziona al gruppo carbonilico del piruvato
2) Questa addizione è seguita dalla decarbossilazione del piruvato
L’anello carico positivamente del TPP agisce da trappola di elettroni che stabilizza la
carica negativa generata dalla decarbossilazione. Tale carica viene trasferita all’anello.
3) La protonazione forma idrossietil-TPP
Il gruppo idrossietilico legato alla
TPP viene ossidato a formare un
gruppo acetile ed è trasferito alla
lipoamide, un derivato dell’acido
lipoico legato ad un residuo di lisina
dell’enzima
L’ossidante è il gruppo disolfuro
della lipoamide
Questa reazione è catalizzata
ancora dalla componente piruvato
deidrogenasi E1.
Il gruppo acetile viene trasferito dalla acetillipoamide al CoA per formare
Acetil CoA
Questa reazione è catalizzata dalla
diidrolipoil transacetilasi E2.
Il legame tioestere ricco di energia
viene conservato.
La forma ossidata della lipoamide viene rigenerata dalla
diidrolipoil deidrogenasi (E3)
Il
complesso
della
piruvato
deidrogenasi non è in grado di
portare a termine un altro ciclo
catalitico finchè la diidrolipoamide
non è riossidata a lipoamide
Due elettroni vengono trasferiti a
un
gruppo
prostetico
FAD
dell’enzima e poi al NAD+
(trasferimento insolito ?)
Il potenziale di trasferimento di un
elettrone del FAD viene modificato
dalla sua associazione all’enzima e
gli permette di trasferire elettroni al
NAD+.
Tappe della decarbossilazione ossidativa del piruvato ad
acetil-CoA da parte del complesso della piruvato deidrogenasi
E1= piruvato deidrogenasi
E2= diidrolipoil transacetilasi
E3= diidrolipoil deidrogenasi
Reazioni del ciclo dell’acido citrico
1) Formazione del citrato
L’atomo di carbonio metilico del gruppo acetilico si lega al gruppo
carbonilico (C2) dell’ossalacetato.
La reazione catalizzata dalla citrato sintasi è una condensazione
aldolica seguita da un’idrolisi
L’idrolisi del citril CoA fa procedere la
reazione verso la sintesi del citrato
La citrato sintasi deve
l’idrolisi di acetil CoA
impedire
Modificazioni conformazionali della citrato sintasi in seguito al
legame dell’ossalacetato
Il legame dell’ossalacetato, che avviene per primo, induce un importante
riarrangiamento strutturale che determina la creazione di un sito di legame per l’acetil
CoA
La citrato sintasi catalizza la reazione di condensazione portando i substrati molto
vicini, orientandoli e polarizzando specifici legami.
Meccanismo di sintesi del citril CoA ad opera della citrato sintasi
Il residuo His 274 dona
un protone all’ossigeno
carbonilico
dell’acetil
CoA per promuovere la
rimozione del protone
metilico
da
parte
dell’Asp 375
L’ossalacetato viene
attivato
dal
trasferimento di un
protone dall’His 320
al suo atomo di
carbonio carbonilico
Il concomitante attacco
dell’enolo dell’acetil CoA
al carbonio carbonilico
dell’ossalacetato
determina la formazione
di un legame C-C
Meccanismo di sintesi del citril CoA ad opera della citrato sintasi
Il citril CoA neoformato induce altre modificazioni strutturali dell’enzima.
Il sito attivo viene racchiuso completamente e His 274 partecipa nuovamente come
donatore di protoni per idrolizzare il tioestere
Il CoA abbandona l’enzima seguito dal citrato e l’enzima torna nella conformazione
aperta
Citrato sintasi
L’enzima dopo aver legato l’ossalacetato (in giallo) va incontro a una grande
modificazione conformazionale. In rosso un analogo stabile dell’acetil-CoA
L’enzima è in grado di idrolizzare il citril CoA ma non l’acetil CoA:
a) l’acetil CoA non si lega all’enzima finchè l’ossalacetato non è legato e
pronto alla condensazione;
b) I residui catalitici cruciali per l’idrolisi del tioestere non sono posizionati
in modo appropriato finchè non si forma il citril CoA
2) Il citrato viene isomerizzato a isocitrato
L’isomerizzazione avviene attraverso una reazione di deidratazione seguita
da una di idratazione.
Il centro Fe-S è importante sia nel legame col substrato sia nel processo catalitico
3) Ossidazione dell’isocitrato ad α-chetoglutarato e CO2.
Decarbossilazione ossidativa dell’isocitrato catalizzata dalla
isocitrato deidrogenasi
Si produce NADH
β-chetoacido instabile
4) Ossidazione dell’α-chetoglutarato a succinil-CoA e CO2.
L’energia dell’ossidazione dell’α-chetoglutarato viene conservata mediante
la formazione del legame tioestere del succinil-CoA.
Questa reazione è praticamente identica alla reazione della piruvato
deidrogenasi; il complesso dell’α-chetoglutarato deidrogenasi è molto simile
al complesso della piruvato deidrogenasi sia come struttura che come
funzione (3 Enzimi, E1, E2 e E3 e 5 coenzimi).
5) Conversione del Succinil-CoA a succinato e formazione di un
legame fosforico ad alta energia.
GTP + ADP ' GDP + ATP
Reazione catalizzata dalla nucleoside difosfochinasi
Reazione della succinil-CoA sintetasi
1) Un gruppo fosforico sostituisce il
CoA
nel
succinil-CoA
legato
all’enzima, formando un acil fosfato
ad alta energia.
2) Il succinil fosfato dona il gruppo
fosforico a un residuo di His
dell’enzima,
producendo
un
fosfoistidil-enzima ad alta energia
3) Il gruppo fosforico viene trasferito
dal residuo di His al gruppo
fosforico
terminale
del
GDP
generando GTP.
Meccanismo di reazione della succinil-CoA sintetasi
Succinil fosfato
L’enzima succinil-CoA sintetasi di E. coli.
La sequenza amminoacidica di
questo enzima nei batteri e nei
mammiferi
è
simile
e
presumibilmente è molto simile
anche la struttura tridimensionale.
Il sito attivo include parte della
subunità α (in blu) e parte della
subunità β (in marrone).
Le “eliche potenti” (in blu scuro e in
marrone scuro) avvicinano le loro
parziali cariche positive al gruppo
fosforico (in arancione) che si trova
sull’His246
della
catena
α,
stabilizzando
il
fosfoenzima
intermedio. In rosso è rappresentato
il CoA
…rigenerazione dell’ossalacetato per ossidazione del
succinato (6, 7 e 8),
6) Ossidazione del succinato a fumarato
Il FAD è l’accettore di atomi di idrogeno in questa reazione in quanto la
variazione di energia libera è troppo piccola per ridurre il NAD+.
Il FAD è strettamente legato alla succinato deidrogenasi.
La succinato deidrogenasi è il solo enzima del ciclo dell’acido citrico a essere
legato alla membrana. Gli elettroni estratti dal succinato passano attraverso
il FAD ed entrano nella catena di trasporto degli elettroni della membrana
mitocondriale interna
7) Idratazione del fumarato per produrre malato
8) Ossidazione del malato ad ossalacetato
La reazione complessiva del ciclo dell’acido citrico è:
Acetil CoA + 3 NAD+ + FAD + GDP + Pi + H2O Æ
¿ 2 CO2 + 3 NADH + FADH2 + GTP + 2 H+ + CoA
Il ciclo di Krebs opera soltanto in condizioni aerobiche poiché il NAD+ e il
FAD possono essere rigenerati nel mitocondrio soltanto dal trasferimento
degli elettroni all’ossigeno molecolare.
Il ciclo dell’acido citrico, come tutte le altre vie
metaboliche, è il prodotto dell’evoluzione, la maggior
parte della quale è avvenuta prima della comparsa degli
organismi aerobici.
Molto probabilmente i primi organismi
anaerobici usavano alcune delle reazioni
del ciclo dell’acido citrico in processi
biosintetici lineari.
Esistono moderni organismi anaerobici
che mancano dell’ α-chetoglutarato
deidrogenasi e pertanto non sono in
grado di compiere un giro completo del
ciclo dell’acido citrico.
L’α-chetoglutarato e il succinil-CoA sono
tuttavia precursori importanti di una
varietà di vie biosintetiche.
I componenti del ciclo dell’acido citrico sono importanti intermedi biosintetici
Le reazioni anaplerotiche riforniscono il ciclo dell’acido citrico di intermedi
Ruolo della biotina nella reazione della piruvato carbossilasi
Regolazione del ciclo dell’acido citrico
Il complesso della piruvato deidrogenasi è regolato allostericamente e per
fosforilazione reversibile
Il complesso della piruvato deidrogenasi è inibito dai suoi prodotti immediati, il NADH
e l’acetil CoA.
Il componente piruvato deidrogenasi è regolato anche dalla modificazione covalente;
una chinasi specifica fosforila e inattiva la piruvato deidrogenasi, e una fosfatasi attiva
la deidrogenasi rimuovendo il gruppo fosforico.
L’aumento del rapporto NADH/NAD+, acetil CoA/CoA o ATP/ADP promuove la
fosforilazione e quindi l’inattivazione del complesso.
La piruvato deidrogenasi è inattiva quando la carica energetica è elevata e gli intermedi
biosintetici sono abbondanti.
Il ciclo dell’acido citrico è regolato in più punti.
La velocità del ciclo dell’acido citrico è
regolata con precisione in modo da
soddisfare il fabbisogno di ATP di una
cellula animale.
I punti di regolazione primari sono gli
enzimi allosterici isocitrato deidrogenasi e
α-chetoglutarato deidrogenasi.
Il ciclo del gliossilato
Il ciclo del gliossilato
Nelle piante ed in alcuni
invertebrati e microorganismi
l’acetato può servire sia come
fonte di energia che come
precursore per la sintesi dei
carboidrati.
La reazione complessiva del ciclo del gliossilato è:
2 Acetil CoA + NAD+ + 2 H2O Æ Succinato + 2 CoA + NADH + H+
PEP carbossichinasi
Ossalacetato + GTP Æ Fosfoenolpiruvato + CO2 + GDP
Via gluconeogenetica
Nelle piante, gli enzimi del ciclo del gliossilato sono sequestrati all’interno di
organelli circondati da membrana detti gliossisomi.
Relazioni tra il ciclo del gliossilato e il ciclo dell’acido citrico
Le reazioni del ciclo del gliossilato
(nei
gliossisomi)
procedono
simultaneamente con quelle del
ciclo dell’acido citrico (nei
mitocondri), e gli intermedi
passano attraverso il citosol a
questi due compartimenti.
La conversione del succinato a
ossalacetato è catalizzata dagli
enzimi del ciclo dell’acido citrico.
Mediante la combinazione di queste due vie metaboliche le piante in germinazione sono
in grado di convertire gli atomi di carbonio dei lipidi dei semi in glucosio.
Il ciclo del gliossilato e il ciclo dell’acido citrico sono regolati in modo coordinato
Il ciclo dell’acido citrico e il ciclo del gliossilato
competono per l’isocitrato.
Quando i livelli di ATP sono elevati l’isocitrato
deidrogenasi
viene
inattivata
mediante
fosforilazione e l’isocitrato viene incanalato nel
ciclo del gliossilato per la formazione di
intermedi per la biosintesi.