Gli enzimi
Gli enzimi sono le proteine1 che catalizzano2
l reazioni
le
i i chimiche
hi i h che
h avvengono neii
sistemi biologici
1con
2Un
l’eccezione
l eccezione dei ribozimi (RNA catalitici)
catalizzare è una sostanza che promuove una reazione chimica senza
subire alcuna modificazione permanente
Proprietà
p
generali
g
delle reazioni
catalizzate dagli enzimi
• Elevate velocità di reazione (106-10
1012 volte
lt
maggiori rispetto a quella delle reazioni non
catalizzate
t li
t )
• Avvengono
g
in condizioni più
p moderate
• Maggiore specificità di reazione
• Sono
S
spesso soggette
tt a regolazione
l i
Specificità di substrato
• Gli enzimi sono stereospecifici
• Sono selettivi riguardo l’identità chimica
d i lloro substrati
dei
b t ti ((specificità
ifi ità geometrica)
ti )
Il grado di specificità geometrica può tuttavia
variare
ariare considerevolmente
considere olmente
Enzimi in biotecnologie
Specificità di substrato
Complementarità tra sito attivo e substrato
Modello Chiave
Chiave-serratura
serratura
(Fisher 1894)
Adattamento indotto
((Koshland 1958))
I catalizzatori aumentano la
velocità della reazione abbassando
ll’energia
energia di attivazione
I catalizzatori non
modificano gli equilibri
chimici
hi i i delle
d ll reazioni
i i
Meccanismi di catalisi:
1) Catalisi acido-basica
• La catalisi acida generale è un processo in
p
di un
cui il trasferimento temporaneo
protone da un acido abbassa l’energia
libera dello stato di transizione di una
reazione
• Si
S parla di catalisi basica generale se la
velocità di reazione viene accelerata dalla
sottrazione temporanea di un protone da
parte di una base
L
L’attività
di questi
q
enzimi
m è
fortemente influenzata dal pH
Catalisi acido
acido-basica
basica
RNasiA
RNasi A
Meccanismo catalitico dell’RNasi
dell RNasi A
Meccanismo catalitico dell’RNasi
dell RNasi A
Meccanismi di catalisi:
2) C
Catalisi
t li i covalente
l t ((nucleofilica)
l fili )
La catalisi covalente coinvolge la
f
formazione
i
di un llegame covalente
l t
transitorio tra l’enzima e il substrato
H 2O
A-B → A + B
H2O
A-B + X: → A-X + B → A+X: + B
Catalisi covalente (o nucleofilica)
Gruppi nucleofilici ed elettrofilici
Meccanismi di catalisi:
3) Catalisi favorita da ioni metallici
Effetti di prossimità e orientamento
• Gli enzimi che catalizzano
reazioni a più substrati agiscono
mettendo i substrati in contatto tra
loro
• Gli enzimi legano i loro substrati
secondo un orientamento
appropriato in modo da favorire la
reazione
• Gli enzimi stabilizzano i movimenti
relativi traslazionali e rotazionali
dei loro substrati e dei loro gruppi
catalitici
Orientamento del substrato
2O2- + 2 H
+
H2O2 + O2
Cu,Zn superoxide
p
dismutases
Cu2+ + O2-
Cu+ + O2
Cu+ + O2- + 2 H+
C
2 + H O
Cu2+
C
2 2
2 O2- + 2H+
O2 + H2O2
O2O2-
O2-
O2-
O2-
- Glu 131
Thr 5624
5
Å 10
Å
Å
Arg 141
+
Thr 135
4Å
+
Cu
Cu
O2-
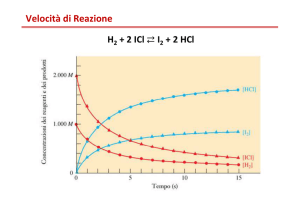
Cinetica enzimatica
Velocità delle reazioni chimiche:
1) Reazioni di primo ordine
A→B
V=d[B]/dt
V
d[B]/dt oppure V=
V -d[A]/dt
d[A]/dt
V= d[B]/dt = -d[A]/dt = k1[A]
K= Costante di velocità
Integrando
g
s-1
ln[A]
[ ] º/[A]=k
[ ] 1t
oppure[A]/[A]º=e-k1t
k1
[A] [B]
k-11
-V=d[A]/dt=-k1[A]+k-1[B]
0=-k1[A]eq+k-1[B]eq
[B]eq/[A]eq=kk1/k-11=K
K
(costante di equilibrio)
Reazioni di secondo ordine
k1
2A→B
2
V=d[B]/dt=k
[ ]
[A]
[
]
2
((mol/L)s
) -1
Cinetica della catalisi enzimatica
k1 k2
E +S ES P + E
k-1
v=d[P]/dt= k2[ES]
d[ES]/dt=k1[E][S]-k-1[ES]-k2[ES]
Cinetica della catalisi enzimatica
L’equazione
q
di Michaelis-Menten
k1
k2
E +S ֎ES ֎ P + E
v=d[P]/dt= k2[ES]
k-1
Se [S]>>[E]
allora d[ES]/dt=0
[E]T= [E]+ [ES] oppure [E]=[E]T-[ES]
v0= k2 [ES]
d[ES]/dt=k1[E][S]-k-1[ES]-k2[ES]
k1[E][S] =k-1[ES] + k2[ES]
([E]T-[ES])[S]/[ES]= (k-1+ k2)/k1=KM
KM[ES]=([E]T-[ES])[S]
[ES]=[E]T[S]/ KM+[S]
v°=k2[E]T[S]/ KM+[S]
Vmax=k2[E]T
v°= Vmax[S]/ KM+[S]
Equazione di Michaelis Menten
Se v°=1/2 Vmax
allora
KM=[S]
E’ possibile definire la costante catalitica di un
enzima, kcat, come:
Kcat=Vmax/[E]
Vmax/[E]T
Questa costante misura la velocità del processo
catalitico (il numero delle molecole di substrato
trasformate in un secondo) ed è detta anche
numero di turnover
v°= Vmax[S]/ KM+[S]
1/V0= KM/ V
Vmax[S]
[ ] + 1/V
1/Vmax
Inibizione irreversibile