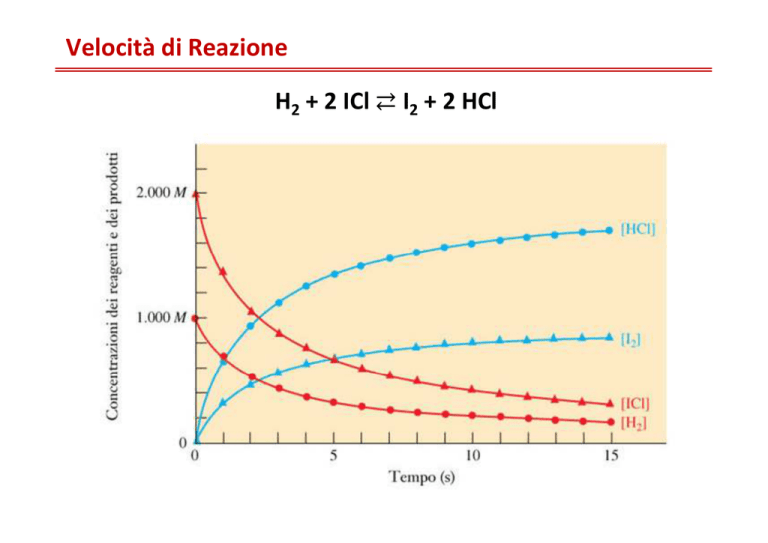
Velocità di Reazione
H2 + 2 ICl ⇄ I2 + 2 HCl
Cinetica Chimica
• ci dice se una reazione avviene spontaneamente.
• È indispensabile però sapere anche quanto impiega una
reazione a raggiungere il proprio stato di equilibrio.
• Spontaneità e velocità non hanno nessuna correlazione
tra loro.
• Esistono reazioni molto spontanee e molto lente, oppure
reazioni poco spontanee che raggiungono l’equilibrio
velocemente.
Velocità di Reazione
Velocità di Reazione
→ Velocità di Reazione
La legge cinetica della reazione è:
× × • = costante cinetica della reazione
(dipende dalla natura della reazione).
• = ordine di reazione rispetto ad A.
• = ordine di reazione rispetto a B.
• = ordine complessivo della reazione.
• In generale l’ordine di reazione non corrisponde ai coefficienti
stechiometrici ma suggerisce il meccanismo di reazione.
Il Meccanismo di Reazione
• Il meccanismo di reazione è il modo dettagliato - a livello
molecolare - con cui i reagenti si combinano per dare
i prodotti e determina la velocità di reazione.
• In generale una reazione avviene attraverso uno
o più passaggi intermedi - detti anche processi elementari che ne descrivono il meccanismo.
→ → → Energia di Attivazione
• Modello teorico: teoria delle collisioni.
• Per poter reagire due particelle devono collidere tra loro.
• Si avrà reazione solo se le particelle collidenti possiedono una
energia maggiore di un valore minimo detto energia di
attivazione. In questo caso si parla di urto efficace.
Energia di Attivazione
• Modello teorico: teoria delle collisioni.
• Un urto efficace non dipende solo dall’energia ma anche
dall’orientazione dei reagenti.
• Ci deve essere sovrapposizione fra due orbitali di frontiera
delle due molecole incidenti.
Urti Efficaci e Non Efficaci
Urti Efficaci e Non Efficaci
Energia di Attivazione e Coordinata di Reazione
L’energia di attivazione
si riferisce al percorso
più favorevole della reazione,
indicato dalla coordinata
di reazione.
Energia di Attivazione e Coordinata di Reazione
Equazione di Arrhenius
• Esprime la dipendenza della costante cinetica rispetto alla temperatura:
×
!"
#$
• = fattore di frequenza o fattore di Arrhenius.
• La velocità di reazione aumenta con la temperatura.
• L’energia di attivazione non dipende dalla temperatura,
ma dalla natura della reazione.
Equazione di Arrhenius
Reazione Multistadio
Intermedi di Reazione e Stati di Transizione
Intermedio = specie chimica capace di esistenza reale
ed autonoma.
I due massimi corrispondono alla formazione di due complessi
attivati (o stati di transizione), mentre il minimo tra essi
corrisponde alla formazione dell’intermedio, che ha energia
minore rispetto ai complessi attivati.
Intermedi di Reazione e Stati di Transizione
Catalisi
• Catalizzatore = sostanza che aumenta la velocità
di raggiungimento dell’equilibrio.
• L’uso di catalizzatori non comporta variazioni allo stato
di equilibrio. Quindi non agisce sullo stato iniziale e finale
della reazione.
• Il catalizzatore si ritrova inalterato alla fine della reazione.
• Il catalizzatore fa percorrere alla reazione un percorso diverso
da quello che sarebbe spontaneo e che implica una energia di
attivazione minore.
Catalisi
Tipi di Catalisi
• Catalisi eterogenea quando il catalizzatore è in una fase
diversa da reagenti e prodotti (es. solido per reazioni
gassose).
• Catalisi omogenea quando il catalizzatore è nella stessa fase
di reagenti e prodotti.
• Catalisi enzimatica quando il catalizzatore è una proteina, che
in questo caso viene detta enzima.
Catalisi Enzimatica
Velocità di Reazione
La legge cinetica della reazione è:
× × • = costante cinetica della reazione
(dipende dalla natura della reazione).
• = ordine di reazione rispetto ad A.
• = ordine di reazione rispetto a B.
• = ordine complessivo della reazione.
• In generale l’ordine di reazione non corrisponde ai coefficienti
stechiometrici ma suggerisce il meccanismo di reazione.
Determinazione dell’Ordine di Reazione
→ %&''(
× • Se )
• Se • Se ⇒
⇒
⇒
la reazione è di ordine zero.
la reazione è di primo ordine.
la reazione è di secondo ordine.
Integrazione delle Leggi di Velocità: Ordine Zero
+
)
+
) ,)
)
)
Se: )
⇒
½ )
tempo di dimezzamento
Integrazione delle Leggi di Velocità: Primo Ordine
+
)
+ ) ,)
;
.
)
Se: )
)
⇒
½ .01
tempo di dimezzamento
Integrazione delle Leggi di Velocità: Secondo Ordine
+
)
+ ) ,)
;
)
)
Se: )
⇒
½ )
tempo di dimezzamento
Integrazione delle Leggi di Velocità
A parità di valore numerico della costante cinetica,
maggiore è l’ordine di reazione, tanto più lentamente
procede la reazione.
Integrazione delle Leggi di Velocità: Secondo Ordine
→ 23435 ;
)≠ )
)
7 ;
)
7
)7
7
)
7
)
7
Integrando fra 7) ) e 7 e fra ) ) e si ottiene:
) )
.
)
)
7
)7
)
Integrazione delle Leggi di Velocità: Casi Complessi
Reazioni consecutive del primo ordine:
:;
:<
→8→9
Sistema di equazioni differenziali:
Integrazione delle Leggi di Velocità: Casi Complessi
Reazioni consecutive del primo ordine:
:;
:<
→8→9
Dopo l’integrazione:
)
)
0
)
1
Integrazione delle Leggi di Velocità: Casi Complessi
Integrazione delle Leggi di Velocità: Casi Complessi
Reazioni di primo ordine all’equilibrio:
:;
⇄8
:
;
Equazione differenziale:
Dopo l’integrazione:
=
0 =
0
)
0 )
= 10
= 1
) 1/0 0 > ? 1
0 > ? 1
1
1
Integrazione delle Leggi di Velocità: Casi Complessi
Se A Integrazione delle Leggi di Velocità: Casi Complessi
Se B Integrazione delle Leggi di Velocità: Casi Complessi
Reazioni di primo ordine all’equilibrio:
:;
⇄8
:
;
Solo in questo caso e se il sistema si comporta in maniera ideale:
=
=
Integrazione delle Leggi di Velocità: Casi Complessi
Reazioni di primo ordine all’equilibrio:
:;
⇄8
:
;
All’equilibrio, la velocità della reazione diretta è uguale
alla velocità della reazione inversa:












