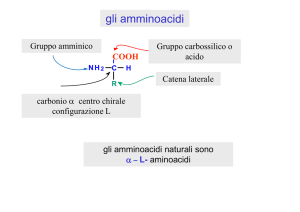
α-­‐Amminoacidi Amminoacido: composto che possiede un gruppo carbossilico e un gruppo amminico α-­‐Amminoacido: il guppo amminico è in posizione a rispe8o al carbossile COOH
α CH-NH2
R
reazione acido-­‐base COO
zwi8erione α CH-NH3
R
Zwi8erione:un composto neutro nel suo complesso ma che presenta una separazione di carica, in pra<ca è un sale interno Stereochimica degli α-­‐amminoacidi COO
H
NH3
R
SERIE D COO
H3N
H
R
SERIE L Gli α-­‐amminoacidi naturali appartengono alla serie L (L’unico amminoacido non chirale è la glicina R = H) Proprietà acido-­‐base In generale, H2O a pH fisiologico (intorno a 7) gli amminoacidi sono in forma zwi<erionica e possono agire sia da acido (donatore di protoni tramite il gruppo NH3+) che da base (acce<ore di protoni tramite il gruppo COO-­‐). Sostanze di questo Gpo si chiamano ANFOTERI. COO
H3N
La catena laterale R conferisce a ciascun amminoacido delle proprietà diverse H
R
Alcuni α-­‐amminoacidi comuni COO
H
NH3
COOH
+
H3O+
H
NH3
R
R
COO
COO
H
NH3
R
+
HO-
H
NH2
+
+
H2O
H2O
R
Generalmente a pH intorno 7 (pH fisiologico) gli amminoacidi sono degli zwi<erioni Reazione acido-­‐base della catena laterale +H
COO-
3N
NH3
+
pKa (NH3+ cat. lat) = 10.53 gruppo amminico protonato HOOC
COOH
pKa (-­‐COOH cat. lat) = 3.86 NH3+
gruppo carbossilico protonato amminoacido (stru8. a pH fisiol.) pKa (α-­‐COOH) COO-
glicina
pKa (α-­‐NH3+) pKa cat. Lat. pI 2.35
9.78
6.06
2.35
9.87
6.11
2.10
9.82
3.86
2.98
2.10
9.47
4.07
3.08
2.18
8.95
10.53
9.74
NH3+
COO-
alanina
NH3+
acido
aspartico
-OOC
COONH3+
acido
glutammico
-OOC
COONH3+
lisina
+H
3N
COONH3+
Punto Isole8rico pI Al pH=pI la molecola è uno zwi8erione, la sua carica complessiva è 0 COOH
H
NH3
R
COO
H3O+
H
NH3
COO
HO-
H
R
R
pH << pI (ambiente acido) pH = pI NH2
(ambiente basico) Il pI dipende dalla stru8ura molecolare Calcolo del pI Molecole che non hanno gruppo acidi o basici pI = [pKa(α-­‐COOH) + pKa(α-­‐NH3+)]/2 Molecole che hanno un gruppo amminico nella catena laterale pI = [pKa(α-­‐NH3+) +pKa (NH3+cat. lat) ]/2 Molecole che hanno un gruppo –COOH nella catena laterale pI = [pKa(α-­‐COOH) + pKa (COOH cat. lat)]/2 Se nella catena laterale ci sono Se nella catena laterale ci sono (-­‐COOH) Ele8roforesi Più alta è la carica maggiore è la velocità di migrazione. A parità di carica migra più velocemente la molecola con PM più piccolo Legame pep<dico (Legame ammidico) Isomero trans è favorito Un tripep<de Il legame ammidico ha un parziale cara8ere di doppio legame O
R
O
O
N
H
H
R
N
H
H
R
N
H
H
NB: l’azoto delle ammidi è ibridato sp2 e NON è basico; esiste una barriera rotazionale intorno al legame C-­‐N di circa 15-­‐20 kcal/mol Isomero trans è favorito La trasformazione di un legame ammidico dalla forma TRANS alla cis può avere conseguenze importanG dal punto di vista biologico Stru8ura ad α-­‐elica (la catena polipepGdica è avvolta a spirale) Conformazione β a foglie8o pieghe8ato La catene polipepGdiche possono disporsi in maniera parallela o anGparallela