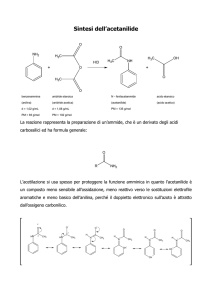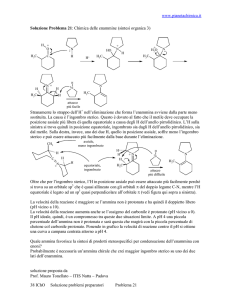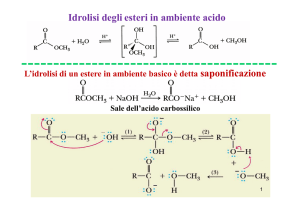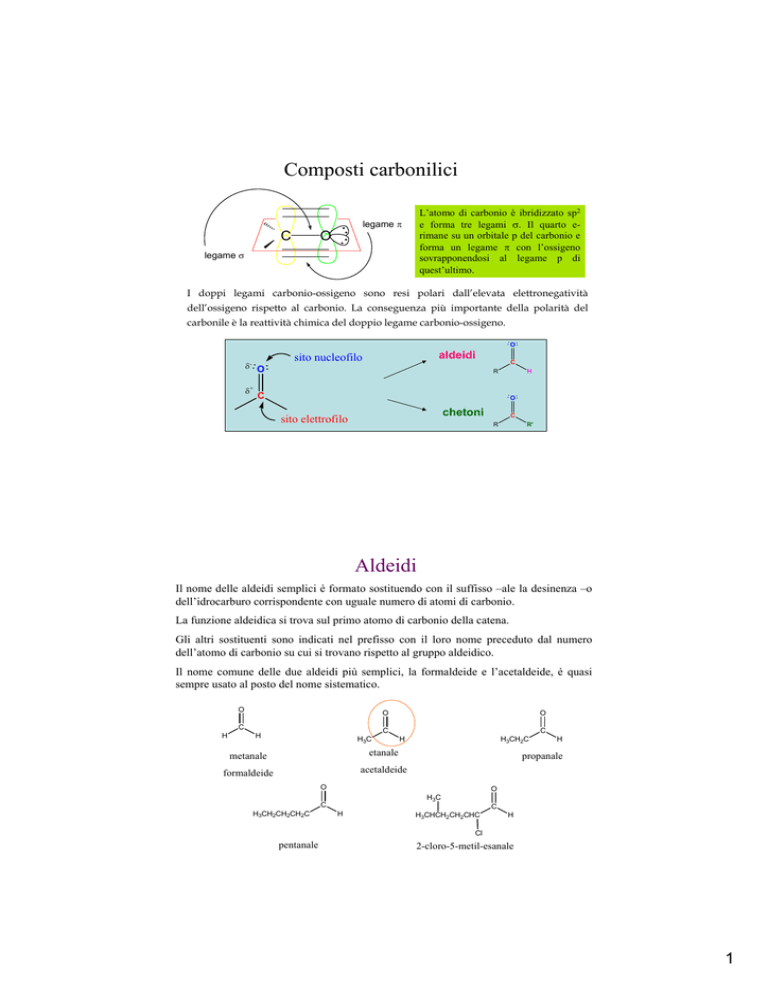
Composti carbonilici
C
L’atomo di carbonio è ibridizzato sp2
e forma tre legami σ. Il quarto erimane su un orbitale p del carbonio e
forma un legame π con l’ossigeno
sovrapponendosi al legame p di
quest’ultimo.
legame π
O
legame σ
I doppi legami carbonio-ossigeno sono resi polari dall’elevata elettronegatività
dell’ossigeno rispetto al carbonio. La conseguenza più importante della polarità del
carbonile è la reattività chimica del doppio legame carbonio-ossigeno.
O
δ- O
+
δ
aldeidi
sito nucleofilo
C
R
H
C
O
chetoni
sito elettrofilo
C
R
R'
Aldeidi
Il nome delle aldeidi semplici è formato sostituendo con il suffisso –ale la desinenza –o
dell’idrocarburo corrispondente con uguale numero di atomi di carbonio.
La funzione aldeidica si trova sul primo atomo di carbonio della catena.
Gli altri sostituenti sono indicati nel prefisso con il loro nome preceduto dal numero
dell’atomo di carbonio su cui si trovano rispetto al gruppo aldeidico.
Il nome comune delle due aldeidi più semplici, la formaldeide e l’acetaldeide, è quasi
sempre usato al posto del nome sistematico.
O
O
C
H
O
C
H
H3C
C
H
metanale
etanale
formaldeide
acetaldeide
H3CH2C
O
O
H3C
C
H3CH2CH2CH2C
H
propanale
H
C
H3CHCH2CH2CHC
H
Cl
pentanale
2-cloro-5-metil-esanale
1
Se il gruppo aldeidico è presente come sostituente su un anello, si usa nel nome il suffisso –
carbaldeide. In questo caso, l’atomo di carbonio del carbonile non viene contato nell’assegnare il
nome alla porzione idrocarburica della molecola.
O
C
H
H3C
CH
O
Cicloesancarbaldeide
trans-2-metilciclopentancarbaldeide
Si indica solitamente con il nome di benzaldeide il derivato del benzene che porta un gruppo
aldeidico. Un secondo sostituente sull’anello aromatico può occupare tre differenti posizioni rispetto
al gruppo aldeidico:
•se il secondo sostituente si trova sull’atomo di carbonio 2 dell’anello, è detto orto (o-) rispetto al
gruppo carbonilico;
•se si trova sul carbonio 3, è in meta (m-);
•se sul carbonio 4 è in para (p-).
6
5
O
O
C
C
H
1
4
2
O
C
H
O
H
Br
3
NO2
benzaldeide
o-bromobenzaldeide
C
H
H3CH2C
m-nitrobenzaldeide
p-etilbenzaldeide
CHETONI
I chetoni sono denominati sostituendo la desinenza –o dell’idrocarburo con lo stesso
numero di atomi di carbonio con il suffisso –one e precisando con un numero la
posizione del carbonile nella catena. Per gli altri sostituenti si usano gli opportuni
prefissi, preceduti da numeri che ne indicano la posizione.
H3C
O
O
C
C
CH3
propanone
acetone
H3CH2CHC
O
CH2CH2CH3
H3CH2C
C
CH2CH3
Br
3-bromo-4-eptanone
3-pentanone
In alcuni casi può essere conveniente denominare i gruppi organici che sono presenti
come sostituenti sul carbonile, che viene quindi designato con la parola chetone.
O
O
CCH3
cicloesanone
ciclopentilmetilchetone
Cl
O
2-clorociclopentanone
2
I chetoni che hanno il gruppo fenile direttamente legato al carbonile si indicano
solitamente con il suffisso fenone.
O
C
O
C
CH3
acetofenone
benzofenone
O
C
O
CH2CCH3
CH2CH3
1-fenil-1-propanone
1-fenil-2-propanone
etilfenilchetone
benzilmetilchetone
propiofenone
Scrivere i nomi IUPAC per i seguenti composti
O
CHO
O
a.
b.
c.
H
a. La catena più lunga contenente il gruppo carbonilico ha cinque carboni. Il nome IUPAC è 2etil-3-metilpentanale;
b. Il nome IUPAC è 3-metil-2-cicloesenone;
c. Il nome IUPAC è 2-metibenzaldeide.
3
Scrivere la formula di struttura di tutti i chetoni di formula molecolare C6H12O
ed assegna ad ognuno il nome IUPAC. Quali di questi chetoni sono chirali?
3-esanone
2-esanone
O
O
O
O
4-metil-2-pentanone
O
O
stereocentro
2-metil-3-pentanone
3-metil-2-pentanone
3,3-dimetil-2-butanone
Solo il 3-metil-2-pentanone ha uno stereocentro ed è chirale.
OSSIDAZIONE DEGLI ALCOLI AD ALDEIDI E CHETONI
L’ossidazione degli alcoli a composti carbonilici è eseguita con ossidanti a base di Cr6+, che
nei prodotti sono ridotti a Cr3+:
• CrO3, Na2CrO7 e K2Cr2O7 sono ossidanti energici, non selettivi usati in soluzioni acquose
acide (H2SO4 + H2O);
• PCC (clorocromato di piridinio), solubile nei solventi organici alogenati, può essere usato
anche in assenza di acidi forti tanto da costituire un agente ossidante più blando e più
selettivo.
ALCOLI 1° → ALDEIDI
ALCOLI 2° → CHETONI
R
O
R
OH
H
R
Cr
+
O
O
O
R
R
OH
H
Cr
O
O
H
O
O
R
Cr
OH
O
H2O
L’attacco nucleofilo dell’alcol sul metallo elettrofilo seguito
dal trasferimento protonico forma un estere cromico.
R
O
R
+
Una base rimuove
un protone e la
coppia elettronica
del legame C-H
OH3 forma il nuovo
legame C=O.
4
RIDUZIONE DELLE ALDEIDI E DEI CHETONI CON IDRURI METALLICI
Il trattamento di un’aldeide o un chetone con NABH4 o LiAlH4, seguito dal trattamento
con acqua o un’altra fonte di protoni, produce un alcol.
ALDEIDE
ALCOL 1°
O
H3CH2C
O
H
H
H3CH2C
H
OH
OH
H
H
H3CH2C
H
H
AlH3
n-propanolo
propanaldeide
CHETONE
ALCOL 2°
O
H3CH2C
O
CH3
H
H3CH2C
H
OH
OH
CH3
H3CH2C
H
CH3
H
BH3
2-butanolo
2-butanone
N.B. La riduzione converte un carbonio carbonilico planare ibridato sp2 in un carbonio tetraedrico ibridato
sp3. Ne consegue che quando si forma un nuovo centro stereogenico la riduzione dà origine ad una miscela
racemica di due alcoli.
Quale alcol si forma quando ciascuno dei seguenti composti è trattato con NaBH4 in CH3OH?
O
O
c.
b.
a.
H
O
Quale composto carbonilico è necessario per preparare ciascuno dei seguenti alcoli per
riduzione con idruri metallici?
HO
OH
OH
a.
b.
c.
5
ADDIZIONE DI IONE CIANURO → SINTESI DELLE CIANIDRINE
O
O
CN
+
C
NC
H3C
CH2CH3
H3C
OH
H
CH2CH3
NC
H3C
CH2CH3
Proporre un meccanismo per la sintesi dell’1-idrossicicloesancarbonitrile
CN
HO
1-idrossicicloesancarbonitrile
O
HO
CN
O
CN
H
+
CN
LA RIDUZIONE DI WOLFF-KISHNER
Se un chetone o un aldeide sono riscaldati in una soluzione basica di idrazina, il gruppo
carbonilico è trasformato in gruppo metilenico. Il processo è chiamato deossigenazione
perché viene rimosso un ossigeno dal reagente.
O
H2N
CH3
H2
C
NH2
CH3
OH, ∆
H
O
N
HN
CH3 2
NH2
C
N
H
H
CH3
N
OH
C
H
N
N
CH3
C
N
CH3
H
OH
H
OH
N
H
H2
C
CH3
OH
H
C
CH
CH3
+
N2
N
CH3
6
L’addizione nucleofila dei reattivi di Grignard: la formazione di alcoli
Il carattere nucleofilo dei reattivi di Grignard si deve all’essere il legame carboniomagnesio fortemente polare, con una elevata densità elettronica sul carbonio. Ne
viene che questi composti reagiscono come se fossero carbanioni.
+
H3C
δ+
δ+
δ-
O
H3C
O- MgBr
OH
H+
MgBr
H2O
H
H3C
H3C
CH3
H
H
CH3
acetaldeide
2-propanolo
(alcol secondario)
N.B. l’entità dell’alcol formantesi dipende dall’entità del composto carbonilico iniziale:
1.
alcoli primari si formano per reazione dei reattivi di Grignard con il metanale
(formaldeide);
2. alcoli secondari per reazione dei reattivi di Grignard con aldeidi diverse dal metanale;
3. alcoli terziari per reazione dei reattivi di Grignard con chetoni
δ+
δ-
O
+ H3CH2C
δ+
H
O- MgBr
MgBr
H2O
H
H
H
H
CH2CH3
formaldeide
δ-
+ H3CH2C
δ+
CH2CH3
2-butanone
CH2CH3
H
alcol primario
O
H3C
OH
H+
δ+
O- MgBr
MgBr
OH
H+
H2O
H3C
H3CH2C
CH2CH3
H3C
H3CH2C
CH2CH3
alcol terziario
7
Esercizio: Sintetizzare il seguente alcol mediante addizione nucleofila di reattivi di Grignard.
OH
Essendo l’alcol da sintetizzare un alcol terziario, la reazione di Grignard ha luogo tra un
chetone ed un opportuno reattivo di Grignard. Esistono tre possibilità:
1.
OH
O
δ-
O- MgBr
δ+
+ H3CH2CH2C
H2O
CH2CH2CH3
δ+
OH
O
δ
O- MgBr
δ+
δ-
+
2.
OH
H+
MgBr
H3CH2C
H 2O
H3CH2C
O
δ-
OH
+
H3C
O- MgBr
δ+
H+
MgBr
OH
H2O
δ+
3.
OH
H+
MgBr
+
H3C
Esercizio: Sintetizzare il seguente alcol partendo da un opportuno composto carbonilico ed un
reattivo di Grignard.
OH
1-fenilbutan-2-olo
Essendo l’alcol da sintetizzare un alcol secondario, la reazione di Grignard ha luogo tra un
aldeide (diversa dal metanale) ed un opportuno reattivo di Grignard. Esistono due possibilità:
1.
OH
O
+
δ
δ-
H
+
H3CH2C
O-MgBr
δ+
MgBr
CH2CH3
H+
H2O
1-fenilbutan-2-olo
2.
O-MgBr
CH2CH3
OH
O-MgBr
O
δ+
1-fenilbutan-2-olo
δ-
H
+
δ+
CH2MgBr
C
H2
H+
O-MgBr
H2O
8
L’addizione nucleofila di alcoli: la formazione degli acetali
Le aldeidi e i chetoni reagiscono con gli alcoli in presenza di catalizzatori acidi
fornendo gli acetali e i chetali.
O
OH
H+
H3C
H
OH
OH
O
H3C
H3 C
H
H3C
H
CH3
H3C
H
O
H
H
la protonazione dell'ossigeno
carbonilicopolarizza fortemente il
carbonile
OH2
I STEP: Sintesi di emiacetali
OH
H3C
OCH3
H
emiacetale
OH2
H
OH
H
H
H+
H3C
H3C
H3C
H
OCH3
H3 C
H
CH3
O
O
OCH3
H
OCH3
O
H
H3 C
OCH3
H
emiacetale
II STEP: Sintesi degli acetali
OCH3
H3 C
H
OCH3
acetale
9
Esercizio: Mostrare la struttura dell’acetale che si ottiene dalla reazione acidocatalizzata tra 2-pentanone e propan-1,3-diolo
O
+
H3C
H+
CH2CH2CH3
O
OH
H+
H3C
OHCH2CH2CH2OH
OH
O
H
CH2CH2CH3
H3C
CH2CH2CH3 H3C
CH2CH2CH2OH
CH2CH2CH3
OH
OH
CH2CH2CH2OH
H3C
H3CH2CH2C
O
H3C
H3CH2CH2C
H
OCH2CH2CH2OH
OH2
continua
OH2
OH
- H2O
H+
H3C
H3CH2CH2C
OCH2CH2CH2OH
H3C
H3CH2CH2C
OCH2CH2CH2OH
H
H3C
H3C
H3CH2CH2C
OCH2CH2CH2OH
H3C
O
CH2
O
CH2
O
CH2
- H+
CH2
H3CH2CH2C
O
CH2
CH2
H3CH2CH2C
10
Esercizio: Identificare il composto carbonilico e l’alcol necessari alla formazione del seguente
acetale:
H3C
O
H3CH2C
O
CH3
CH3
Descrivere il meccanismo di reazione.
Nel corso della reazione la funzione carbonilica è dapprima trasformata in funzione alcolica
(emiacetale) poi completamente persa per perdita di acqua e formazione di un carbocatione
intermedio. Le due funzioni eteree dunque derivano da due alcoli legati successivamente nella
sintesi dell’emiacetale prima e dell’acetale poi.
O
H3C
O
H3CH2C
O
CH3
H3C
H3C
OH
H3C
H+
+
OH
H3CH2C
CH3
CH3
O
CH3
H+
emiacetale
+
H3C
H3C
O
H3CH2C
O
CH3
OH
CH3
Completa il meccanismo…
Esercizio: Identificare il composto carbonilico e l’alcol necessari alla formazione del seguente
acetale:
H3C
O
H2CH2C
O
CH2
CH2
Soluzione
H3C
O
H2CH2C
O
CH2
CH2
L’acetale ciclico prende origine da un composto carbonilico e un
diolo. In questo caso:
O
H+
+
H3 C
OHCH2CH2OH
CH2CH2
Descrivi il meccanismo di reazione…
11
CONDENSAZIONE ALDOLICA
O
La reazione aldolica è una
condensazione carbonilica
che avviene tra due molecole
di aldeide o di chetone o tra
un aldeide ed un chetone. La
reazione si realizza in due
passaggi:
O
+
H3C
CH3
H3C
La base strappa un atomo di idrogeno
acido dal C-α di un composto carbonilico
fornendo lo ione enolato.
H
O
O
H
H3C
H3C
C
H2
1.Addizione nucleofila;
O
OHCH2
H3C
CH2
ione enolato
2.α-sostituzione.
Un reagente carbonilico
(donatore) è trasformato
dalla base in ione enolato
nucleofilo che si addizionaH3C
al
carbonio
carbonilico
elettrofilo di una seconda
molecola
reagente
(accettore). La molecola
donatrice
subisce
un’αsostituzione, la molecola
accettrice
un’addizione
nucleofila.
O
O
O
O
O
H
+
CH2
H3C
H3C
H
C
H2
H
CH3
O
OH
H
H3C
C
H2
H
CH3
aldolo
OHO
H3C
H
OH
O
C
H
CH3
H3C
enone α,β-insaturo
C
H
H
CH3
O
H3C
OH
C
H
H
CH3
Esercizio: Sintetizzare il seguente enone α,β-insaturo
O
H2C
H
C
H
CH2CH3
L’enone α,β-insaturo è il prodotto di una reazione di condensazione carbonilica. Un reagente
carbonilico è trasformato dalla base in ione enolato nucleofilo che si addiziona al carbonio
carbonilico elettrofilo della seconda molecola reagente.
Come riconosco il composto carbonilico che funge da nucleofilo?
Il composto carbonilico che funge da nucleofilo conserva la funzione carbonilica in tutto il
decorso di reazione. La base infatti asporta un protone acido dal carbonio in α alla funzione
carbonilica.
E quello che funge da elettrofilo?
Il composto carbonilico che funge da elettrofilo perde la funzione carbonilica per attacco dello
ione enolato nucleofilo. La funzione carbonilica è così trasformata in funzione alcolica (aldolo).
Per successiva catalisi e riarrangiamento elettronico prende origine il doppio legame
12
Da quanto detto è chiaro che la molecola prodotto deve essere divisa come segue:
O
H
H2C
C
H
CH2CH3
elettrofilo
nucleofilo
Il decorso di reazione è:
O
O
+
H2C
CH3
H3CH2C
H
O
O
H2C
O
OH-
H
H2C
C
H2
CH2
H2C
CH2
ione enolato
O
O
O
O
O
H
+
H2C
CH2
H3CH2C
H
H2C
C
H2
O
OH
H
H
CH2CH3
H2C
C
H2
H
CH2CH3
aldolo
OHO
H2C
H
C
H
O
CH2CH3
H2C
OH
C
H
H
CH2CH3
O
H2C
OH
C
H
H
CH2CH3
enone α,β-insaturo
13
Esercizio: Mostra come si
prepara il seguente composto
mediante
reazione
aldolica
intramolecolare.
O
O
OH
H
H
H
H
O
O
O
O
O
H
H
H
H
O
O
O
H
H
OH
OH
OH
OH
H
O
H
H
O
O
H
O
14