Chimica Inorganica II con laboratorio
•
Docente: Eugenio Garribba
•
CFU: 5+2
•
Modalità d’esame: esame orale sul programma del corso
•
Relazioni: da consegnare una settimana prima dell’esame
•
Materiale: "Chimica inorganica: principi, strutture, reattività”
J. E. Huheey, E. A. Keiter, R. L. Keiter
Piccin
“Chimica inorganica”
J. D. Lee
Piccin
“Chimica inorganica”
P. Atkins, T. Overton, J. Rourke, M. Weller, F. Armstrong
Zanichelli
Lucidi presentati a lezione
Articoli di riviste scientifiche
Journal of Chemical Education
Programma del corso
•
Elementi di transizione
Configurazioni elettroniche. Proprietà generali. Principali stati di ossidazione. Andamento
delle proprietà principali (dimensioni, potenziali di ionizzazione, etc.).
•
Chimica di coordinazione
Chimica di coordinazione: generalità. Teoria di Werner. Atomi centrali e leganti.
Classificazione dei leganti. Numeri e geometrie di coordinazione. Distorsioni geometriche.
Nomenclatura dei composti di coordinazione. Isomeria. Complessi in soluzione e stabilità
termodinamica. Effetto chelato, macrociclico e criptato. Teoria HSAB.
•
Teoria del campo cristallino
Teoria del campo cristallino. Applicazione alle geometrie ottaedrica, tetraedrica, quadrata,
bipiramidale trigonale e piramidale quadrata. Effetti magnetici, strutturali e termodinamici.
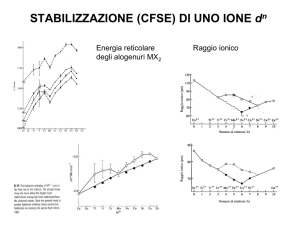
Il momento magnetico. CFSE. Distorsione Jahn-Teller. Serie spettrochimica.
Programma del corso
•
Teoria dell’orbitale molecolare per i complessi
Complessi ottaedrici con soli legami s e con legami s + p. Leganti p-donatori e p-accettori.
Razionalizzazione della serie spettrochimica.
•
Spettri elettronici dei complessi
L’accoppiamento di Russel-Saunders. I termini spettroscopici. I diagrammi di Orgel per
complessi ottaedrici e tetraedrici. Gli spettri dei complessi per le configurazioni d 1-d9.
•
Classificazione dei composti dei metalli di transizione
Principio di elettroneutralità. Composti in stato di ossidazione alto, intermedio e basso.
•
Composti dei metalli di transizione nei bassi stati di ossidazione
Leganti p-accettori. Metallo-carbonili. Cenni di organometallica.
•
Chimica dei metalli di transizione negli stati di ossidazione intermedi ed elevati
Elementi della prima serie di transizione: stati di ossidazione, chimica delle soluzioni
acquose, principali composti e complessi.
Esercitazioni di laboratorio
•
Complessazione dello ione Cu2+ da parte della tetraglicina (Spettroscopia UV-visibile)
•
La transizione dalla geometria ottaedrica alla planare quadrata in complessi chelati di Ni2+
(Spettroscopia UV-visibile)
•
Sintesi e caratterizzazione di complessi ottaedrici di Co3+ (Spettroscopia UV-visibile e
Spettroscopia IR)
•
Sintesi e caratterizzazione del complesso solido di Mn3+ [Mn(acetilacetonato)3]
(Spettroscopia IR, Analisi elementare)
•
Complessazione dello ione VO2+ da parte dell’acido 3,4-diidrossibenzoico (Spettroscopia
EPR)
•
Caratterizzazione delle specie Cr-CO con i metodi DFT (Simulazione al computer)
Biomolecole e ioni inorganici
• Il funzionamento della cellula (Na+, K+)
• L’emoglobina e la mioglobina (Fe2+)
• Le ferro-zolfo proteine (Fe2+ e Fe3+)
• I citocromi (Fe2+ e Fe3+)
• Gli enzimi (Fe, Cu, Mn, Zn, V, Co, Ni, Mo)
• La fotosintesi (Mg2+, Mn2+, Mn3+, Mn4+)
Elementi (metalli) di transizione
Metalli di transizione
Elementi che, allo stato elementare o in uno stato di ossidazione
significativo, hanno livelli d o f parzialmente occupati
Si considerano elementi di transizione anche Cu, Ag e Au (gruppo 11)
che hanno una configurazione elettronica (n-1)d10 ns1
•
Cu2+: 3d9
•
Ag2+: 4d9
•
Au3+: 5d8
•
Zn2+: 3d10
Metalli di transizione
•
Metalli con energia di atomizzazione elevata
•
Alti punti di fusione ed ebollizione
•
Elevata conducibilità (rame e argento sono i migliori conduttori di elettricità e calore)
•
Scarsamente reattivi in condizioni normali
•
Elevata durezza ed elevata densità
•
Proprietà catalitiche
•
Elevati potenziali di riduzione (alcuni si trovano in natura allo stato nativo)
•
Bassa elettronegatività (ma maggiore degli elementi dei gruppi I e II)
•
Numeri di ossidazione compresi fra 2 e 8
•
Gusci d o f parzialmente occupati
•
Danno spesso composti colorati
•
Formano spesso composti paramagnetici
Metalli di transizione
[FeIII(SCN)(H2O)5]2+
[CuII(NH3)4(H2O)2]2+
[CoII(SCN)4(H2O)2]2–
[CuIIBr4]2–
Metalli di transizione
Riempimento degli orbitali
Riempimento degli orbitali
•
L’orbitale 4s si estende rispetto al nucleo
più di quello 3d
•
L’orbitale 4s è più penetrante di quello 3d
•
Gli elettroni 4s schermano gli elettroni 3d
dalla carica nucleare
Riempimento degli orbitali
Riempimento degli orbitali
Riempimento degli orbitali
Riempimento degli orbitali
Configurazioni elettroniche
I serie di transizione
Elemento
Simbolo
Configurazione Elettronica
Scandio
Sc
[Ar]3d14s2
Titanio
Ti
[Ar]3d24s2
Vanadio
V
[Ar]3d34s2
Cromo
Cr
[Ar]3d54s1
Manganese
Mn
[Ar]3d54s2
Ferro
Fe
[Ar]3d64s2
Cobalto
Co
[Ar]3d74s2
Nichel
Ni
[Ar]3d84s2
Rame
Cu
[Ar]3d104s1
Zinco
Zn
[Ar]3d104s2
Configurazioni elettroniche
II e III serie di transizione
Y
Zr
Nb
Mo
Tc
Ru
Rh
4d15s2 4d25s2 4d45s1 4d55s1 4d55s2 4d75s1 4d85s1
Pd
4d10
Ag
Cd
4d105s1 4d105s2
La
Hf
Ta
W
Re
Os
Ir
Pt
Au
Hg
5d16s2 5d26s2 5d36s2 5d46s2 5d56s2 5d66s2 5d76s2 5d96s1 5d106s1 5d106s2
Configurazioni elettroniche degli ioni
Gli elettroni ns sono sempre rimossi prima di quelli (n-1)d
Esempi:
Co2+
[Ar]4s23d7
[Ar]3d7
Co3+
[Ar]4s23d7
[Ar]3d6
Cu2+
[Ar]4s13d10
[Ar]3d9
Configurazioni elettroniche degli ioni
V3+
3d2
Mn2+
3d5
Co2+
3d7
VO2+
3d1
Mn3+
3d4
Co3+
3d6
VO2+
3d0
Mn4+
3d3
Ni2+
3d8
Cr3+
3d3
MnO4
3d0
Cu+
3d10
CrO3+ 3d1
Fe2+
3d6
Cu2+
3d9
CrO42 3d0
Fe3+
3d5
Zn2+
3d10
Gli orbitali che si svuotano prima sono quelli s!!
Stati di ossidazione
Group 8 Metals
d3
21
d4
22
d5
d6
d7
d8
27
d 10
28
d 10s 1
23
24
25
Sc Ti
V
Cr
Mn Fe Co Ni
Cu
Scandium
Titanium
Vanadium
Chromium
Manganese
Iron
Cobalt
Nickel
Copper
39
40
41
42
43
44
45
46
47
Y
Zr
Nb Mo Tc Ru Rh Pd Ag
Yttrium
Zirconium
Niobium
Molybdenum Technetium
Ruthenum
Rhodium
Palladium
Silver
57
72
73
74
76
77
78
79
75
26
d9
29
La Hf
Ta W
Re Os Ir
Pt
Au
Lanthanum
Tantalum
Rhenium
Platinum
Gold
Hafnium
Tungsten
Osmium
Iridium
Primi gruppi
Ultimi gruppi
bassa elettronegatività
più elevate elettronegatività
più elevati stati di ossidazione
più bassi stati di ossidazione
Stati di ossidazione
• Lungo un periodo vi è una continua trasformazione nel
carattere degli orbitali d, che passano da orbitali di valenza
a orbitali inerti, via via che si aggiungono elettroni
• Nel I periodo, l'uso degli orbitali e degli elettroni d aumenta
fino al Mn e quindi diminuisce
Stati di ossidazione
•
Sc, Ti e V sono facilmente ossidati e i numeri di ossidazione più stabili sono quelli
corrispondenti agli elettroni esterni (+3, +4, +5)
•
Con Cr e Mn sono possibili i numeri di ossidazione più alti (+6, +7) ma essi tendono ad
essere ridotti
•
Con Fe, Co, Ni, Cu non sono più i valori massimi di gruppo (8-11) e diventano più stabili i
bassi stati di ossidazione (+1, +2, +3)
Stati di ossidazione
Stati di ossidazione
Dimensioni
Dimensioni
Energie di ionizzazione
I Energia di Ionizzazione
I Serie
II Serie
III Serie
Energie di ionizzazione
Punti di fusione e ebollizione
Punti di fusione e ebollizione
Composti di coordinazione (complessi)
I metalli di transizione formano una vasta classe di composti
in cui il metallo centrale agisce come acido di Lewis nei
confronti di una o più basi di Lewis per dare dei complessi
Complessi
Chimica dei composti di coordinazione
I complessi metallici vanno da semplici ioni
metallici idratati ai complicati metalloenzimi
[Fe(H2O)6]3+, [Cu(H2O)6]2+, Emoglobina, Citocromi
Composti di coordinazione (complessi)
Un composto di coordinazione è definito come un
composto in cui l'atomo centrale forma un numero di
legami maggiore del suo numero di ossidazione
Composto “normale”
Composto di coordinazione
CuBr2
[CuBr4]2–
FeCl3
[FeCl4]–
NiS
[Ni(NH3)6]2+
CoO
[Co(H2O)6]2+
Composti di coordinazione (complessi)
•
Diesbach (XVIII sec): KCN . Fe(CN)2 . Fe(CN)3 (blu di Prussia)
•
Tassaert (1798): CoCl3 . 6NH3 (cloruro luteocobaltico)
Complesso
Colore
Nome
Formulazione attuale
Sale di Reinecke
NH4[Cr(NH3)2(NCS)4]
Sale di Magnus
[Pt(NH3)4][PtCl4]
Co(NO2)3 . KNO2 . 2NH3
Sale di Erdmann
K[Co(NH3)2(NO2)4]
PtCl2 . KCl . C2H4
Sale di Zeise
K[Pt(C2H4)Cl3]
Cr(SCN)3 . NH4SCN . 2NH3
PtCl2 . 2NH3
Verde
CoCl3 . 6NH3
Giallo
Cloruro luteocobaltico
[Co(NH3)6]Cl3
CoCl3 . 5NH3
Porpora
Cloruro purpureo cobaltico
[Co(NH3)5Cl]Cl2
CoCl3 . 4NH3
Verde
Cloruro praseocobaltico
trans-[Co(NH3)4Cl2]Cl
CoCl3 . 4NH3
Violetto
Cloruro violeocobaltico
cis-[Co(NH3)4Cl2]Cl
CoCl3 . 5NH3 .H2O
Rosso
Cloruro roseocobaltico
[Co(NH3)5(H2O)]Cl3
Composti di coordinazione (complessi)
KCl + MgCl2 + 6H2O KCl · MgCl2 · 6H2O (carnallite)
CuSO4 + 4NH3 + H2O CuSO4 · 4NH3 · H2O (tetramminoaquorame(II) solfato)
Fe(CN)2 + 4KCN Fe(CN)2 · 4KCN (ferrocianuro di potassio)
•
Alcuni composti perdono la loro identità in soluzione (sali doppi)
•
Alcuni composti mantengono la loro identità in soluzione (complessi)
Composti di coordinazione (complessi)
Teoria di Werner (premio Nobel 1913)
•
Valenza primaria: carica dello ione metallico
•
Valenza secondaria: numero di ioni o molecole direttamente legati allo
ione metallico
•
La valenza secondaria ha una ben precisa direzionalità
•
Oggi, la valenza primaria si chiama numero di ossidazione, la
valenza secondaria numero di coordinazione
[CuII(NH3)4(H2O)]SO4
K4 [FeII(CN)6]
Teoria di Werner
CoCl3 . nNH3
Cl–
n. ioni
CoCl3 . 6NH3
giallo
3
4
[Co(NH3)6]Cl3
CoCl3 . 5NH3
porpora
2
3
[CoCl(NH3)5]Cl2
CoCl3 . 4NH3
verde
1
2
trans-[CoCl2(NH3)4]Cl
CoCl3 . 4NH3
violetto
1
2
cis-[CoCl2(NH3)4]Cl
CoCl3 . 3NH3
arancione
0
0
[CoCl3(NH3)3]
Il numero di ioni Cl– veniva determinato per titolazione gravimetrica con
Ag+, quello totale degli ioni in soluzione da misure di conducibilità
Teoria di Werner
Werner
Ioni
previsti
NH3
[Co(NH3)6]Cl3
[CoCl(NH3)5]Cl2
4
3
Ioni
previsti
Blomstrand-Jorgensen
Cl
NH3
Co
NH3
NH3
Cl
NH3
Cl
Co
NH3
NH3
Cl
4
NH3
NH3
NH3
NH3
Cl
3
NH3
NH3
NH3
NH3
Cl
2
Cl
Cl
[CoCl2(NH3)4]Cl
2
Co
Cl
Cl
[CoCl3(NH3)3]
0
NH3
Co
Cl
NH3
NH3
Cl
2
Teoria di Werner
CoCl3 . nNH3
Teoria di Werner
•
Nel 1798 B. M. Tassaert notò che soluzioni
di CoII in soluzione acquosa contenente NH3
diventavano scure in acqua e color rossovino per riscaldamento
•
Variando il rapporto di CoX2 (X = Cl, Br o
NO3), NH4X e NH3 si potevano ottenere
complessi come [Co(NH3)6]3+, [Co(NH3)5X]2+
e [Co(NH3)4X2]+
•
L’isolamento degli isomeri cis e trans del
complesso [Co(NH3)4X2]+ da parte di Werner
fu la prima prova della geometria ottaedrica
dei complessi
Teoria di Werner
Composti di coordinazione (complessi)
Un composto di coordinazione è un’entità formata da un
atomo centrale (positivo o neutro) al quale sono legati atomi o
gruppi di atomi (anioni o molecole neutre) chiamati leganti
• Atomo centrale: ione metallico (acido di Lewis)
es. Fe2+, Cu2+, Zn2+
• Legante: molecola o ione dotato di almeno un doppietto
elettronico da poter essere donato (base di Lewis)
es. :NH3, :PH3, H2O:, ammine, RCOO–, F–, Cl–, Br–, I–, RS–
Composti di coordinazione (complessi)
Una molecola (neutra o carica) dotata di un doppietto elettronico
(base di Lewis) può donarlo ad uno ione metallico o ad un altro
accettore di elettroni (acido di Lewis)
F
H
H
H
N
B
H
F
F
O
H
Cu
2+
Composti di coordinazione (complessi)
• Lo ione metallico con alta densità di carica positiva agisce
come acido di Lewis ed attrae elettroni
• I leganti (anionici o neutri) con alta densità di carica
negativa agiscono come basi di Lewis e cedono doppietti
elettronici liberi
Si forma un legame di coordinazione
tra uno ione metallico e un legante
Classificazione dei leganti
Leganti monodentati
• H2O
• NH3, ammine, imidazolo, piridina
• F–, Cl–, Br–, I–
• O2–, OH–, RO–, PhO–
• S2–, RS–
I leganti monodentati hanno un solo atomo donatore
Classificazione dei leganti
Leganti bidentati
NH2CH2CH2NH2
C2O42–
2,2’-bipiridina
(etilendiammina, en)
(ossalato, ox)
(bipy)
H H H H
NH2
H 2N
–
O
O
O
O–
N
N
• Possiedono più di un atomo donatore
• Sono chiamati anche chelanti (perché formano cicli o anelli
chelati)
Classificazione dei leganti
Leganti bidentati
NH3
H2N
NH3
H3N
Ni
2+
NH3
NH2
Ni2+
H2N
NH2
H3N
NH2
NH3
[Ni(NH3)6]
2+
[Ni(en)3]2+
NH2
Classificazione dei leganti
Leganti bidentati
Classificazione dei leganti
Leganti bidentati
Classificazione dei leganti
Leganti bidentati
H 2C
C H2
NH2
H2N
H2
C
H 2C
C H2
NH 2
H2C
NH2
H2N
N H2
H2
C
C H2
C H2
H2N
N H2
M
C H2
H 2C
NH2
NH 2
H 2C
H2C
M
CH2
H 2C
CH 2
H 2C
C H2
H 2N
NH 2
M
Classificazione dei leganti
R
O
Ciclo a tre termini
NR2
M
C
M
O
M
CH2
C
R
O
S
M
Ciclo a quattro termini
CCH3
M
O
H2
N
Ciclo a cinque termini
M
S
R
CH2
N CH2
H2
R
O
Ciclo a sei termini
C
M
CNR2
R
N
C
N
C
M
R
R
H
C
CH
O
C
N
M
O
R
R
Classificazione dei leganti
Leganti polidentati
H 2N
N
H
NH2
H 2N
N
H
N
H
dien (dietilentriammina)
trien (trietilentetraammina)
TRIDENTATO
TETRADENTATO
H 2N
N
H
N
H
N
H
tetren (tetraetilenpentaammina)
PENTADENTATO
NH2
NH2
Classificazione dei leganti
Leganti tridentati
CH2CH2NH2
O
N
O
NH
CH2CH2NH2
O
O
O
N
Leganti rigidi:
O
N
O
O
H
C
N
Coordinazione meridionaleN
R
C
O
OH
La struttura planare è obbligata
(manteni-
mento della coniugazione p che favorisce
la planarità dell’intero legante)
N
M
M
M
O
O
N
O
O
N
Leganti flessibili:
Coordinazione facciale (simmetrica o asimmetrica)
Classificazione dei leganti
Leganti polidentati
NH2
OH2
NH
NH2
NH
OH2
OH2
[Cu(en)(H2O)4]2+
NH2
NH
Cu
Cu
Cu
NH2
OH2
OH2
OH2
OH2
OH2
[Cu(dien)(H2O)3]2+
NH2
NH2
OH2
[Cu(trien)(H2O)2]2+
Classificazione dei leganti
Leganti polidentati
_
O
O
O
O
N
_
O
O
EDTA
Etilendiamminotetraacetato
N
O
_
O
_
L’EDTA è usato per sequestrare i metalli
Complesso dell’EDTA con il Ca2+: usato per determinare il calcio nelle acque
Complesso dell’EDTA con il Pb2+: usato per eliminare il piombo
Classificazione dei leganti
O
O
O
O
O
O
Na
O
O
O
O
O
O
18-crown-6
N
O
O
O
O
O
O
N
4,7,13,16,21,24-esaosso-1,10-diazabiciclo-[8,8,8]-esacosano (criptando-222)
Criptando-222
Classificazione dei leganti
Fe2+
– 2H+
Un complesso di
una porfirina col Fe
è denominato eme
Classificazione dei leganti
Leganti a ponte
• Leganti monodentati a ponte: un solo atomo legante che forma due
o tre legami con differenti atomi metallici (RO–, OH–, RS–, Cl–, Br–, I–)
• Leganti bidentati a ponte: leganti con più atomi potenzialmente
donatori (RCOO–)
R
R
R
–
O
Cu
–
O
S–
Cu
Fe
Fe
Cu
C
O–
Cu
Classificazione dei leganti
Leganti a ponte
Increasing polarizability
X
Strongest nucleophile
for low oxidation state
metals centers
F , Cl , Br , I
Primary Halides
M
X
2e- terminal
Terminale
2e–
X
X
M
M
– (-X o -X)
4e- 4e
-bridging
A ponte
2
M
M
M
6e3 -bridging
A ponte
6e– (3-X)
Classificazione dei leganti
Leganti a ponte
Classificazione dei leganti
Leganti a ponte
Rubredossina
Ferredossina batterica (3-S2–)
Ferredossina delle piante (2-S2–)
Classificazione dei leganti
COO–
C
O1
C
O2
M
O1
M
C
C
O2
M
O1
O1
O2
M
M
C
O1
O2
M
M
C
O1
O2
M
M
O2
M
M
Classificazione dei leganti
Leganti ambidentati
N3– e SCN–
3-1,1,1
-1,3
-1,1
-1,3